丹参提取物对脑外伤模型大鼠脑神经元SIRT1-FoxO1-自噬通路的影响
2020-03-25柳慧金
应 勇 柳慧金
脑外伤是一种由各种外力导致脑组织损伤的疾病。中药在治疗脑卒中及神经退行性疾病中占有重要地位。研究表明,丹酚酸B 或总丹酚酸A 可以改善脑缺血再灌注损伤小鼠的学习记忆障碍情况,对神经组织损伤有保护作用[1-2]。白藜芦醇[3]、姜黄素[4]等中药成分通过调节沉默信息调节因子1(silent information regulatorprotein,SIRT1)-叉头框蛋白O1(fork-head box O1,FoxO1)-自噬通路改善脑缺血损伤状况。本研究以SD 大鼠为对象制备脑外伤模型,向其腹腔注射丹参提取物(Salvia Miltiorr-hiza Extract,SME)或SIRT1 抑制剂(selisistat,EX-527)进行交叉实验,通过观察大鼠脑神经元损伤情况及SIRT1、FoxO1 的mRNA 和蛋白表达的影响,探讨SME 影响SIRT1-FoxO1-自噬通路改善大鼠脑外伤的可能机制。
1 实验材料
1.1 动 物 SPF 清洁级SD 大鼠78 只,雌雄各半,购自东南大学实验动物中心,实验动物生产许可证号:SCXK(苏)2017-0003,实验动物使用许可证号:SYXK(苏)2017-0041,动物质量合格证号:20180114,10 周龄,体质量为(220±20)g,12h/12h(白光/红光)下饲养,温度为(24±2)℃,相对湿度范围为37%~46%,自由饮食、饮水,定期更换垫料、饲料,经常清理、更换鼠箱,保持环境清洁、安静、通风良好。本动物实验经浙江省台州市第一人民医院伦理委员会审核,批文号:(伦审)2018-0004 号。
1.2 药物制备 丹参来自我院中药房(采购自亳州市谯城区众营种植专业合作社),经药剂科梁震野副主任药师鉴定后为正品。丹参药材粉碎呈粗粉后,加入75%乙醇加热回流提取5 次,定量滤纸过滤,合并滤液后常压蒸馏浓缩获得浓膏,再将浓膏在烘箱中90℃干燥,粉碎后获得SME。高效液相色谱测定所得SME 中丹参素平均含量为0.63mg/g。
1.3 主要试剂及仪器 超特敏电化学发光(ECL)试剂盒、尼氏焦油紫染液(上海碧云天生物技术有限公司,批号P0018AS、C0117);兔抗SIRT1 多克隆抗体(美国圣克鲁斯生物技术,批号sc-15404);兔抗Fox-O1 多克隆抗体(德国默克生命科学有限公司,批号SAB3500507);兔抗β-actin 多克隆抗体、HRP 标记羊抗兔IgG(英国abcam 公司,批号ab1801、ab5851);DAB 显色试剂盒(北京索莱宝科技有限公司,批号DA1010);TRIzol 试剂盒(赛默飞世尔科技有限公司,批号15596018);cDNA 反转录试剂盒(天根生化科技有限公司,批号KR202);ECL 显色试剂盒(上海翊圣生物科技有限公司,批号36208ES60);冰冻切片机(德国徕卡公司,型号:CM1950);倒置荧光显微镜(日本奥林巴斯公司,型号:IX73);RT-PCR仪(瑞士罗氏公司,型号:LightCycler 96)。
2 实验方法
2.1 动物分组 将SD 大鼠按照随机数字表法分为假手术组、模型组、SME 低、中、高剂量组和抑制剂组,每组13 只。
2.2 建模及给药 参照改良Feeney 法[5]进行建模,使用自制的自由落体打击器进行实验。打击器下方为大鼠头部固定装置,大鼠端脑正上方悬置金属套管,套管上端固定打击物,设置固定高度为30cm。向腹腔注射2%戊巴比妥钠(40mg/kg)对大鼠进行麻醉。完全麻醉后通过咬杆和耳杆将大鼠头部固定在自制打击器平台上,剪去头皮,用颅骨钻打开右侧颅骨,用2 号针头挑出硬脑膜,不挑开软脑膜。充分暴露脑组织,使用套管下端靠近暴露的脑组织,释放的打击物通过套管到达大鼠端脑软组织,从而导致右侧大脑半球局部脑挫裂伤。假手术组仅开天窗不实施打击。动物造模成功后,假手术组和模型组大鼠腹腔注射生理盐水2mL;SME 低、中、高剂量组大鼠分别腹腔注射0.75、1.50、3.00mg/kg 的SME;抑制剂组先按照1.50mg/kg 的SME 溶液给药,随后以5mg/kg剂量腹腔注射EX-527[6];各组注射体积均为2mL。每周称重1 次,根据体质量调整药量,每周注射1 次,注射持续4 周后进行后续实验。
2.3 冰冻切片及尼氏染色 每组各取3 只大鼠,对大鼠进行麻醉,进行心脏灌流。先灌入PBS,待右心耳流出清澈液体后开始灌入300mL 冰浴过的4%多聚甲醛,取大鼠脑投入4%多聚甲醛后4℃过夜,冠状切成小段,然后在20%、30%蔗糖溶液中梯度脱水。脱水完成后进行冠状面冰冻切片,切片厚度30μm。按照说明书步骤进行尼氏染色。经过脱水、封片、晾干步骤后,使用切片全景扫描系统获取染色后的切片图像(由武汉赛维尔生物科技有限公司提供)。
2.4 免疫组化检测大鼠脑组织SIRT1 和FoxO1 阳性细胞比例 取冰冻切片,将切片放入枸橼酸钠缓冲液(0.1mmol/L,pH=6.0)中。胎牛血清封闭,加一抗4℃过夜(一抗稀释比例均为1:500),加二抗37℃孵育1h 后,用DAB 试剂盒显色,显色过程中注意控制本底水平。冲洗掉DAB 残留后用苏木素再次复染、组织脱水透明、封片。SIRT1、FoxO1 阳性细胞计数:每个对象单个指标选4 张切片,单张切片再随机选择5 个不重叠视野(×400)进行拍照。
2.5 RT-PCR 检测大鼠脑组织SIRT1 和FoxO1 mRNA 表达量 每组各取4 只大鼠,取右侧脑组织剪碎,加入液氮进行组织研磨,4℃下分别加入TRIzol、氯仿、异丙醇、无RNA 酶水(0.1%焦碳酸二乙酯溶液)后以8000g 离心力离心10min 制备出总RNA,紫外分光光度计分析RNA 纯度和含量合格后,然后置于EP 管中反转录生成cDNA。取cDNA 作为定量模板,经历热循环,扩增后收集荧光信号,采用相对量化研究分析数值,计算方法为2-ΔΔct。所用引物由上海生工生物工程股份有限公司合成,见表1。
2.6 Western blot 检测大鼠脑组织SIRT1 和FoxO1蛋白表达 每组取6 只大鼠用于实验,将大鼠脑组织剪碎放入PE 管,加入陶瓷研磨珠和预冷的蛋白提取液放入研磨机中低温研磨。研磨后离心取上清液,用考马斯亮蓝法测总蛋白含量,再调整蛋白浓度至800μg/mL。等量加入上样缓冲液煮沸5min。冷却至室温后,4℃下保存备用。每孔加入50μg 蛋白样品进行凝胶电泳,半干后转至醋酸纤维素膜,室温封闭1h。加入一抗(稀释比例1:1000),4℃冰箱孵育过夜。加入二抗(1:1000),37℃反应2h,ECL 显色后显影仪曝光拍照。照片使用ImageJ 15.1 进行半定量分析。

表1 RT-PCR 引物序列及产物片段
2.7 统计学方法 实验数据应用SPSS 21.0 统计软件进行分析。计量资料采用均数±标准差()表示。各组间比较采用单因素方差(One-Way ANOVA)分析,两两比较采用SNK q 检验法。在免疫组化阳性细胞比例检测中,使用3σ 法剔除每个对象20 个观测值中的异常值后取均值作为该对象的计量值。以P<0.05 为差异有统计学意义。
3 结果
3.1 尼氏染色 假手术组大鼠脑组织神经元形态良好,尼氏小体染色清晰,胶质细胞结构完整,神经纤维排布紧密;模型组大鼠脑组织神经元变形严重,坏死细胞被全染,细胞核分布稀疏,外伤部位出现疏松水肿;SME 低剂量组脑组织有少量的血管充血,神经元变形坏死情况较模型组有明显改善,组织形态较为完整;SME 中、高剂量组大鼠脑组织神经元较低剂量组有一定改善,视野中未出现全染的损伤神经元;抑制剂组视野中出现个别全染损伤神经元,但总体神经元形态与SME 低剂量组差别不大,见插页图1。
3.2 免疫组织化学检测大鼠脑组织SIRT1 和FoxO1阳性细胞比例 与假手术组比较,模型组大鼠脑组织SIRT1 和FoxO1 阳性细胞比例均显著升高(P<0.05);与模型组比较,抑制剂组大鼠脑组织SIRT1 阳性细胞比例显著降低(P<0.05),SME 高剂量组大鼠脑组织SIRT1 和FoxO1 阳性细胞比例均显著升高(P<0.05);与抑制剂组比较,SME 低剂量组大鼠脑组织FoxO1 及中、高剂量组大鼠脑组织SIRT1 和Fox-O1 阳性细胞比例显著升高(P<0.05);与SME 低剂量组比较,SME 高剂量组大鼠脑组织SIRT1 阳性细胞比例显著升高(P<0.05)。见表2、插页图2-3。
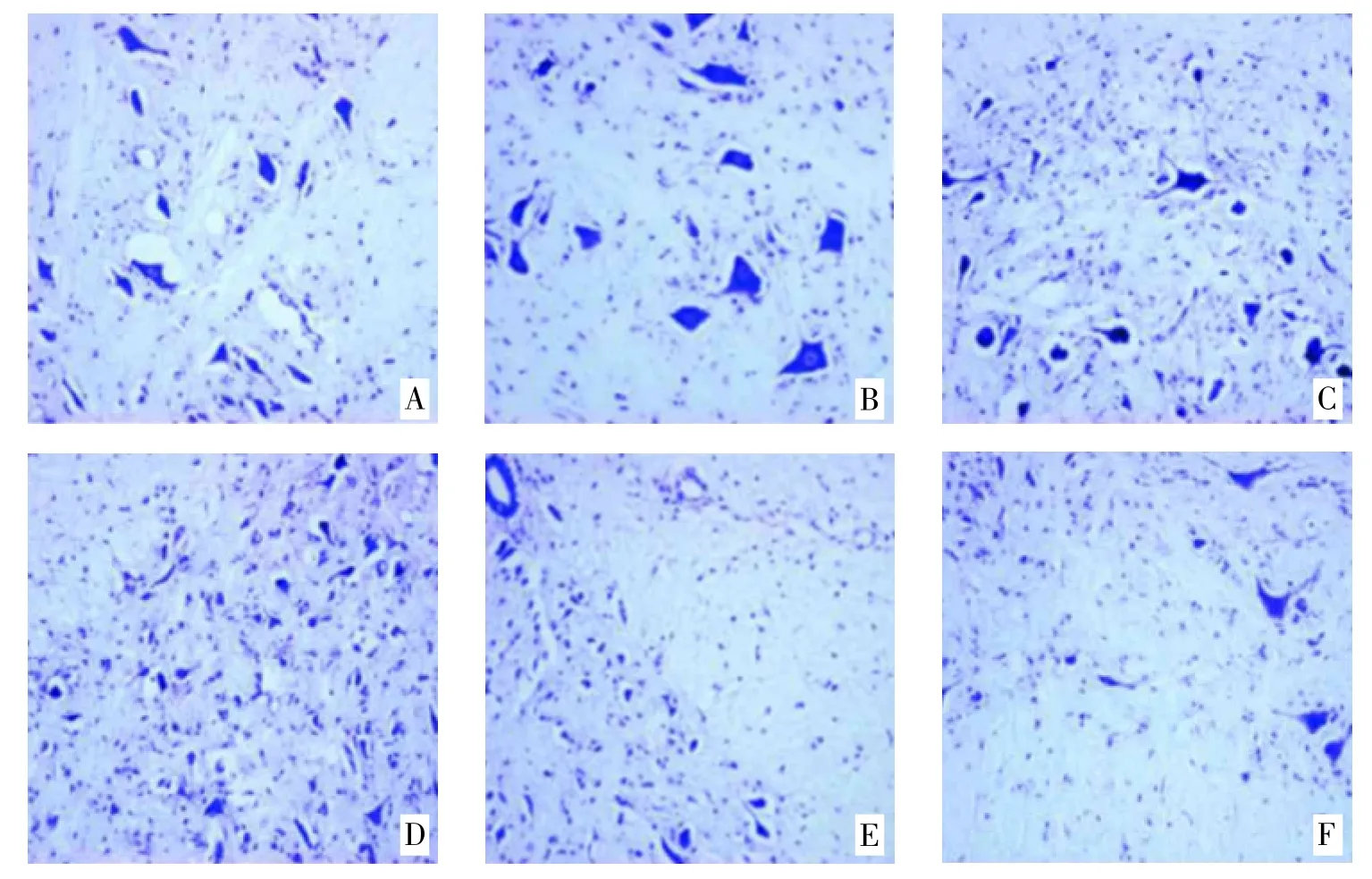
图1 大鼠右侧端脑冰冻切片结果(尼氏焦油紫染色,40×,n=3)
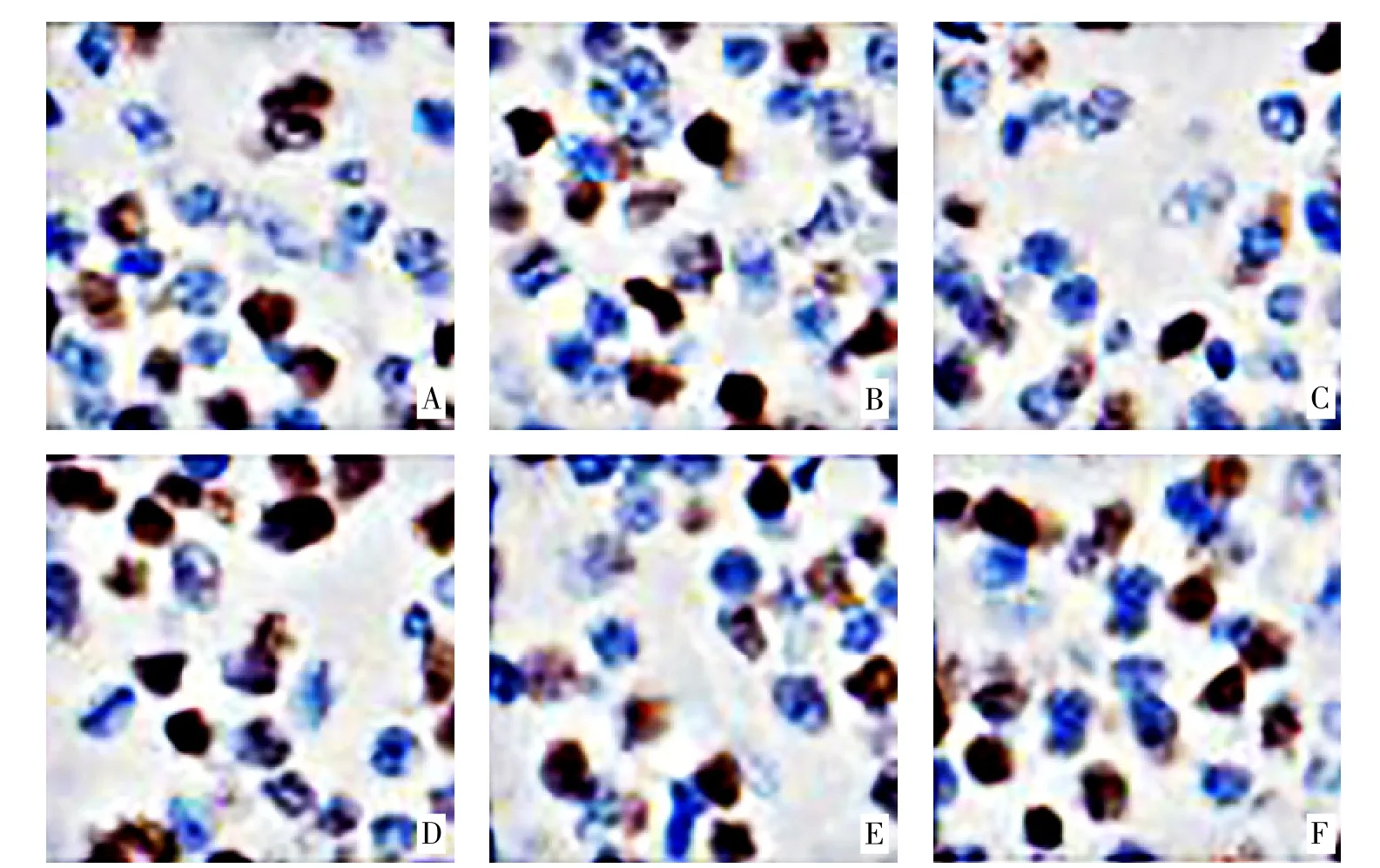
图2 大鼠右侧端脑冰冻切片SIRT1 免疫组化染色结果(400×,n=3)

图3 大鼠右侧端脑冰冻切片FoxO1 免疫组化染色结果(n=3,400×)
3.3 RT-PCR 检测大鼠脑组织SIRT1 和FoxO1 mRNA 水平变化 与假手术组比较,模型组大鼠脑组织SIRT1 和FoxO1 mRNA 表达显著升高(P<0.05);与模型组比较,抑制剂组大鼠脑组织SIRT1mRNA 表达显著降低(P<0.05),SME 高剂量组大鼠脑组织SIRT1 和FoxO1 mRNA 表达显著升高(P<0.05);与抑制剂组比较,SME 低、中、高剂量三组大鼠脑组织SIRT1 和FoxO1 mRNA 表达均升高(P<0.05);与SME 低剂量组比较,SME 中剂量组大鼠脑组织FoxO1、SME 高剂量组大鼠脑组织SIRT1 和FoxO1 mRNA 表达显著升高(P<0.05);与SME 中剂量组比较,SME 高剂量组大鼠脑组织SIRT1 和Fox-O1 表达显著升高(P<0.05)。见表3。
表2 各组大鼠脑组织SIRT1 及FoxO1 染色阳性细胞比例(%,)
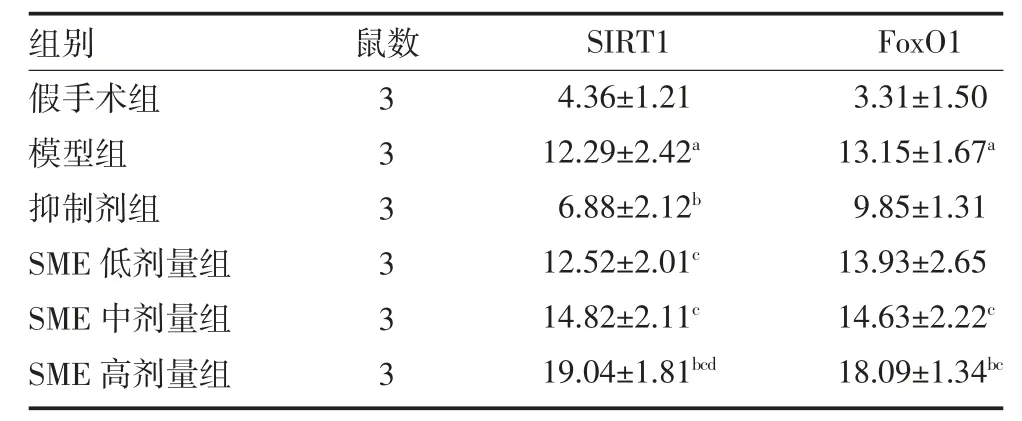
表2 各组大鼠脑组织SIRT1 及FoxO1 染色阳性细胞比例(%,)
注:假手术组和模型组予腹腔注射2mL 生理盐水;SME 低剂量组予腹腔注射0.75mg/kg SME;SME 中剂量组予腹腔注射1.50mg/kg SME;SME 高剂量组予腹腔注射3.00mg/kg SME;抑制剂组予腹腔注射1.50mg/kg SME+5mg/kg SIRT1 抑制剂;SME 为丹参提取物;SIRT1为沉默信息调节因子1;FoxO1 为叉头框蛋白O1;与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与抑制剂组比较,cP<0.05;与SME 低剂量组比较,dP<0.05
表3 各组大鼠脑组织SIRT1 及FoxO1 mRNA 表达水平变化()
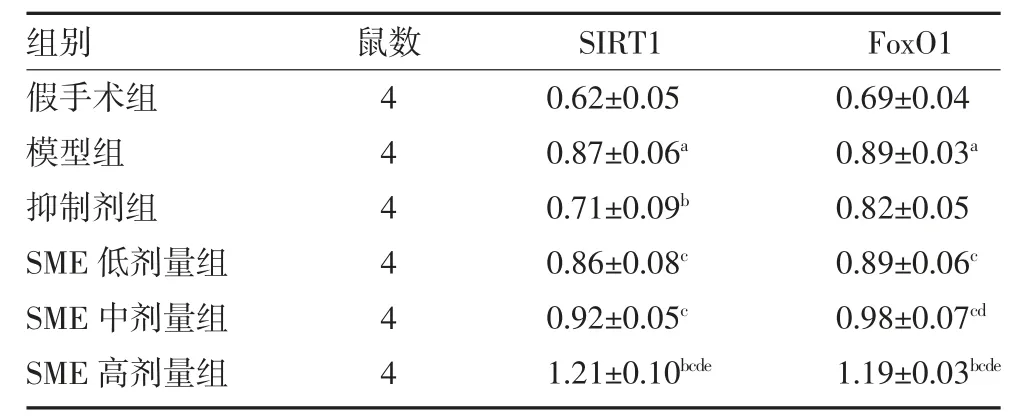
表3 各组大鼠脑组织SIRT1 及FoxO1 mRNA 表达水平变化()
注:假手术组和模型组予腹腔注射2mL 生理盐水;SME 低剂量组予腹腔注射0.75mg/kg SME;SME 中剂量组予腹腔注射1.50mg/kg SME;SME 高剂量组予腹腔注射3.00mg/kg SME;抑制剂组予腹腔注射1.50mg/kg SME+5mg/kg SIRT1 抑制剂;SME 为丹参提取物;SIRT1为沉默信息调节因子1;FoxO1 为叉头框蛋白O1;与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与抑制剂组比较,cP<0.05;与SME 低剂量组比较,dP<0.05;与SME 中剂量组比较,eP<0.05
3.4 Western blot 检测大鼠脑组织SIRT1 和FoxO1蛋白水平变化 与假手术组比较,模型组大鼠脑组织SIRT1 和FoxO1 蛋白表达量显著升高(P<0.05);与模型组比较,抑制剂组大鼠脑组织SIRT1 蛋白表达量显著降低(P<0.05),SME 低、中、高剂量三组大鼠脑组织SIRT1 和SME 高剂量组FoxO1 蛋白水平均显著升高(P<0.05);与抑制剂组比较,SME 低剂量组大鼠脑组织SIRT1 及SME 中、高剂量两组SIRT1和FoxO1 蛋白水平都显著升高(P<0.05);与SME 低剂量组比较,SME 中、高剂量两组大鼠脑组织的SIRT1 和SME 高剂量组FoxO1 蛋白水平显著升高(P<0.05)。见表4、插页图4。
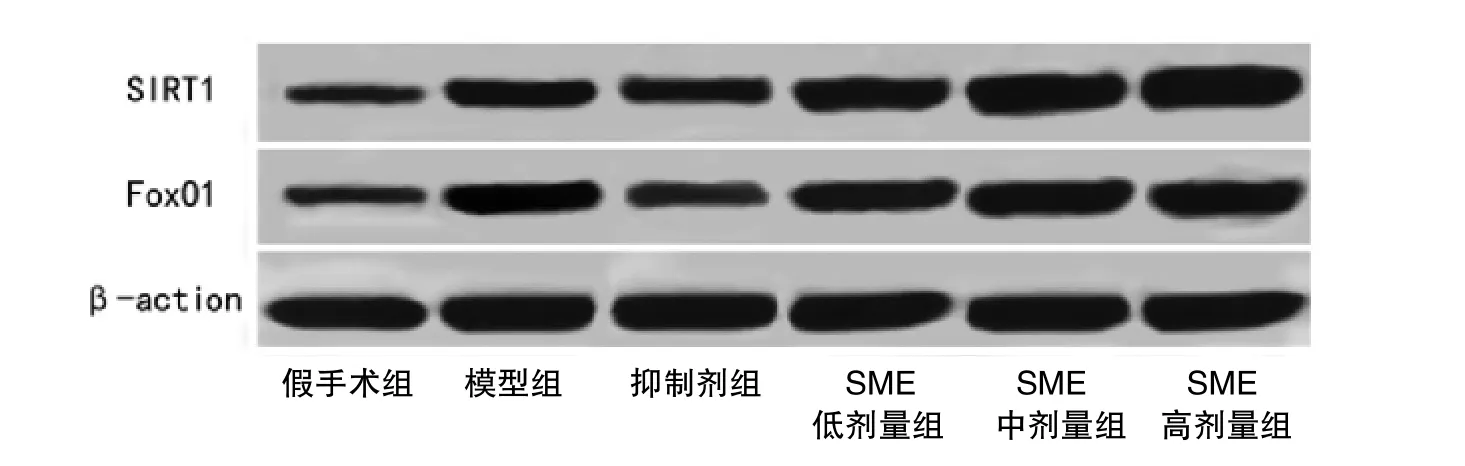
图4 各组大鼠STIR1 及FoxO1 Weston blot 结果
表4 各组大鼠脑组织STIR1 及FoxO1 蛋白表达相对强度值比较()
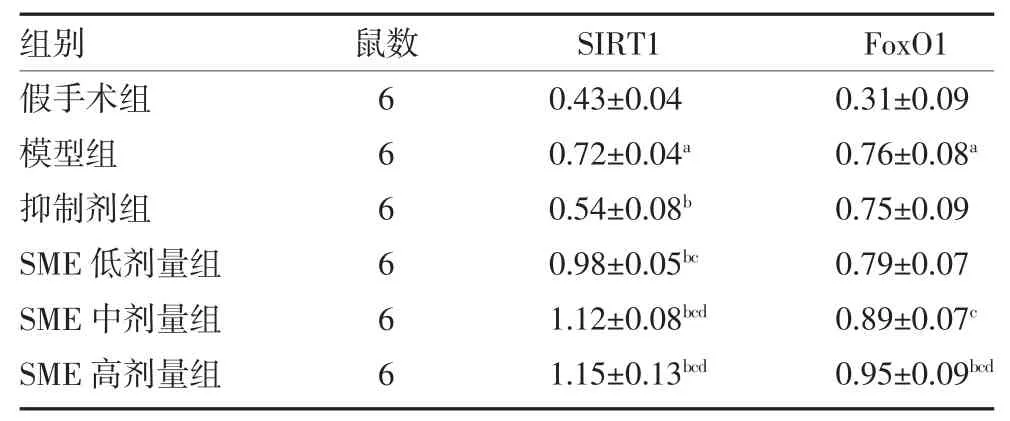
表4 各组大鼠脑组织STIR1 及FoxO1 蛋白表达相对强度值比较()
注:假手术组和模型组予腹腔注射2mL 生理盐水;SME 低剂量组予腹腔注射0.75mg/kg SME;SME 中剂量组予腹腔注射1.50mg/kg SME;SME 高剂量组予腹腔注射3.00mg/kg SME;抑制剂组予腹腔注射1.50mg/kg SME+5mg/kg SIRT1 抑制剂;SME 为丹参提取物;SIRT1为沉默信息调节因子1;FoxO1 为叉头框蛋白O1;与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与抑制剂组比较,cP<0.05;与SME 低剂量组比较,dP<0.05
4 讨论
自噬是细胞内重要的分解代谢过程,是机体在应对不良刺激如外伤、缺血、缺氧等应激状态下启动的一种自我保护机制,是细胞清除受损细胞器的主要途径。自噬在细胞中具有维持内环境稳定和结构重塑的重要作用[7]。脑组织受到机械、缺血、缺氧等损伤时,大量神经元的正常自噬,能够促进神经元受损后的存活[8]。因此,自噬在各种脑缺血、脑损伤发生及预后中具有重要作用。SIRT1 属于烟酰腺嘌呤二核苷酸依赖的类组蛋白去乙酰化酶,广泛存在于各组织细胞中。FoxO(叉头转录因子)是一类关键的调控因子,参与调节细胞周期和DNA 修复[9]。FoxO 还能够激活细胞的自噬活性,在分子水平上参与细胞的增殖分化等过程,其中又以FoxO1、FoxO3 的作用最为广泛[10]。FoxO1 蛋白活性受乙酰化、磷酸化和泛素化调节,其基因的转录激活也会受到SIRT1 等上游转录调控因子的乙酰化/去乙酰化调节。SIRT1 调节自噬是一个比较复杂的过程。目前研究发现,SIRT1 调节自噬的途径主要有两种:一是通过去乙酰化自噬相关基因的表达产物来直接影响自噬;二是位于细胞核内的SIRT1 通过激活FoxO1 基因诱导自噬[11]。也有研究表示,SIRT1 也能通过调控线粒体途径的自噬激活,维持神经元功能稳定[12]。本实验结果显示,模型组大鼠脑组织形态和神经元损伤程度比假手术组严重;SIRT1 和FoxO1 阳性细胞比例、mRNA 和蛋白表达量均显著高于假手术组(P<0.05)。Kou 等[13]研究指出,这种SIRT1 和FoxO1 升高现象可能是造模后大鼠脑外伤部位的缺血和营养剥夺激活了SIRT1-FoxO1-自噬通路,从而调控神经细胞自噬以保护神经功能。
丹参是临床常用中药,用于治疗瘀血诸症、疮痈肿毒热病、烦躁神昏以及心悸失眠等。SME 有减轻内皮损伤、抗炎、抗血小板聚集、调节糖脂代谢的作用[14]。其中丹参水溶性成分有很强的抗脂质过氧化和抗自由基能力[15]。而丹参酮IIA 等脂溶性成分则可以通过降低炎性因子水平来降低血压和改善心脏功能[16]。本实验结果显示,SME 处理组大鼠的脑组织形态和神经元损伤程度都比模型组有显著改善;SME 中、高剂量两组大鼠脑组织SIRT1 和FoxO1 的阳性细胞比例、mRNA 和蛋白表达量相比模型组都有不同程度升高(P<0.05),并且跟剂量呈正相关(P<0.05);可见其促进SIRT1 升高的效果同姜黄素和白藜芦醇的作用效果类似;虽然FoxO1 也可以通过p-AKT/FoxO1等其他通路进行调节,结果显示SIRT1 和FoxO1 随剂量变化趋势相同,这说明FoxO1 在大鼠脑组织中的表达受到SIRT1 的正向调控[17]。抑制剂组丹参注射液给药量与SME 中剂量组是相同的,但EX527 能抑制SIRT1 的去乙酰化作用。在抑制剂作用下抑制剂组的SIRT1 的mRNA 和蛋白水平显著低于模型组或SME 中剂量组(P<0.05),但FoxO1 的mRNA 和蛋白水平却与模型组和SME 中剂量组无显著差异(P>0.05)。据此推测SME 不仅能够促进SIRT1 的表达量升高,还能够增强SIRT1 的去乙酰化活性,从而使FoxO1 在mRNA 和蛋白表达量升高。在氧化应激、炎症反应等病理情况下,组织细胞常出现自噬活动的过度激活,而过度的自噬会引起细胞无法存活[18]。神经元自噬的发生与尼氏小体有关,在尼氏染色结果中我们还注意到,处理组切片的神经元尼氏小体的密度整体好于模型组[19]。这说明SME 能够有效保护处理组的神经元形态,使其不过度自噬。
综上所述,丹参注射液后处理能够促进脑外伤大鼠SIRT1 表达,增强SIRT1 的去乙酰化活性,正向调节SIRT1-FoxO1-自噬通路发挥神经保护作用。
