胃癌组织中miR-200a-3p、G3BP2的表达及意义
2020-03-25李晶晶王小云武政喜张宁程玉娥汤纳李睿
李晶晶,王小云,武政喜,张宁,程玉娥,汤纳,李睿
1石嘴山市第一人民医院,宁夏石嘴山 753600;2宁夏医科大学总医院
胃癌是全球男性中第四大常见癌症,在女性中排第五位,我国2012年发病约42万例,死亡达29.8万例[1]。近年来,随着诊断及治疗技术的发展,我国胃癌的病死率呈下降趋势,但多数患者确诊时已处于中晚期,同时伴有肿瘤局部侵袭和淋巴结转移,5年总体生存率仅为30%左右[2]。微小RNA(miRNA)是内源性非编码RNA,长度为20~24个核苷酸,能通过结合靶基因的3′端非编码区(UTR),影响靶基因的信使RNA稳定性,调控多条细胞内信号传导通路,在炎症、肿瘤、心血管等疾病中均发挥重要的调节作用[3]。miR-200a-3p位于人类染色体1p36.33,在肾细胞癌[4]、肝细胞肝癌[5]等肿瘤中异常表达,可通过影响靶基因CBL、CDK6等基因表达,影响肿瘤的发生发展。GTP酶激活蛋白SH3功能区结合蛋白2(G3BP2)基因位于人类染色体4q21.1,有17个外显子。该基因编码的G3BP2蛋白能与p53和E3泛素连接酶结合,促进p53的类泛素化,导致p53自细胞核移出[6],削弱其抑癌作用,促进肿瘤细胞增殖。研究表明,多种miRNA,如miR23b等均可参与对G3BP2表达的调控过程,影响肿瘤的发生发展[7]。2015年1月~2019年1月,我们检测了胃癌组织中miR-200a-3p及G3BP2表达,探讨二者在胃癌发生发展中的临床意义。
1 资料与方法
1.1 临床资料 选取2015年1月~2016年1月于我院接受手术治疗的97例胃癌患者。纳入标准:①均经术后病理检查确诊为胃腺癌;②首次诊治,既往未接受过化疗、放疗等抗肿瘤治疗;③临床病理资料完整,患者或其家属均知情同意并签署知情同意书;④患者一般健康状况良好,术后随访资料完整。排除标准:①合并其他胃恶性肿瘤(如平滑肌肉瘤等),其他原发性恶性肿瘤,如原发性肝癌、肾癌等;②合并严重的心肝肺肾等脏器功能不全。其中男52例、女45例,年龄19~71(58.2±8.1)岁;伴淋巴结转移50例,无淋巴结转移47例;肿瘤直径:<5 cm者63例,≥5 cm者34例;肿瘤位置:贲门胃底部、胃体部31例,幽门胃窦部66例;肿瘤TNM分期:Ⅰ、Ⅱ期59例,Ⅲ、Ⅳ期38例;组织学分化程度:高中分化45例,低分化52例;浸润深度:达深肌层及浆膜层62例,黏膜下层及浅肌层35例。
1.2 癌组织中miR-200a-3p及G3BP2表达的检测方法 应用实时荧光定量PCR(qRT-PCR)法检测癌组织及其配对的癌旁正常组织(距肿瘤组织边缘5 cm以上,且病理检查未见肿瘤细胞)中miR-200a-3p及G3BP2mRNA的表达。取约50 mg组织,液氮中研磨,加入1 mL TRIzol充分裂解细胞,严格按照试剂盒说明书操作步骤提取组织中总RNA,溶于DEPC水中,紫外分光光度计检测总RNA的浓度及纯度,OD260/OD280介于1.9~2.1。以总RNA为模板,应用逆转录试剂盒进行对总RNA反转录,合成cDNA。按照BIOMIGA公司SYBR Green试剂盒说明书配制qRT-PCR反应体系。miR-200a-3p特异性茎环引物正向引物:5′-ACTCAACGTGCAAGCCTCG-3′,反向引物:5′-GCTCAAGAAAGTGCTGATCCC-3′,miR-200a-3p的内参U6正向引物:5′-ACCAGGACCAGAGGAAACCT-3′,反向引物:5′-GCTAGCCTCTGGATT-3′;G3BP2正向引物:5′-GTAGGGCGGGAGTTTGTGAG-3′,反向引物:5′-CTGGGGCTTTCCACTAGCATC-3′,G3BP2的内参基因GAPDH正向引物:5′-CTGGGCTACACTGAGCACC-3′,反向引物:3′-AAGTGGTCGTTGAGGGCAATG-5′。反应条件:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火1 min,72 ℃延伸30 s,变性、退火及延伸过程共40个循环。每个样本设3个复孔。采用相对Ct值方法进行数据分析,miR-200a-3p及G3BP2的相对表达量以2-ΔCt法表示,其中ΔCt=CtmiR-200a-3p/G3BP2-CtGAPDH。
1.3 随访 以门诊或电话方式对患者进行随访,随访起始时间为手术日起,每3个月随访1次,随访终止时间为2019年1月。随访终点为患者死亡或随访结束。统计患者复发及生存情况。
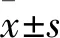
2 结果
2.1 胃癌组织与癌旁正常组织中miR-200a-3p及G3BP2表达比较 胃癌组织与癌旁正常组织中miR-200a-3p相对表达量分别为0.375±0.082、1.106±0.122,G3BP2相对表达量分别为3.757±0.930、1.041±0.345。胃癌组织中miR-200a-3p相对表达量低于癌旁正常组织(t=48.977,P=0.000),而G3BP2相对表达量高于癌旁正常组织(t=26.967,P=0.000)。
2.2 胃癌组织中miR-200a-3p、G3BP2表达与患者临床病理特征的关系 癌组织中miR-200a-3p、G3BP2表达与肿瘤TNM分期及组织分化程度有关(P均<0.05),而与患者年龄、性别、肿瘤大小、肿瘤位置及淋巴结转移无关(P均>0.05)。见表1。

表1 胃癌组织中miR-200a-3p、G3BP2表达与患者临床病理特征的关系
2.3 胃癌组织中miR-200a-3p与G3BP2表达的关系 Pearson线性相关分析显示,胃癌组织中miR-200a-3p与G3BP2表达呈负相关(r=-0.610,P=0.008)。
2.4 胃癌组织中不同miR-200a-3p、G3BP2表达与生存预后的关系 截至2019年1月,所有患者随访2~36个月,中位随访时间25.3个月。随访过程中无失访病例,随访期间死亡37例,17例为术后出现肿瘤复发转移,20例为肿瘤进展死亡。以miR-200a-3p相对表达量的平均数0.375为界值,其中miR-200a-3p高表达组47例,miR-200a-3p低表达组50例。miR-200a-3p高表达组3年总体生存率(OS)为80.9%(38/47),miR-200a-3p低表达组3年OS为44.0%(22/50)。Kaplan-Meier生存分析结果显示,miR-200a-3p低表达组患者3年OS低于miR-200a-3p高表达组(χ2=13.994,P=0.002)。以G3BP2相对表达量的平均数3.757为临界值,其中G3BP2高表达组48例,G3BP2低表达组49例。G3BP2高表达组3年OS为52.1%(25/48),G3BP2低表达组3年OS为71.4%(35/49),Kaplan-Meier生存分析结果显示,G3BP2高表达组3年OS低于G3BP2低表达组(χ2=4.047,P=0.044)。
3 讨论
我国是胃癌发病率较高的国家之一,发病和死亡例数约占全球病例数的50%[8]。早期胃癌局限于黏膜层或黏膜下层,淋巴结转移率低,手术治疗预后较好,5年存活率达90%以上。胃癌早期临床症状不典型,多数患者就诊时已为中晚期,单纯手术治疗效果差,常需放化疗、靶向治疗及免疫治疗等多学科综合性治疗,但治疗有效率低,患者生存预后较差[9]。
miRNA是长度20~25个核苷酸的非编码RNA分子,在肿瘤发生发展过程中,miRNA能调控肿瘤细胞的细胞周期、细胞凋亡、侵袭、转移及耐药性的产生等,有可能成为肿瘤诊断、治疗及预后的生物学靶点[10]。miRNA具有肿瘤促进和肿瘤抑制两种功能,miRNA能通过结合靶基因信使RNA 5′端结合,改变信使RNA的稳定性,调控基因表达。近年来,在肝癌、肾癌等肿瘤中均发现miR-200a-3p表达降低的现象,并能通过调控反向靶基因的表达,促进肿瘤的恶性进展。如在肾细胞癌中miR-200a-3p能通过靶向抑制癌基因精子相关抗原9的表达,抑制肿瘤细胞的增殖,并诱导细胞凋亡,发挥肿瘤抑制功能[11]。本研究结果显示,胃癌组织中miR-200a-3p的相对表达量低于癌旁正常组织,差异有统计学意义,原因可能是长链非编码RNA,如小核仁RNA宿主基因15(SNHG15)作为内源竞争性RNA,竞争性抑制miR-200a-3p表达及功能,促进反向Yes相关蛋白1(YAP1)-Hippo信号通路活化,导致肿瘤进展[12]。此外,胃癌组织中miR-200a-3p表达与肿瘤TNM分期、组织分化有关,表明癌组织中miR-200a-3p表达参与肿瘤的发生发展。其机制可能是miR-200a-3p能通过结合并抑制上皮间质转化相关基因的表达,如E-钙黏蛋白、转录因子ZEB1和ZEB2等,抑制上皮表型向间质表型转化。本研究结果显示,miR-200a-3p低表达组3年OS低于miR-200a-3p高表达组,表明miR-200a-3p可提示患者预后。
G3BP2是RNA结合蛋白家族的成员,参与特异性信使RNA的稳定和降解,调控靶基因的翻译过程,参与病毒感染、细胞应激调节及肿瘤恶性进展等过程的调控[13]。近年来研究表明,G3BP2在乳腺癌[14]、前列腺癌[15]等肿瘤中存在表达升高的现象。本研究中,胃癌组织中G3BP2的相对表达量高于癌旁组织,其机制可能与抑制其表达的miRNA,如miR-1178表达降低有关。正常状态时,miR-1178通过结合G3BP2的UTR,促进信使RNA降解,而在肿瘤发生后,miR-1178表达降低,导致G3BP2表达显著升高[16]。此外,低分化、肿瘤分期Ⅲ、Ⅳ期癌组织中G3BP2表达较高,表明癌组织中G3BP2表达可能参与胃癌的发生发展。其原因可能是肿瘤发生时,α-细小蛋白表达降低,G3BP2能直接结合并活化上皮间质转化关键转录因子Twist,促进反向信号传导,促进肿瘤细胞的恶性增殖及向上皮表型转化[17]。此外,本研究中,G3BP2高表达组3年OS较G3BP2低表达组低,表明G3BP2能提示胃癌患者预后。本研究结果显示,胃癌组织中G3BP2与miR-200a-3p表达呈负相关关系,其机制目前尚不清楚,可能是miR-200a-3p能结合上皮间质转化的关键转录因子,如ZEB1、TWIST等的启动子区,抑制转录因子表达[18]。
综上所述,胃癌组织中G3BP2表达升高,而miR-200a-3p表达降低,二者联合检测有助于患者病情判断及预后评估。
