7种硒化多糖抗氧化活性的比较
2020-03-23高珍珍张超景丽荣胡元亮
高珍珍,张超,景丽荣,胡元亮
(1. 内蒙古农业大学兽医学院,内蒙古 呼和浩特 010018;2. 南京农业大学动物医学院,江苏 南京 210095 )
近年来,大量研究已经证实中药多糖具有促进免疫调节[1]、抗氧化[2]、抗肿瘤[3]和抗病毒[4]等多种生物活性。相关研究发现,多糖的生物活性与其空间结构密切相关,经物理、化学等手段对其结构进行适当的修饰后,可获得更高药理活性的多糖衍生物[5]。硒是生命活动所必需的微量元素之一,构成若干氧化酶的活性中心,可增强机体的抗氧化能力和对疾病的抵抗能力[6]。其存在形式有无机硒和有机硒两种,相对于无机硒,有机硒具有易被机体吸收,毒性低,副作用小的特点,更安全、高效[7]。硒多糖作为有机硒的一种,天然获得产量很低,不能满足需求,通过化学合成的硒多糖,既可保持多糖的基本构型和生理功能,又能有效的提高硒的生物利用度,发挥微量元素元素硒和多糖的双重功能[8]。
本研究室在前期研究中,通过活性追踪、正交设计和活性比较手段筛选出抗氧化活性较强的7种硒化多糖,硒化五味子多糖sSCP1、硒化当归多糖sCAPS2、硒化百合多糖sLP2、硒化党参多糖sCCPS5、硒化白术多糖sAMP6、硒化枸杞多糖sLBP6、硒化淫羊藿多糖sEMP7及最佳修饰条件[9-11]。本试验通过体外试验比较7种硒化多糖的体外抗氧化活性,筛选出效果较好的3种硒化多糖,并设置高、中、低3个浓度进一步比较它们的体内抗氧化活性。本试验旨在筛选出抗氧化活性较好的硒化多糖及最佳剂量,为研制硒多糖抗氧化增强剂提供理论依据。
1 材料与方法
1.1 硒化多糖准备
分别按前期研究制备7种硒化多糖,sSCP1(硒化五味子多糖,制备条件为:每500 mg多糖加亚硒酸钠200 mg、50 ℃反应6 h;得率41.23%,糖含量56.83%,硒含量5.41 mg·g-1)、sCAPS2(硒化当归多糖,制备条件:每500 mg多糖加亚硒酸钠200 mg、70 ℃反应8 h,得率36.80%,糖含量50.9%,硒含量12.98 mg·g-1)、sLP2(硒化百合多糖,制备条件:每500 mg多糖加亚硒酸钠400mg、70 ℃反应6 h;得率50.28%,糖含量54.21%,硒含量24.73 mg·g-1)、sCCPS5(硒化党参多糖,制备条件:每500 mg多糖加亚硒酸钠300 mg、70 ℃反应8 h;得率29.12%,糖含量56.2%,硒含量11.86 mg·g-1)、sAMP6(硒化白术多糖,制备条件:每500mg多糖加亚硒酸钠400 mg、70 ℃反应10 h;得率25.18%,糖含量44.21%,硒含量10.45 mg·g-1)、sLBP6(硒化枸杞多多糖,制备条件:每500 mg多糖加亚硒酸钠400 mg、70 ℃反应6 h;得率35.84%,糖含量47.5%,硒含量13.66 mg·g-1)、sEPS7(硒化淫羊藿多糖,制备条件:每500 mg多糖加亚硒酸钠400mg、 50 ℃反应10 h;得率30.90%,糖含量34.44%,硒含量3.53 mg·g-1)。将7种硒化多糖按糖含量分别用蒸馏水倍比稀释成5个浓度(1、0.5、0.25、0.125、和0.0625 mg·mL-1),将sCAPS2、sAMP6和sLBP6稀释成0.05 mg·mL-1、0.1 mg·mL-1和0.15 mg·mL-1,Na2SeO3稀释成10 μg·mL-1,煮沸30 min灭菌,4 ℃保存备用。
1.2 主要试剂
三羟甲基氨基甲烷(Tris),Sanland-chemInternationalInc 公司。1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-picrylhydrazyl radical 2,2-Diphenyl-1-(2,4,6-trinitro- phenyl) hydrazyl, DPPH),Sigma 公司。水杨酸、乙醇、七水合硫酸亚铁、过氧化氢、铁氰化钾等均为国产分析纯。谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒、超氧化物歧化酶(SOD)检测试剂盒、丙二醛(MDA)检测试剂盒和总抗氧化能力(T-AOC)检测试剂盒,购自南京建成生物工程研究所。
1.3 体外试验
1.3.1 羟自由基清除试验
取164支试管,分为硒化多糖组、硒化试剂Na2SeO3组和空白对照组,分别加入倍比稀释好的各浓度硒化多糖和硒化修饰试剂Na2SeO3组(1、0.5、0.25、0.125、0.062 5 mg·mL-1)2 mL,每组4个重复,在每个试管中先加入9 mmol·L-1FeSO42 mL,再加入9 mmol·L-1的水杨酸-乙醇溶液 2 mL,各浓度硒化多糖及硒化修饰试剂Na2SeO32mL,8.8 mol·L-1过氧化氢2 mL启动整个反应,用蒸馏水代替硒化化多糖和硒化修饰试剂Na2SeO3作为空白对照组。37 ℃反应30 min后,以蒸馏水代替多糖溶液做空白调零,用754型紫外分光光度计测定510 nm处测定硒化多糖组和硒化修饰试剂Na2SeO3组(Ax)及空白对照组(A0)的吸光度。用下式计算羟自由基清除率,羟自由清除率=(1-Ax/A0)×100%。
1.3.2 DPPH自由基清除试验
取168支试管,分为硒化多糖组、硒化试剂Na2SeO3组、DPPH对照组和空白对照组,加入倍比稀释好的各浓度硒化多糖和硒化修饰试剂Na2SeO3组(A1)(1、0.5、0.25、0.125、0.062 5 mg·mL-1)0.5 mL,置10 mL试管中,加入2.5 mL 的DPPH 溶液,每组4个重复,硒化多糖和硒化修饰试剂Na2SeO3对照组(A2)以2.5 mL无水乙醇代替多糖;DPPH 对照组(A0)以2.5 mL无水乙醇代替DPPH。室温避光放置30 min 后,用无水乙醇调零,测的517nm处的吸光值A1、A2和A0,清除率=[1-(A1-A2)/A0]×100%。
1.3.3 ABTS自由基清除试验
取164支试管,分为硒化多糖组、硒化试剂Na2SeO3组和空白对照组,分别加入倍比稀释好的各浓度硒化多糖和Na2SeO3组(1、0.5、0.25、0.125、0.062 5 mg·mL-1)10 μL,再加入ABTS自由基溶液2 mL(以1∶200 比例)每组4个重复。室温下反应6 min,反应结束后用分光光度计测定734 nm波长处的吸光度值(Ax)和空白对照组(A0)的吸光度值。按以下公式计算ABTS自由基清除率:清除率=(1-Ax/A0)×100%。
1.4 体内试验
取6周龄ICR小鼠288只,随机均分为12组,雌雄各半,适应性饲养1周后,除空白对照组外用OVA进行免疫,2周后二免。在首次免疫的同时,9个硒化多糖组分别灌胃0.05 mg·mL-1、0.1 mg·mL-1和0.15 mg·mL-1的sCAPS2、sLBP6和sAMP60.4 mL,硒化试剂组灌胃Na2SeO3的5 μg·mL-10.4 mL,免疫对照组(M)和空白对照组(K)灌胃等量生理盐水,1次/d,连续3 d。分别于首免后第7、21和35天(D7、D21和D35)每组随机抽取8只,摘眼球采血,分离血清,测定T-AOC、GSH-Px 和SOD的活性和MDA的含量,剖检,取肝脏固定,石蜡切片,HE染色,观察组织学变化。
1.5 数据分析
数据以Means±SE表示,用SPSS20.0软件进行方差分析和多重比较。当P<0.05时,为差异显著。
2 结果
2.1 体外试验
2.1.1 各组羟自由基清除率的变化
结果见图1。在1 mg·mL-1时,除sSCP1外各硒化多糖组的羟自由基清除率均显著高于Na2SeO3组(P<0.05),sCAPS2组最高,与sLBP6组差异不显著;在0.5 mg·mL-1时,各硒化多糖组的清除率均显著高于Na2SeO3组(P<0.05),sLBP6组最高,sCAPS2组次之,sAMP6组再次之,三组之间差异不显著;在0.25 mg·mL-1时,sCAPS2、sCCPS5、sAMP6和sLBP6组的清除率显著高于其他各组(P<0.05);在0.125 mg·mL-1时,sCAPS2、sCCPS5、sAMP6和sLBP6组的清除率显著高于其他各组(P<0.05);在0.0625 mg·mL-1时,sCAPS2、sCCPS5和sAMP6组的清除率均显著高于Na2SeO3组(P<0.05),sCAPS2组最高,sLBP6组的差异不显著。
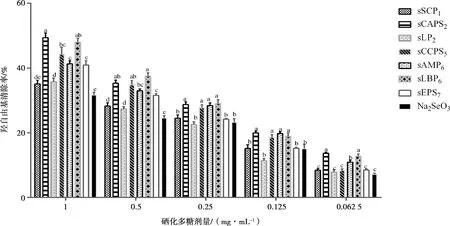
注:同一剂量组间比较,字母不同表示差异显著(P<0.05),字母相同表示差异不显著(P>0.05)。下同
图1 各组的羟自由基清除率
2.1.2 各组DPPH自由基清除率的变化
结果见图2。在1 mg·mL-1时,各硒化多糖组的DPPH自由基清除率均显著高于Na2SeO3组(P<0.05),sCAPS2组最高,显著高于其它各组(P<0.05);在0.5 mg·mL-1时,各硒化多糖组除sLP2外的清除率均显著高于Na2SeO3组(P<0.05),sLBP6组最高,显著高于其它各组(P<0.05);在0.25 mg·mL-1时,sCAPS2、sCCPS5和sLBP6组的清除率显著高于其他各组(P<0.05);在0.125 mg·mL-1时,sCAPS2和sLBP6组的清除率显著高于其他各组(P<0.05);在0.062 5 mg·mL-1时,sCAPS2和sLBP6组的清除率均显著高于其它各组(P<0.05),sLBP6组最高,与sCAPS2组差异不显著。
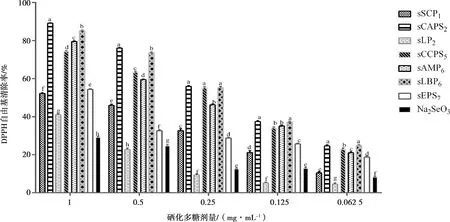
图2 各组的DPPH自由基清除率
2.1.3 各组ABTS自由基清除率的变化
结果见图3。在1 mg·mL-1时,各硒化多糖组的ABTS自由基清除率均显著高于Na2SeO3组(P<0.05),sLBP6组最高,但与sCAPS2组差异不显著,两组均显著高于其它各组(P<0.05);在0.5 mg·mL-1时,各硒化多糖组的清除率均显著高于Na2SeO3组(P<0.05),sCAPS2组最高,与sLBP6组差异不显著,两组均显著高于其它各组(P<0.05);在0.25 mg·mL-1时,各硒化多糖组的清除率均显著高于Na2SeO3组(P<0.05),sCAPS2组最高,与sLBP6组差异不显著,两组均显著高于其它各组(P<0.05);在0.125 mg·mL-1时,各硒化多糖组对ABTS自由基的清除率均显著高于Na2SeO3组(P<0.05),sCAPS2组显著高于其他各组(P<0.05);在0.0625 mg·mL-1时,各硒化多糖组的清除率均显著大于Na2SeO3组(P<0.05),sCAPS2组显著高于其他各组(P<0.05)。
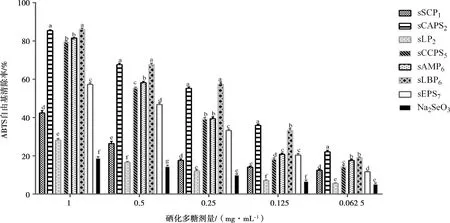
图3 各组的ABTS自由基清除率
2.2 体内试验
2.2.1 各组血清T-AOC活性的变化
各组血清T-AOC含量的变化见表1。在D7,各硒化多糖组的血清T-AOC含量均显著高于免疫对照组和空白对照组(P<0.05),sLBP6H组最高、显著高于其它各组(P<0.05);在D21,各硒化多糖组的血清T-AOC含量显著高于免疫对照组和空白对照组(P<0.05),sLBP6H组显著高于其它各组(P<0.05));在D35,各硒化多糖组除sCAPS2L、sAMP6L的血清T-AOC含量显著高于免疫对照组和空白对照组(P<0.05),sLBP6H组最高,显著高于除sCAPS2M和sLBP6M组外的其它各组(P<0.05)。
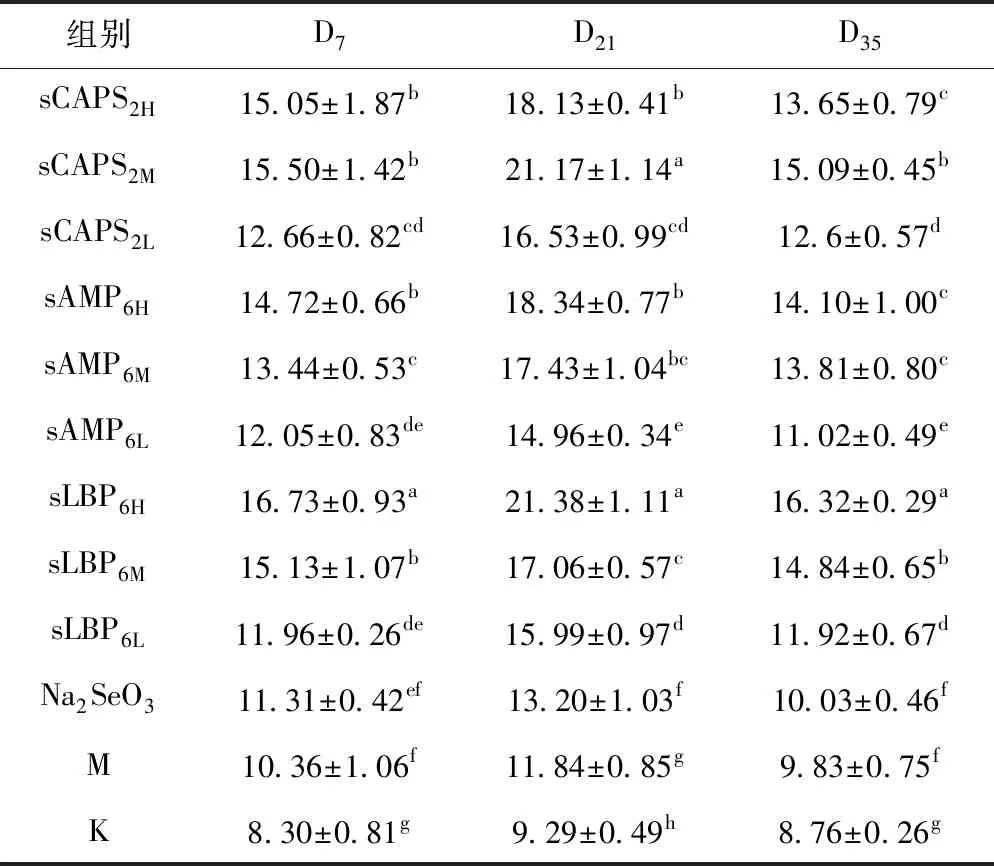
表1 各组血清T-AOC活性的变化 U/mL
注:同列数据标不同字母者差异显著(P<0.05)。下同
2.2.2 各组血清GSH-Px活性的变化
各组血清GSH-Px活性的变化见表2。在D7,各硒化多糖组的血清GSH-Px活性均显著高于免疫对照组和空白对照组(P<0.05),sLBP6H组显著高于其它各组(P<0.05);在D21,各硒化多糖组的血清GSH-Px活性显著高于免疫对照组和空白对照组(P<0.05),sLBP6H组最高且显著高于其它各组(P<0.05);在D35,各硒化多糖组的血清GSH-Px活性显著高于免疫对照组和空白对照组(P<0.05),sAMP6H组最高且显著高于除sLBP6H组外的其它各组(P<0.05)。
2.2.3 各组血清SOD活性的变化
各组血清SOD活性的变化见表3。在D7,各硒化多糖组的血清SOD活性均显著高于免疫对照组和空白对照组(P<0.05),sCAPS2M组最高,其次为sCAPS2H和sLBP6H组,这三组显著高于其它各组(P<0.05);在D21,各硒化多糖组的血清SOD活性显著高于免疫对照组和空白对照组(P<0.05),sLBP6H组最高且显著高于其它各组(P<0.05);在D35,各硒化多糖组的血清SOD活性显著高于免疫对照组和空白对照组(P<0.05),sLBP6H组最高且显著高于其它各组(P<0.05)。
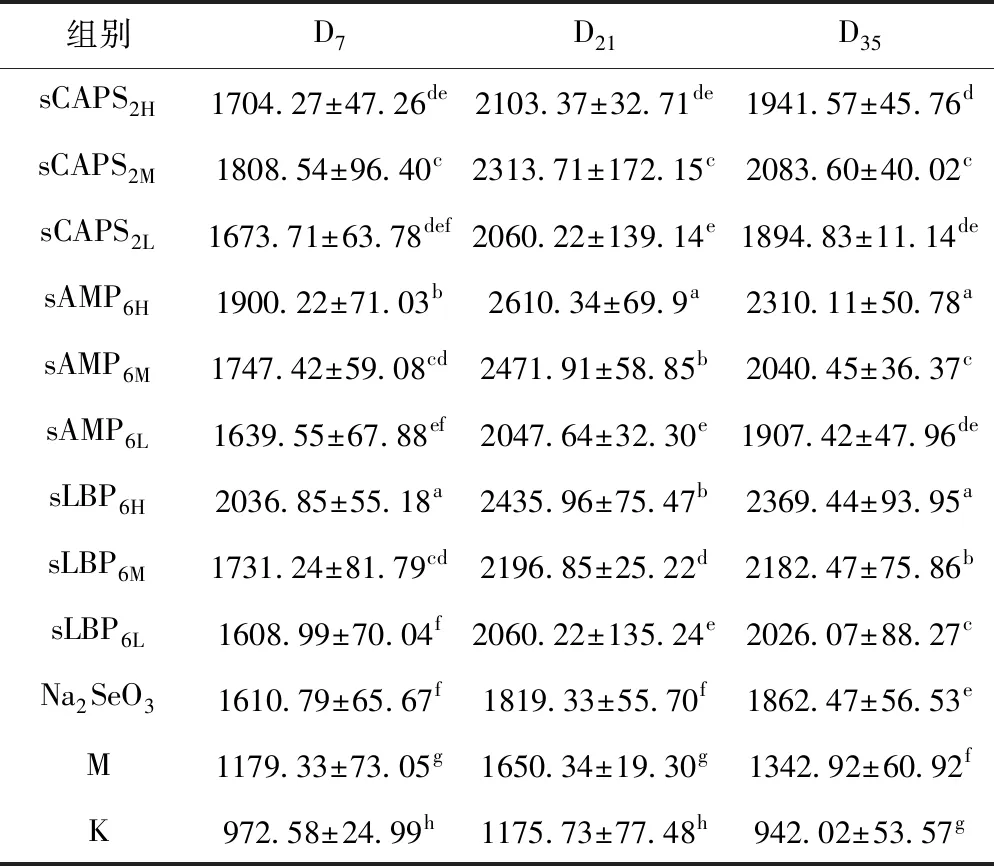
表2 各组血清GSH-Px活性的变化 U/mL
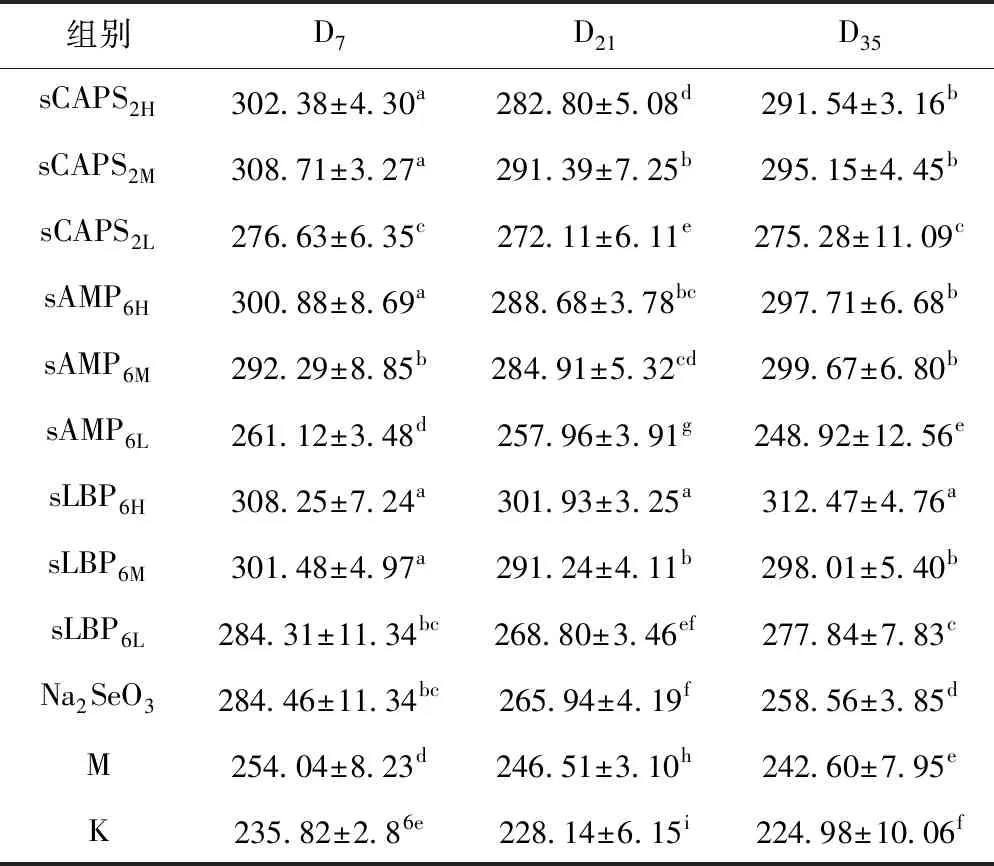
表3 各组血清SOD活性的变化 U/mL
2.2.4 各组血清MDA含量的变化
各组血清MDA含量的变化见表4。在D7,各硒化多糖组除sAMP6L组外的血清MDA含量均显著低于免疫对照组和空白对照组(P<0.05),sLBP6H组最低,其次为sCAPS2M组,这两组显著低于其它各组(P<0.05);在D21,各硒化多糖组的血清MDA含量显著低于免疫对照组和空白对照组(P<0.05),sLBP6H组最低、显著低于其它各组(P<0.05);在D35,各硒化多糖组的血清MDA含量均显著低于免疫对照组和空白对照组(P<0.05),sLBP6H组最低,其次为sAMP6H组差异不显著,这两组显著低于其它各组(P<0.05)。
2.2.5 各组肝脏组织变化
各组小鼠肝组织形态学变化见图4,各组肝细胞大小均匀,形态较规则,细胞核清晰,肝索排列整齐紧密。各组肝血窦内的内皮细胞,枯否氏细胞明显多于空白对照组。sCAPS2H组(图4A)、sCAPS2M组(图4B)、sAMP6H组(图4D)、sAMP6M组(图4E)、sLBP6H组(图4G)和sLBP6M组(图4H)肝血窦内的内皮细胞和枯否氏细胞明显多于sCAPS2L组(图4C)、sAMP6L组(图4F)、sLBP6L组(图4I)。sCAPS2H组、sCAPS2M组和sCAPS2L组中,sCAPS2M组肝血窦内的内皮细胞和枯否氏细胞增多明显。sAMP6H组、sAMP6M组和sAMP6L组中,sAMP6H组肝血窦内的内皮细胞,枯否氏细胞增多明显。sLBP6H组、sLBP6M组和sLBP6L组中,sLBP6H组肝血窦内的内皮细胞和枯否氏细胞增多明显。
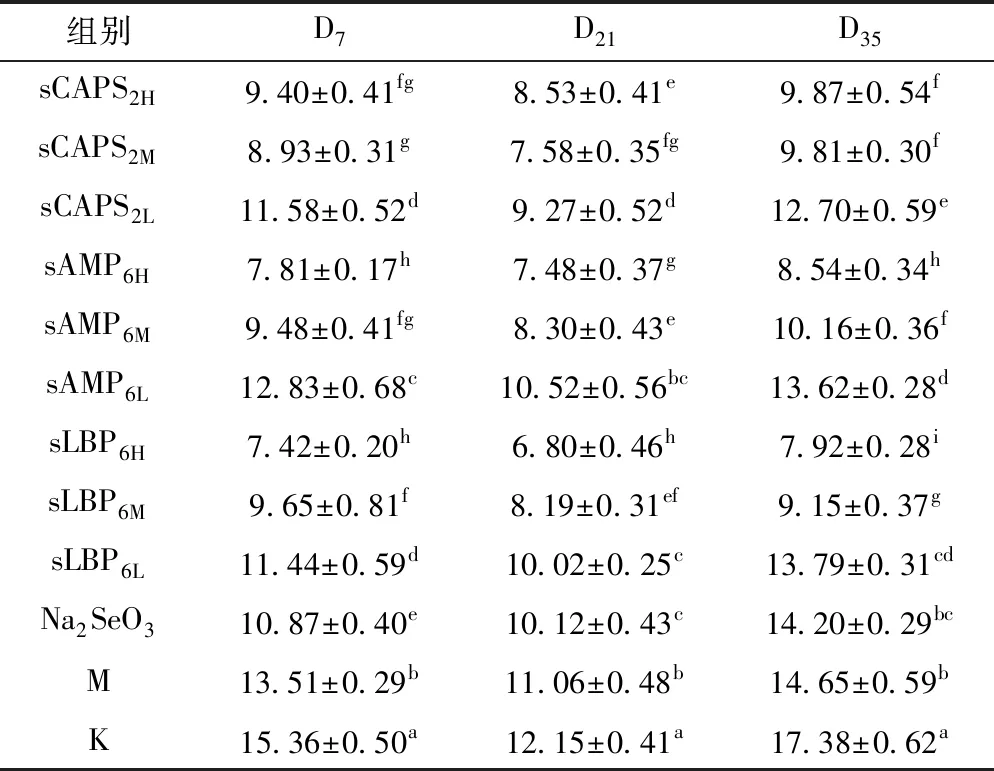
表4 各组血清中MDA含量的变化 nmol/mL
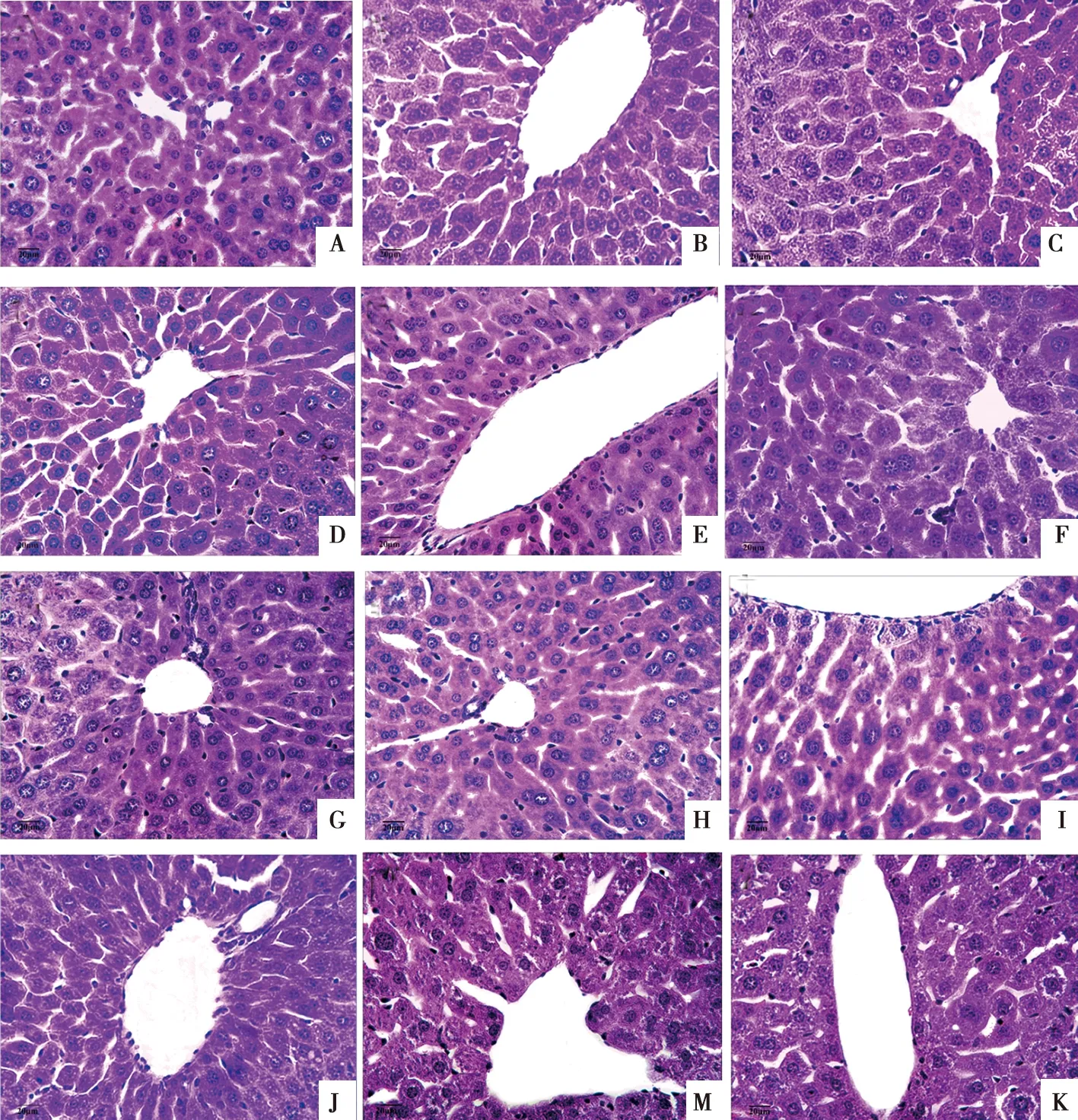
A. sCAPS2H组;B. sCAPS2M组;C. sCAPS2L组;D. sAMP6H组;E. sAMP6M组;F. sAMP6L组;G. sLBP6H组;H. sLBP6M组;I. sLBP6L组;J. Na2SeO3组;M. 免疫对照组;K. 空白对照组
图4 各组小鼠肝组织学变化 HE 染色结果 (10×40)
3 讨论
1973年,美国学者Rotruck发现硒是GSH-Px必需的组成部分[12]。同年,世界卫生组织宣布,硒是人和动物体内必需的微量元素。硒有许多重要的生理功能,其中抗氧化性是硒的生化作用基础。机体防御体系的抗氧化能力的强弱与健康程度存在密切的关系[13-14],硒多糖作为一种抗氧化剂往往具有多功能性,但是目前大多数抗氧化方法都是从一个角度来评价抗氧化物在食品以及生物体体系中的多功能作用。所以,一种抗氧化方法不能全面的评价抗氧化物的抗氧化能力。只有通过几种不同抗氧化作用机理的方法,在不同的条件下测定样品的抗氧化能力,才能比较全面和准确的了解抗氧化剂的抗氧化能力。
机体在生长代谢过程中会不断产生各种自由基,其中羟自由基(·OH)作为体内最活泼的活性氧可与生物体内多种生物大分子相互作用,破坏其原有生理功能,对机体造成伤害[15]。由于其存在时间短、攻击性强、破坏性大而成为自由基化学研究的热点,当加入羟自由基清除剂时可降低羟自由基对机体的损害[16]。由图1可见,各硒化多糖在浓度0.062 5~1 mg·mL-1的羟自由基清除率均大于或显著大于Na2SeO3组,sCAPS2在3个浓度组,sLBP6在2个浓度组的羟自由基清率均大于或显著大于其它各组。DPPH是一种很稳定的以氮为中心的自由基,通过检测生物制剂对DPPH自由基的清除能力可以表示其抗氧化性的强弱,应用DPPH法来评价体外抗氧化剂和植物抗氧化能力是一种快速、简便、灵敏、可行的方法[17]。由图2可见,比较硒化多糖各浓度的DPPH自由基清除率,sCAPS2在5个浓度组、sLBP6在3个浓度组、sCCPS5在1个浓度组的DPPH自由基清率均显著大于其它各组。ABTS 法,是使用最普遍的测量和表征抗氧化剂抗氧化能力的比色法[18]。比较硒化多糖各浓度的ABTS自由基清除率由图3可见,各硒化多糖浓度在0.062 5~0.25 mg·mL-1的ABTS自由基清除率均大于或显著大于Na2SeO3组。sCAPS2在5个浓度组,sLBP6在3个浓度组的羟自由基清率均大于或显著大于其它各组。综合比较各硒化多糖三个自由基清除率,可以得出硒化多糖sCAPS2、sLBP6和sAMP6的体外抗氧化活性较强。
为了验证体外试验结果,并筛选出抗氧化活性最强的硒化多糖及最佳剂量,选择体外抗氧化效果较好的sCAPS2、sLBP6和sAMP6,并设置3个剂量,进行体内抗氧化活性比较。T-AOC的测定原理是,机体内存在许多抗氧化物质将Fe3+还原成Fe2+,而后者可与菲啉类物质形成稳定的化合物,通过比色可测定其抗氧化能力的高低[19]。在体内抗氧化体系中,GSH-Px酶的活性中心是硒半胱氨酸,能特异性的催化还原型谷胱甘肽对过氧化氢的还原反应可以起保护细胞膜结构和功能的作用,调节机体内的抗氧化防御体系。SOD可歧化O2-形成H2O2,而H2O2在GSH-Px的作用下分解为H2O,从而达到消除自由基的作用,SOD 活性的高低间接反映了机体清除氧自由基的能力[20]。本试验结果显示,在首免后的3个时间点,各硒化多糖组的血清T-AOC、GSH-Px和SOD含量均高于或显著高于免疫对照组和空白对照组。在D7、D21和D35三个时间点,sLBP6H血清T-AOC活性组均为最高,高于或显著高于其它各组;在D7和D35两个时间点,sLBP6H组血清GSH-Px活性均为最高,高于或显著高于其它各组, 在D7, sAMP6H组血清GSH-Px活性均为最高,高于或显著高于其它各组;D7、D21和D35三个时间点,sLBP6H组的血清SOD活性含量最高,高于或显著高于其它各组;MDA即丙二醛,是在脂质过氧化过程中,由自由基引起而生成的一种醛类物质,可作为交联剂促进核酸、蛋白质及磷脂的交联,从而改变生物大分子的活性。通过检测定丙二醛的含量可以判断机体脂质过氧化的程度,间接反应出机体细胞的损伤程度[21]。本试验结果显示,在首免后的三个时间点,各硒化多糖组的血清MDA含量均低于或显著低于免疫对照组和空白对照组,sLBP6H组最低,低于或显著低于其它各组。综合比较,sLBP6高剂量的体内抗氧化活性最强。
肝脏是机体重要的消化腺,由实质细胞和非实质细胞组成,实质细胞即肝细胞,非实质细胞包括枯否细胞、肝星状细胞、肝窦内皮细胞等[22]。肝细胞参与机体糖类的合成和转换,蛋白质的合成、储存,尤其是在胆固醇、胆汁酸和磷脂酸的合成,调节机体的氧化平衡状态中发挥重要作用[23]。枯否氏细胞能吞噬和清除由胃肠道进入门静脉的细菌、病毒、异物及衰老的红细胞和血小板等,在维持肝脏内环境的稳态中发挥重要作用[24]。通过观察各组小鼠肝组织的 HE 染色结果显示,各组肝细胞大小均匀,形态较规则,细胞核清晰,肝索排列整齐紧密。硒化多糖高、中组肝细胞和肝血窦内的枯否氏细胞明显多于空白对照组、免疫对照组和Na2SeO3组。其中,sLBP6H组和sAMP6H组肝细胞和枯否氏细胞增多最明显。推测硒化多糖能引起肝脏组织结构发生改变,可能与其提高机体抗氧化能力有关,我们将继续进一步探讨其作用机理。
