非洲猪瘟病毒无标签重组B602L抗原制备与鉴定
2020-03-23张晓凯徐保娟崔晓霞李洋洋周晓慧张鑫宇张泉夏晓莉孙怀昌
张晓凯,徐保娟,崔晓霞,李洋洋,周晓慧,张鑫宇,张泉,夏晓莉,孙怀昌,3*
(1. 扬州大学兽医学院/江苏高校动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009;2. 青岛易邦生物工程有限公司,山东 青岛 266032;3. 江苏农牧职业技术学院,江苏 泰州 225300)
非洲猪瘟(African swine fever, ASF)是威胁世界养猪业最危险的传染病[1]。该病长期在沙哈拉以南非洲国家呈地方性流行,2007年传入格鲁吉亚,目前已在亚美尼亚、阿塞拜疆、俄罗斯、罗马尼亚、乌克兰、比利时等10多个欧洲国家流行[2]。2018年8月我国沈阳首次报道ASF疫情[3-4],截止12月19日已有23省(市)发生91起家猪疫情和2起野猪疫情,严重威胁我国养猪业的健康发展。由于缺少安全有效的疫苗,目前该病主要依赖感染猪扑杀和生物安全措施进行控制,因此快速、准确实验室诊断十分重要[5]。
ASF实验室诊断方法包括病毒学检测方法和血清学检测方法,血清学检测方法主要有免疫荧光试验、酶联免疫吸附试验(ELISA)和免疫转印(Western blot),其中ELISA主要用于血清学筛查,免疫荧光试验和免疫转印主要用于检测结果验证。非洲猪瘟病毒(African swine fever virus, ASFV)抗体检测ELISA主要有世界动物卫生组织(OIE)推荐的ELISA(OIE-ELISA)和商品化试剂盒,但检测敏感性都较低[5]。
B602L是ASFV的非结构蛋白,作为分子伴侣参与p72衣壳蛋白的折叠[6-7],也是强免疫原性抗原之一[8]。尽管国内已有ASFV重组抗原表达的报道[9-11],但能否作为血清学诊断抗原有待用自然感染康复猪血清验证。另外,现有的ASFV重组抗原多带有组氨酸标签,而我国猪群使用带组氨酸标签的亚单位疫苗已较普遍,因此有可能导致交叉反应。类弹性蛋白多肽(elastin-like polypeptide, ELP)是根据体内弹性蛋白重复序列合成的多聚体,具有温度敏感的可逆相变特性,在低于相变温度溶液中呈可溶状态,高于相变温度溶液中变为凝聚状态,因此ELP融合蛋白可用简单的相变循环(温控离心)纯化[12]。本研究将ASFV B602L与ELP进行融合表达,利用相变循环进行融合蛋白纯化,用烟草蚀纹病毒(Tobacco etch virus, TEV)蛋白酶活性包涵体切除ELP标签,用获得的无标签重组B602L抗原建立ASFV抗体检测ELISA方法,现将研究结果报告如下。
1 材料与方法
1.1 材料
ELP融合表达载体pET-ELP由本实验室构建和保存;大肠杆菌DH5α和BL21(DE3)从美国Novagen公司引进,本实验室保存;含Ba71V株ASFV B602L基因的重组质粒pGEX-4T-1-B602L由葡萄牙Parkhouse教授提供;TEV蛋白酶活性包涵体由本实验室制备;ASFV重组抗原免疫猪血清由本实验室制备,重组抗原在英国动物卫生所ASF参考实验室用ASFV抗体阳性血清鉴定正确。
1.2 表达载体构建
根据ASFV B602L基因序列设计1对PCR引物,正向引物P1序列为5- TAGAGCTCCGAAAACCTGTACTTCCAGGGTGCAGAATTTAATATTGATGAGC-3(斜体和下划线分别表示引入的SacⅠ酶切位点和TEV蛋白酶识别位点),反向引物R1序列为5- ACGCGGCCGCTTACAATTCTGCTTTTGTATATAA-3(NotⅠ酶切位点)。以pGEX-4T-1-B602L为模板进行PCR扩增,反应程序为98 ℃变性10 s、55 ℃退火5 s、72 ℃延伸10 s,共30个循环。将PCR产物克隆入pET-ELP载体,获得的重组载体pELP-B602L经限制酶切鉴定正确后送上海生物工程有限公司进行测序鉴定。
1.3 融合蛋白表达
将重组载体pELP-B602L转化BL21(DE3)大肠杆菌,挑取单菌落接种卡那霉素(50 μg/mL)LB培养液,37 ℃摇床培养过夜;按1∶100比例接种500mL卡那霉素 2×TY培养基(10 g/L酵母提取物, 16 g/L胰蛋白胨, 5 g/L 氯化钠),37 ℃摇床培养5 h;转入20 ℃摇床平衡30 min,加入0.2 mmol/L IPTG,20 ℃诱导表达16 h,4 ℃、5000 g离心10 min;沉淀菌体用1/10培养基体积PBS离心洗涤1次, 用50 mL PBS悬浮, 超声波充分裂解(40 w, 10 s,间歇15 s,共10 min);4 ℃、14 000 g离心10 min收集上清液,离心沉淀用等量PBS悬浮,各取10μL进行12% SDS-PAGE分析。
1.4 融合蛋白纯化
纯化ELP-B602L融合蛋白的相变循环参考文献[12]进行,将重组菌裂解液与等体积含0.5%TritonX-100的4 mol/L氯化钠混匀,26 ℃孵育10 min,室温、14 000 g离心5 min;离心沉淀用TEV蛋白酶切割液(50 mmol/L Tris-HCl, 0.5 mmol/L EDTA,1 mmol/L DTT,pH8.0)悬浮,4 ℃孵育8 h,4 ℃、12 000 g离心10 min,收集上清液。
1.5 标签切除与目的蛋白回收
用TEV蛋白酶活性包涵体切除ELP标签参考文献[13]进行,蛋白酶用量为100 μg/mL,30 ℃孵育8 h,6 000 g离心10 min去除蛋白酶性包涵体;离心上清液加入1/100蛋白酶抑制剂混合物(碧云天生物技术公司),室温孵育30 min;上清液加入等体积4 mol/L氯化钠,26 ℃孵育10 min,室温、14 000 g离心5 min;上清液用PBS(pH7.2)透析2次,14 000 g离心10 min,上清液即为纯化的无标签重组B602L抗原。
1.6 重组抗原免疫转印鉴定
用12%SDS-PAGE分离B602L重组蛋白,用半干转印仪(Bio-Rad公司)转移PVDF膜,用含5%脱脂乳粉的PBS(pH7.2)37 ℃封闭1 h;加入含0.2%Tween20封闭液1∶500稀释的B602L抗体阳性猪血清,37 ℃孵育1h;用PBST(含0.1%Tween-20 PBS)洗膜4次,5 min/次;加入含0.2%Tween20封闭液1∶10 000稀释的DyLight800标记驴抗猪IgG(美国KPL公司),37 ℃孵育1 h;用PBST洗膜4次,5 min/次,杂交信号用Odyssey Infrared Imaging System (美国LI-COR公司)在800 nm波长扫描。
1.7 重组抗原ELISA鉴定
用0.1 mol/mL碳酸盐溶液(pH9.6)将纯化重组B602L抗原稀释至5 μg/mL,分装ELISA反应板,100 μL/孔,设不加抗原空白对照孔,4 ℃包被过夜;用PBST(含0.05% Tween20的PBS)洗板4次,加入封闭液(含5%脱脂乳粉的PBST),100 μL/孔,37 ℃孵育1 h;用封闭液稀释重组B602L抗原免疫猪血清,加入ELISA板各孔,100 μL/孔,设阴性猪血清对照,37 ℃孵育1 h;用PBST洗板4次,加入封闭液1∶10 000稀释的辣根过氧化物酶标记羊抗猪IgG(无锡药科美生物公司),100 μL/孔,37 ℃孵育1 h;用PBST洗板4次,加入新鲜配制的TMB显色液,100 μL/孔,37 ℃避光孵育20 min;加入2 mol/L硫酸终止反应,50 μL/孔;以空白对照孔调零,用酶标仪(Bio-Tek公司)读取各孔的OD450值。
2 结果与分析
2.1 表达载体鉴定
用限制性内切酶SacⅠ和NotⅠ对重组载体pELP-B602L进行双酶切鉴定,琼脂糖凝胶电泳显示可切出预期的约1.8 kb插入片段(图1),序列测定结果显示插入的基因片段无突变,表明重组表达载体构建正确。
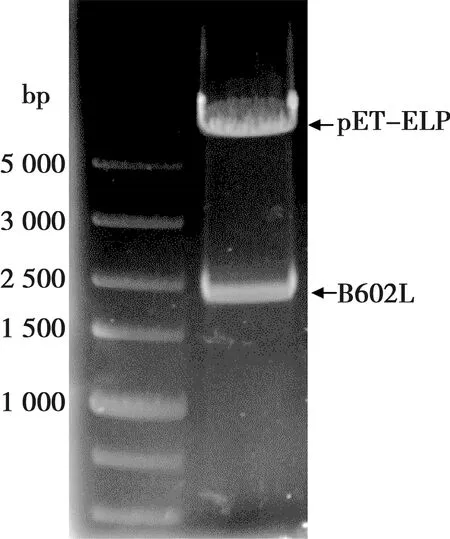
M. DNA Marker; 1. pELP-B602L酶切
图1 融合表达载体pELP-B602L的酶切鉴定
2.2 融合蛋白表达
将重组载体pELP-B602L转化BL21(DE3)大肠杆菌,用0.2 mmol/L IPTG、20℃诱导表达16h,SDS-PAGE分析结果显示重组菌表达预期的118 kDa重组蛋白,重组蛋白为可溶性表达,存在于菌体裂解液离心上清中(图2)。
M.蛋白质分子量标准;1. 未诱导重组菌;2. IPTG诱导重组菌;3. 裂解菌离心上清;4. 裂解菌离心沉淀
图2 ELP-B602L融合蛋白表达的电泳分析
2.3 融合蛋白纯化
将重组菌裂解液与等体积含0.5%TritonX-100的4 mol/L氯化钠混匀,在26 ℃进行1次相变循环,SDS-PAGE分析结果显示纯化的ELP-B602L融合蛋白纯度大于85%(图3)。

M.蛋白质分子量标准;1. 裂解重组菌离心上清;2. 相变循环纯化的融合蛋白
图3 纯化ELP-B602L融合蛋白的电泳分析
2.4 ELP标签切除与重组B602L回收
将TEV蛋白酶活性包涵体与ELP-B602L融合蛋白在30 ℃孵育8 h,SDS-PAGE分析结果显示切割效率接近100%;将切割产物12 000 g离心10 min去除TEV蛋白酶活性包涵体,离心上清中加入2 mol/L(终浓度)氯化钠,在26 ℃进行再次相变循环,结果显示回收的重组B602L蛋白为预期的69 kDa,纯度大于90%(图4)。
2.5 重组蛋白免疫转印鉴定
用ASFV B602L抗体阳性血清与纯化的ELP-B602L融合蛋白和回收的重组B602L蛋白进行免疫转印试验,结果显示两个蛋白均能被抗体识别(图5),表明两种重组B602L蛋白具有良好的反应原性。

M.蛋白质分子量标准;1. 未切割融合蛋白;2. 蛋白酶切割产物;3. 相变循环离心沉淀;4.相变循环回收的重组B602L蛋白
图4 重组B602L蛋白标签切除与回收的电泳分析
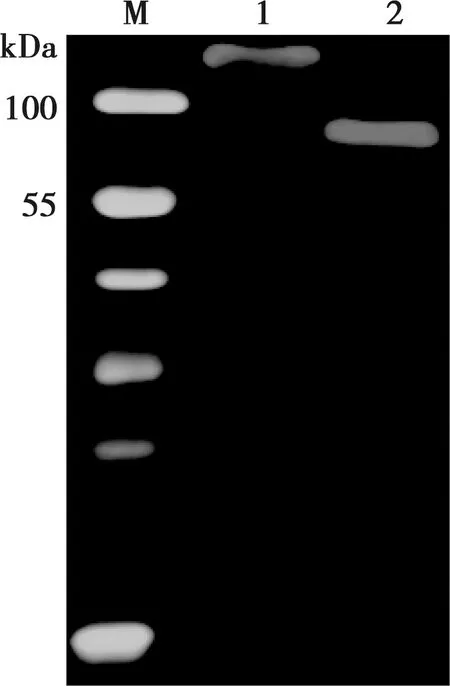
M. 蛋白质分子量标准;1. ELP-B602L融合蛋白;2. 重组B602L蛋白
图5 重组B602L蛋白的免疫转印鉴定
2.6 重组抗原ELISA鉴定
分别用0.5、1.0和2.0 μg/mL重组B602L蛋白包被ELISA反应板,与1∶100、1∶200、1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400稀释B602L抗体阳性(PS)和阴性猪血清(NS)进行棋盘滴定,结果显示三个不同浓度重组B602L蛋白与B602L抗体阴性血清反应阴性(OD450<0.16),与阳性血清反应阳性(OD450>1.5),OD450值与血清稀释倍数呈良好的线性关系(图6)。

图6 重组B602L抗原与猪血清的棋盘滴定
3 讨论
非洲猪瘟病毒感染猪后7~10 d即产生特异抗体,并维持很长时间。目前国内外均未使用非洲猪瘟疫苗,因此抗体检测对于ASF诊断和流行病学调查具有重要意义,也是地方性流行国家(地区)以及亚急性、慢性ASF诊断的主要手段[8]。B602L是ASFV的强免疫原性抗原之一[14]。本实验室已用大肠杆菌表达的B602L等重组抗原建立了混合抗原ELISA抗体检测方法,在ASF参考实验室检测结果显示具有很高的敏感性和特异性[15]。然而,最近在国内检测发现,该ELISA方法与ASF发生前部分猪血清呈阳性反应。由于这些重组抗原带有组氨酸融合标签,而目前我国猪群使用带组氨酸标签的重组亚单位疫苗已较普遍[16-17],因此推测由组氨酸标签的交叉反应所致。为了解决这一问题,本研究将ASFV B602L蛋白与ELP标签进行融合表达,用相变循环获得纯化融合蛋白后,用自制的TEV蛋白酶活性包涵体切除ELP标签。SDS-PAGE分析显示,尽管一次相变循环获得的融合蛋白纯度不高(~85%),但在切除ELP标签和再次相变循环后,回收的重组B602L蛋白的纯度大于90%,进一步证明ELP是有效的新型重组蛋白纯化标签。本研究策略的突出优点包括:利用相变循环(温控离心)即可获得高纯度重组抗原,纯化过程不仅简单、快速,而且不需昂贵的化学试剂和仪器设备;制备的重组抗原不含任何标签和额外氨基氨酸,从而避免纯化标签导致的交叉反应问题,用其建立的抗体检测方法特异性更强。
免疫转印鉴定结果显示,ELP-B602L融合蛋白和回收的重组B602L蛋白均能被特异抗体阳性猪血清识别,表明两种重组蛋白具有良好的反应原性。ELISA检测结果显示重组B602L抗原与抗体阴性血清反应阴性,与特异抗体阳性血清反应阳性,而且抗原浓度与血清稀释倍数具有良好的线性关系。用0.5 μg/mL包被抗原进行ELISA检测,1∶6 400稀释抗体阳性血清的OD450值>1.5,表明用重组B602L抗原进行抗体检测具有很高的敏感性。这些研究表明,本研究获得的无标签重组B602L蛋白可用于ASFV抗体的免疫转印和ELISA检测。
