青海牦牛卵巢颗粒细胞体外培养及kisspeptin-10对其孕酮分泌的影响和机制研究
2020-03-23张琳钦张君徐尚荣彭巍舒适关凯文赵明旺
张琳钦,张君,徐尚荣,彭巍,黄 荣,舒适,关凯文,赵明旺
(1. 青海大学农牧学院,青海 西宁 810016;2. 青海大学畜牧兽医科学院,青海 西宁 810016)
中国是饲养牦牛数量最多的国家,牦牛的养殖大多分布于青藏高原,其在高寒牧区具有不可替代的生态、社会、经济地位[1]。但处于青藏高原严酷的环境下,牦牛的生产性能低下,繁殖性能低下尤其明显[2]。而在动物生殖发育进程中,卵巢颗粒细胞一直起着不容忽视的作用。研究牦牛卵巢颗粒细胞,对更好地理解牦牛的生殖机理及进一步提高牦牛繁殖力具有重要的理论价值和现实意义。
近年来,对哺乳动物卵巢颗粒细胞体外培养体系的研究和建立已较为成熟[3]。因此,在借鉴前人研究的基础上,对青海牦牛卵巢颗粒细胞进行体外分离和培养,建立完善的培养体系是十分必要的,颗粒细胞也确实是研究动物卵巢内分泌功能及生殖生理学的一种理想细胞模型[4]。
孕酮(progesterone, P4)在卵泡排卵和黄体形成过程中发挥作用,能促进子宫机能的成熟,适量的孕酮更有助于雌性动物维持正常性欲和生殖功能[5]。而颗粒细胞的增殖与分化能够直接影响孕酮的分泌,作为卵泡内包裹卵子的细胞群体,它还能够影响卵泡的发育、排卵、黄体形成过程及类固醇激素[6]。也有研究证实,体外培养的颗粒细胞可以自发的分泌孕酮和雌激素,而不需要雄激素作为合成底物[7-8]。
目前,在对生殖启动的关键因子Kisspeptin的研究中发现,它的最小活性片段,具有高度物种间保守性的Kisspeptin-10(kp-10),对颗粒细胞的增殖和孕酮的分泌具有促进作用[9-12]。然而kp-10在牦牛上是否同样对卵巢颗粒细胞孕酮分泌有调节作用尚不清楚。
本研究分离和培养青海牦牛卵巢颗粒细胞,并在此基础上探讨kp-10对青海牦牛卵巢颗粒细胞孕酮分泌的作用和机制。
1 材料与方法
1.1 材料
1.1.1 试验动物
从青海西宁裕泰屠宰场采集刚屠宰的牦牛卵巢,挑选外观色泽光亮、发育正常、没有黄体、有腔卵泡多而饱满的卵巢,放入装有37 ℃含双抗的生理盐水恒温保温杯中,于4 h内运回实验室。
1.1.2 主要试剂
DMEM/F12培养液(GIBCO)、胎牛血清(GIBCO)、青链霉素混合液(BOSTER)、胰酶(BI)、ITS(Sigma)、Kisspeptin蛋白剂(millipore)、PBS(TRANS)、孕酮试剂盒(Bovine P)、Hoechst33258(Solarbio)、Goat Anti-Rabbit IgG(H+L), PE conjugate(TRANS)、FSHR兔多克隆抗体(BOSTER)、即用型正常山羊血清(BOSTER)、Triton-X-100(Solarbio)、Trypan Blue(Solarbio)、4%多聚甲醛(Solarbio)、Fluo-4 AM(Beyotime)。
1.2 方法
1.2.1 青海牦牛卵巢颗粒细胞的分离和培养
在实验室无菌环境下,使用预热的37 ℃生理盐水再次清洗采集回的卵巢,并修剪掉采集卵巢时未除掉的多余韧带、系膜等结缔组织。生理盐水清洗卵巢3次,然后在超净台内,使用5 mL注射器抽吸卵巢上2~8 mm卵泡内的卵泡液,并集中收集入15 mL无菌离心管中。使用100 μm细胞筛过滤卵泡液以去除卵母细胞,常温下,离心(1 000 r/min,5 min)。弃上清,加入含1%双抗的PBS,吹打混匀并清洗细胞3次。离心(1 000 r/min,5 min),弃上清,加入2 mL含胎牛血清的完全培养基,制成单细胞悬液。取100 μL单细胞悬液,再加入等量的台盼蓝染液,进行染色和计数。将细胞悬液调整浓度至4×105/mL接种于25 mL的细胞培养瓶中,于5%CO2、95%空气、37 ℃条件下,饱和湿度的培养箱中培养,24 h后换液1次。期间,PBS冲洗,去除未贴壁细胞和杂质。之后,每48 h换液1次。
1.2.2 FSHR表达鉴定牦牛卵巢颗粒细胞
胰酶消化原代细胞,制备单细胞悬液,将4×105/mL的细胞悬液注入放有8 mm圆形载玻片的35 mm细胞培养皿中,在5% CO2、95%空气、37 ℃条件下,饱和湿度的培养箱中培养24 h,细胞长至贴壁面80%,取出细胞爬片,用PBS冲洗1 min×3次,4%多聚甲醛固定20 min后,进行细胞免疫化学染色:固定好的细胞爬片,PBS洗涤1 min×3次;0.4% Triton通透细胞膜10 min,PBS洗涤1 min×3次;即用型正常山羊血清封闭30 min,除液,不用PBS洗涤;加入一抗FSHR兔多克隆抗体(1∶100),4 ℃孵育,过夜;取出细胞爬片,PBS洗涤1 min×3次,加入二抗羊抗兔IgG(H+L)(1∶100),室温,避光1h,PBS洗涤1 min××3次,加入1 mg/L的Hoechst33258,室温5 min。PBS代替一抗,阴性对照。荧光显微镜下观察。
1.2.3 卵巢颗粒细胞HE染色
颗粒细胞培养过程中,分别于6、12、18、24、36、48、72及96 h取出提前放置的细胞爬片,用PBS冲洗1 min×3次,4%多聚甲醛固定20 min,再用PBS冲洗2次后,苏木素染色2 min,流水冲去浮色,入盐酸酒精中分色数秒,流水冲洗2 min,镜下细胞核染色清晰,胞浆不着色。5%伊红染色2 min,流水冲去浮色,梯度酒精脱水,二甲苯透明,封片后,光镜下观察细胞形态。
1.2.4 CCK法检测牦牛卵巢颗粒细胞的活力
取颗粒细胞,以6×104/mL接种于96孔板,每孔加入完全培养基(含FBS)100 μL,在5%CO2、95%空气、37 ℃条件下,饱和湿度的培养箱中培养。每次选取3个复孔,于6、12、18、24、36、48、72及96 h加入CCK,避光培养2 h后,使用酶标仪,测定450 nm的细胞OD值。以含培养基和CCK的无细胞处理组为空白对照。
1.2.5 不同处理时间及不同浓度下kp-10对牦牛卵巢颗粒细胞活性的影响
取颗粒细胞,按6×104/mL接种于96孔板,每孔加入完全培养基(含FBS)100 μL,在5% CO2、95%空气、37 ℃条件下,饱和湿度的培养箱中培养6 h。细胞贴壁完全,每孔再加入等量的1% ITS培养基(即无血清培养基),继续培养6 h。换无血清培养基稳定培养12 h,弃原液。加入含有不同浓度kp-10(0、10、100及1 000 nmol/L)的无血清培养基继续培养细胞;分别于给药后12、24、48及72 h加入含CCK的培养基,避光培养2 h。使用酶标仪,测定450 nm的细胞OD值。期间,收集适量24 h批次未加CCK的细胞上清,放于-20 ℃冻存,用于孕酮含量检测。
1.2.6 流式细胞仪检测细胞内Ca2+浓度
方法同1.2.5,加入不同浓度的kp-10、Verapamil单独或共同处理细胞24 h后, ELLSA测上清内孕酮含量。细胞则通过胰酶消化后,收集并用PBS(无钙)清洗3遍。加入Fluo-4 AM工作液,室温孵育60 min。PBS(无钙)清洗3遍,室温孵育20 min。最后用PBS(无钙)制备单细胞悬液,调整浓度至1×106/mL。于流式细胞仪上检测,获取的荧光值,通过流式细胞仪自带的Cyt Expert软件分析处理。
1.2.7 ELLSA法检测孕酮含量
收集各组待测的细胞上清,孕酮水平通过ELLSA法进行测定。测定方法按牛孕酮(P)酶联免疫分析试剂盒说明书进行。用酶标仪在450 nm波长下测定吸光度(OD值),得出回归曲线Y=0.109X-0.000 837,相关系数R2=0.996。通过标准曲线计算样品中牛孕酮(P)浓度。
1.3 统计方法
采用SPSS 23.0、Graphpad Prism5对数据进行统计分析并作图。每个处理组设3个重复,每个试验重复3次,测定结果以x±s表示,细胞活力OD值及孕酮浓度用单因变量多因素方差分析、多重比较LSD检验进行两两比较。P<0.05为差异显著,P<0.01为差异极显著。
2 结果
2.1 分离培养细胞的FSHR鉴定
图1所示,细胞培养24 h后(图A),对其进行 FSHR免疫荧光染色。倒置荧光显微镜观察:细胞核被Hoechst333258染成蓝色(图B),分离、培养的细胞基本都表达FSHR(图C),叠加后发现FSHR阳性细胞与核染完全重合(图D),镜下计数显示,表达FSHR阳性细胞>97%,分离培养的细胞确实为牦牛卵巢颗粒细胞。
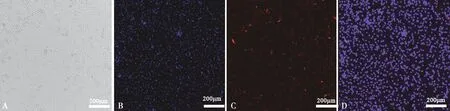
A.光镜下培养24 h的细胞 ;B.Hoechst33258细胞核染色;C.细胞的FSHR染色;D.FSHR和Hoechst33258合并图
2.2 牦牛卵巢颗粒细胞形态观察
由图2可知,牦牛卵巢颗粒细胞在6 h内就能贴壁,并在贴壁初期,部分集中聚集生长,细胞在增殖过程中由密集向稀疏部位迁移,至布满贴壁面,细胞形态由梭形、多边形呈放射状至铺路板状再慢慢变为呈纤维状。
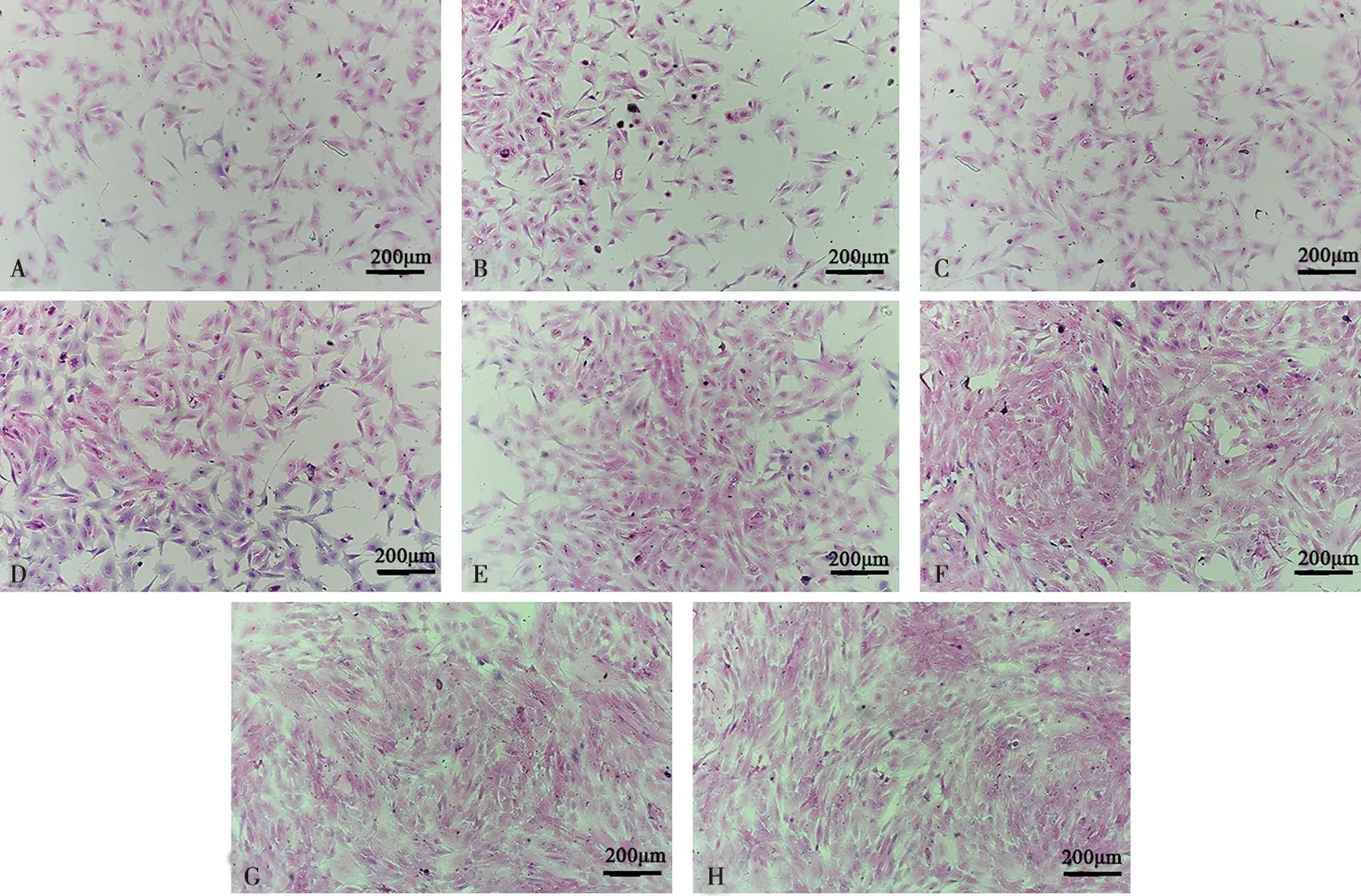
A.培养6 h颗粒细胞;B.培养12 h颗粒细胞;C.培养18 h颗粒细胞;D.培养24 h颗粒细胞;E.培养36 h颗粒细胞;F.培养48 h颗粒细胞;G.培养72 h颗粒细胞;H.培养96 h颗粒细胞
图2 牦牛卵巢颗粒细胞HE染色(×100)
2.3 牦牛卵巢颗粒细胞生长活力检测
CCK是根据检测细胞的还原结果来反映细胞的活力和增殖情况。分别于6、12、18、24、36、48、72及96 h检测细胞活力。结果(图3)可见,细胞生长曲线呈“S”型,在24 h内处于潜伏期,6 h至12 h至18 h差异皆不显著(0.11±0.01vs0.11±0.01vs0.11±0.01,P>0.05)。培养24 h至72 h,细胞进入对数生长期,18 h至24 h至36 h至48 h至72 h差异皆显著(0.11±0.01vs0.15±0.02vs0.35±0.01vs0.46±0.03vs0.61±0.01,P<0.05),72 h至96 h差异不显著(0.61±0.01vs0.62±0.01,P>0.05),根据测得OD值结果,推断细胞已长满细胞培养孔,进入平台期。以上结果表明,牦牛卵巢颗粒细胞符合贴壁细胞的生长规律,细胞培养状态良好[13]。
2.4 不同处理时间及不同浓度的Kisspeptin-10对牦牛卵巢颗粒细胞活力的影响
图4显示,10和100 nmol·L-1kp-10处理12 h均显著提高颗粒细胞的活力(0.64±0.02vs0.58±0.03,0.69±0.02vs0.58±0.03,P<0.05),1 000 nmol·L-1kp-10处理12 h,细胞活力被显著抑制(0.51±0.03vs0.58±0.03,P<0.05);10、100和1 000 nmol·L-1kp-10处理24 h、48 h、72 h均显著提高颗粒细胞的活力,100 nmol·L-1kp-10效果最佳(24 h:0.77±0.02vs0.59±0.01, 0.85±0.01vs0.59±0.01,0.74±0.03vs0.59±0.01;48 h:0.92±0.01vs0.62±0.01, 1.28±0.03vs0.62±0.01, 1.05±0.06vs0.62±0.01; 72 h: 1.5±0.01vs0.66±0.01, 1.6±0.01vs0.66±0.01, 1.56±0.01vs0.66±0.01,P<0.05)。
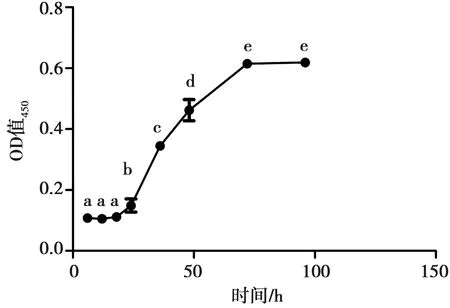
不同字母表示差异显著(P<0.05),相同表示差异不显著(P>0.05)
图3 CCK检测牦牛卵巢颗粒细胞活性
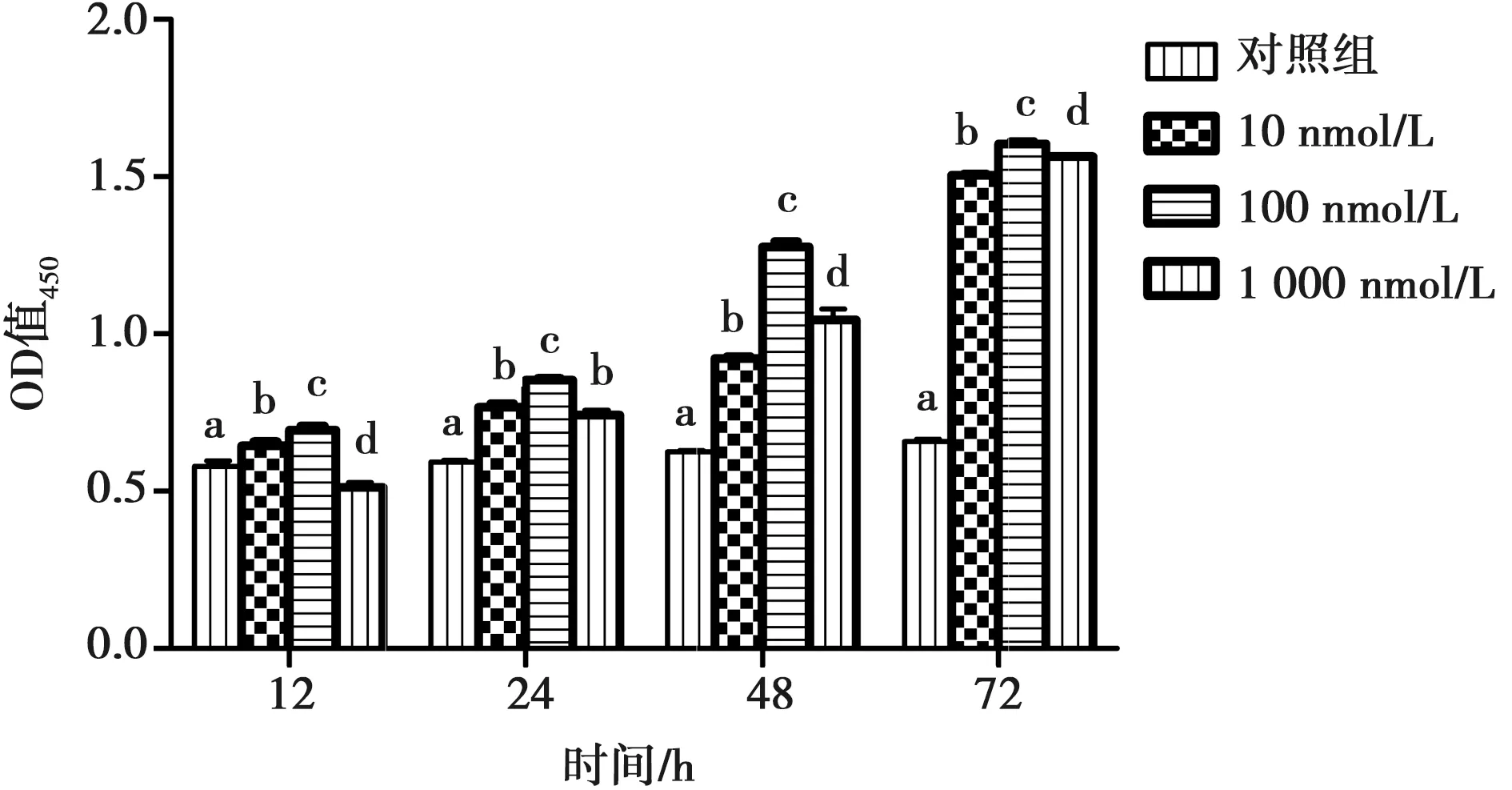
不同字母表示差异显著(P<0.05),相同表示差异不显著(P>0.05)
图4 Kisspeptin-10不同处理时间及浓度对牦牛卵巢颗粒细胞CCK影响
2.5 不同浓度Kisspeptin-10对牦牛卵巢颗粒细胞孕酮分泌的影响
图5显示,与对照组相比,10、100和1 000 nmol·L-1kp-10处理24 h时均显著提高颗粒细胞孕酮的分泌,并且在100 nmol·L-1时最显著。(0.22±0.01vs0.16±0.01, 0.25±0.01vs0.16±0.01, 0.22±0.01vs0.16±0.01, 0.25±0.01vs0.22±0.01,P<0.05)。
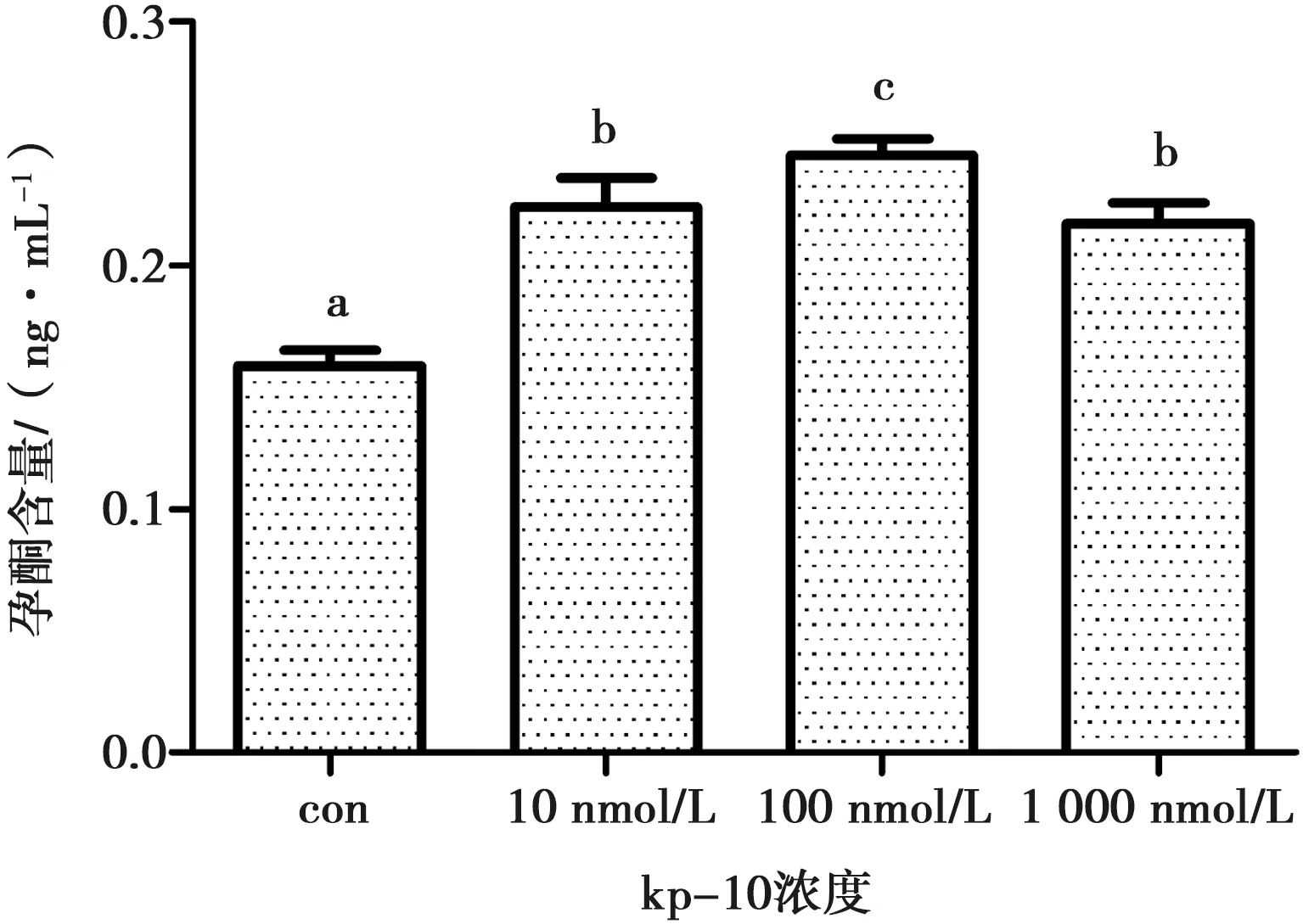
不同字母表示差异显著(P<0.05),相同表示差异不显著(P>0.05)
图5 不同浓度Kisspeptin-10对牦牛卵巢颗粒细胞孕酮分泌的影响
2.6 Verapamil对Kisspeptin-10促牦牛卵巢颗粒细胞孕酮分泌的作用及胞内Ca2+浓度变化
由图6可知,钙离子阻断剂Verapamil会降低孕酮的分泌,于20、50 nmol·L-1时,达显著降低水平(0.233±0.004vs0.252±0.007;0.225±0.005vs0.252±0.007,P<0.05);不同浓度的Verapamil与100nmol·L-1kp-10共同处理时,孕酮含量有所提升,但不能逆转其对孕酮分泌的抑制作用(0.249±0.008vs0.257±0.004;0.233±0.004vs0.234±0.004;0.225±0.005vs0.23±0.003,P>0.05)。
用流式细胞仪检测胞内Ca2+浓度,数据通过Cyt Expert软件分析,其结果与图6中Verapamil和Kisspeptin-10单独或共同处理牦牛卵巢颗粒细胞后孕酮分泌水平相一致(图7)。
不同字母表示差异显著(P<0.05),相同表示差异不显著(P>0.05)
图6 Verapamil对Kisspeptin-10促牦牛卵巢颗粒细胞孕酮分泌的影响
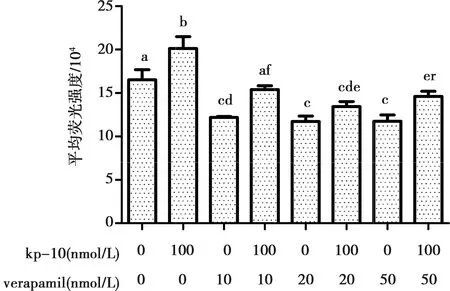
不同字母表示差异显著(P<0.05),相同表示差异不显著(P>0.05)
图7 Kisspeptin-10和Verapamil对牦牛卵巢颗粒细胞内钙离子浓度的影响
3 讨论
本试验在参考了近些年国内外对颗粒细胞的培养方法后,建立了青海牦牛卵巢颗粒细胞体外培养体系,并通过FSHR抗体对牦牛卵巢颗粒细胞进行鉴定。FSHR是位于性腺上的卵泡刺激素特异性受体,在卵泡内,FSHR仅存在于颗粒细胞上,其mRNA位于颗粒细胞的表面[14]。针对使用动物血清所要面临的内外源病毒、细菌和支原体等微生物污染的风险[15],本试验在使用血清培养青海牦牛卵巢颗粒细胞的基础上,逐步建立无血清培养体系。
Kisspeptin可水解为Kisspeptin-54,14,13,10,其共同特点是羧基端为精氨酸-苯丙氨酸-NH2(RF- NH2)模体,都能与GPR54以相似亲和力特异性结合,其中Kisspeptin-10是其最小活性片段,具有高度的物种间保守性[16]。本试验结果表明, kp-10和孕酮分泌呈剂量依懒性增加,这与刘羽红等[9]的研究结果相一致。但本试验中1 000 nmol·L-1kp-10处理12 h时,颗粒细胞活力被显著抑制,参考王军等[17]发表的Kisspeptin对牛卵巢颗粒细胞凋亡的影响研究,推测可能是因为培养短时间,该浓度kp-10对颗粒细胞凋亡的作用明显,故而导致检测时OD值低于对照组。在1 000 nmol·L-1kp-10处理24、48及72 h时,颗粒细胞活力显著提高,结合郭威等[10]、肖蕴琪等[11]的研究结果,推断随着时间的推移,kp-10在促进细胞凋亡过程中也同时起到促进细胞增殖的作用,其对细胞增殖的影响大于对细胞凋亡的促进作用,具体机理,仍需进一步研究。
苯烷基胺类钙通道拮抗剂Verapamil可以作用于细胞膜上的钙通道,阻断胞外Ca2+内流[18]。本试验使用不同剂量的Verapamil单独或与100 nmol·L-1Kisspeptin-10共同处理牦牛卵巢颗粒细胞,试验结果验证了kp-10促进颗粒细胞孕酮分泌的作用可能依赖于胞内Ca2+浓度的变化。
4 结论
综上所述,体外培养青海牦牛卵巢颗粒细胞,建立细胞模型,是理想且可行的。Kisspeptin-10在100 nmol·L-1时效果最佳,可增强青海牦牛卵巢颗粒细胞的活力,促进颗粒细胞孕酮的分泌,Kisspeptin-10促进孕酮分泌的作用可能与胞内Ca2+信号通路有关。
