鳞杯伞可溶性蛋白提取工艺的优化及其营养评价
2020-03-23王江王术荣郭富宽常明昌孟俊龙
王江,王术荣,郭富宽,常明昌,*,孟俊龙
(1.山西农业大学食品科学与工程学院,山西太谷030801;2.黄土高原食用菌提质增效协同创新中心,山西太谷030801)
山西省特色野生食用菌种质资源丰富,台蘑久负盛名。台蘑泛指生长于五台山生态区上的一些优质野生食用菌类,主要品种有台蘑小香蕈、黑水皮香蕈、银盘蘑菇、虎皮香蕈、秋露白等[1]。台蘑味香浓郁,营养丰富,具有驱风散寒、舒筋活血、降低胆固醇、防止动脉硬化、调节人体免疫等保健功效[2-3]。目前,关于台蘑的研究主要集中于种质资源调查[4-5]、营养成分分析[6]和生物学特性及其人工驯化栽培等方面[7-8]。
黑水皮香蕈学名鳞杯伞(Clitocybe squamulosa),隶属于白蘑科(Tricholomataceae)杯伞属(Clitocybe),主要生长于五台管涔山的云杉、落叶松林内草地上;鳞杯伞是野生台蘑中的营养价值极高的一种,其质地柔嫩、风味独特;关于其营养成分分析、生物活性蛋白分离提取及营养价值评价等研究尚未有报道。据此,笔者对鳞杯伞子实体的主要营养成分进行分析的基础上,采用碱溶酸沉法制备活性蛋白,通过探索其最佳提取工艺参数,并对所获取得蛋白氨基酸组分进行营养价值分析和评价;以期为鳞杯伞蛋白的制备及进一步的功能性食品的开发利用提供理论依据。
1 材料与方法
1.1 材料
鳞杯伞[Clitocybe squamulosa(Pers.)Kumm]:山西食用菌工程技术研究中心提供,放置于烘箱中35 ℃下烘干、粉碎、过60 目筛备用;牛血清蛋白标准品:北京百奥莱博科技有限公司;考马斯亮蓝G250 试剂:上海瀚思化工有限公司;浓盐酸:恒泰化工有限公司;氢氧化钠:南京盛庆和化工有限公司;无水乙醇、磷酸:天津市凯通化学试剂有限公司(以上试剂均为分析纯)。
1.2 主要仪器
TB-214 型电子分析天平:北京赛得利斯仪器系统有限公司;GZX-9240MBE 型电恒温鼓风干燥箱:上海博讯实业有限责任公司;SHZ-D(Ⅲ)型循环水真空泵:邦西仪器科技有限公司;DF-101S 磁力搅拌器:北京中兴伟业仪器有线公司;MultifugeX1R Centrifuge 离心机:美国THERMO 有限责任公司;德国Christ ALPHA 2-4 LSC 冷冻干燥机:德国格马有限责任公司;UV-1800 紫外可见分光光度计:上海美普达仪器有限公司;DE-200 红景天高速超微粉碎机:天津市精诚机械有限公司;KDN-1 型全自动凯氏定氮仪:上海仪电科学仪器股份有限公司;Biochrom-30+全自动氨基酸分析仪:英国biochrom/百康有限责任公司。
1.3 试验方法
1.3.1 鳞杯伞子实体中基本成分的分析
蛋白质含量测定方法采用GB 5009.5-2016《食品安全国家标准食品中蛋白质的测定》,采用凯氏定氮法测定;水分含量测定方法采用GB 5009.3-2016《食品安全国家标准食品中水分的测定》,将样品放在(105±1)℃的烘箱中烘至恒重。脂肪含量测定采用GB 5009.6-2016《食品安全国家标准食品中脂肪的测定》;灰分含量测定采用,GB 5009.4-2016《食品安全国家标准食品中灰分的测定》,将样品置于(550±25)℃高温下煅烧4 h,称量残渣的质量;依次对子实体粉进行粗蛋白、水分、粗脂肪、灰分的测定[9]。碳水化合物含量的测定参照李茉[10]的方法,称取样品质量减去样品中所测的水分、灰分、脂肪及蛋白质含量的总和。
1.3.2 鳞杯伞可溶性蛋白含量的测定
采用Bradford 法测定鳞杯伞蛋白提取液中可溶性蛋白的含量,以牛血清蛋白(albumin from bovine serum,BSA)作为标准蛋白,以考马斯亮蓝比色法在595 nm下测定吸光值,通过绘制蛋白标准曲线,见图1。
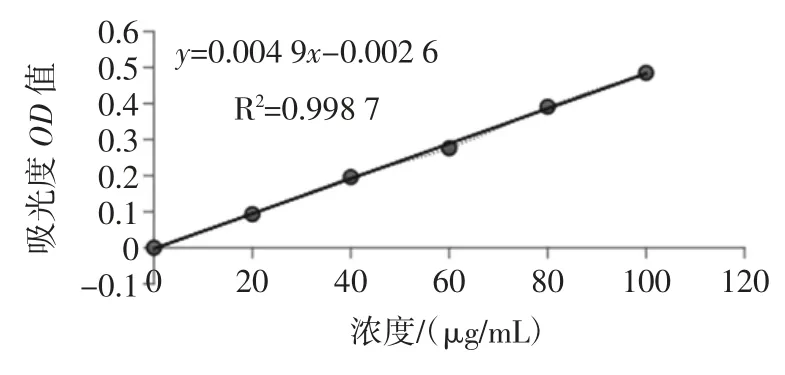
图1 考马斯亮蓝牛血清蛋白标准曲线Fig.1 Coomassie brilliant blue bovine serum albumin standard curve
如图1 所示,建立回归方程为y=0.004 9x-0.002 6,其中 y 为所测吸光度,x 为蛋白浓度(μg/mL),R2=0.998 7。最后,根据标准曲线计算提取液中可溶性蛋白质的含量,以此来确定样品的蛋白提取率。
1.3.3 鳞杯伞子实体蛋白提取的工艺流程
将烘干的鳞杯伞子实体粉过60 目筛→室温下用正己烷料液比为1 ∶10(g/mL)脱脂→置于震荡摇床脱脂2 h→连续用正己烷萃取两次→静置30 min→倾析出己烷→脱脂的样品在空气中干燥24 h 后备用;准确称取脱脂子实体粉0.50 g 溶于不同pH 值与液料比的蒸馏中→调节温度水浴震荡提取→4 500×g/min 离心10 min→测定提取液中可溶性蛋白的含量→调节上清液至鳞杯伞蛋白等电点(pH 3.6)→静置30 min→6 500×g/min 离心15 min→弃上清,将蛋白沉淀用少量去离子水溶解→调节pH 值至中性→真空冷冻干燥得到鳞杯伞粗蛋白粉。
1.3.4 可溶性蛋白提取率的计算

式中:X 为蛋白质提取率,%;C 为提取液中可溶性蛋白浓度,mg/mL;V 为提取液体积,mL;N 为稀释倍数;m1
为样品的质量,mg。
1.3.5 可溶性蛋白提取的单因素试验
利用单因素筛选鳞杯伞可溶性蛋白提取的最佳条件;由于提取过程中影响因素较多,为确定可溶性蛋白最佳的提取工艺,选取液料比、提取液pH 值、提取时间、提取温度对鳞杯伞可溶性蛋白提取率的影响。
1.3.5.1 液料比对鳞杯伞蛋白提取率的影响
准确称取0.50 g 脱脂样品,加入去离子水,调节液料比 10、20、30、40、50 mL/g,使用浓度为 0.5 mol/L NaOH 溶液和0.5 mol/L HCl 溶液调节提取液pH 值为9.5,提取温度为(45±1)℃,提取时间 40 min。最后,将浸提液在 4 ℃离心(4 500×g/min,10 min),取上清液,采用考马斯亮蓝G-250 法测定提取液中的可溶性蛋白含量,计算蛋白的提取率。
1.3.5.2 提取液pH 值对鳞杯伞蛋白提取率的影响
准确称取0.50 g 脱脂样品,加入去离子水,调节液料比30 mL/g,使用浓度为0.5 mol/L NaOH 溶液和0.5 mol/L HCl 溶液调节提取液 pH 值为 6.5、7.5、8.5、9.5、10.5、11.5,提取温度为(45±1)℃,提取时间 40 min。最后,浸提液在 4 ℃下离心(4 500 ×g/min,10 min),取上清液,采用考马斯亮蓝G-250 法测定提取液中的可溶性蛋白含量,计算蛋白的提取率。
1.3.5.3 浸提温度对鳞杯伞蛋白提取率的影响
准确称取0.50 g 脱脂样品,加入去离子水,调节液料比30 mL/g,使用0.5 mol/L NaOH 溶液和0.5 mol/L HCl 溶液调节提取液pH 值为10.5,震荡水浴摇床温度调节为 25、35、45、55、65 ℃,提取时间 40 min。最后,浸提液在 4 ℃下离心(4 500×g/min,10 min),取上清液,采用考马斯亮蓝G-250 法测定提取液中的可溶性蛋白含量,计算蛋白的提取率。
1.3.5.4 浸提时间对鳞杯伞蛋白提取率的影响
准确称取0.50 g 脱脂样品,加入去离子水,调节液料比为30 mL/g,使用0.5 mol/L NaOH 溶液和0.5 mol/L HCl 溶液调节提取液pH 值为10.5,震荡水浴摇床温度调节为 45 ℃,浸提时间调节为 20、40、60、80、100 min。最后,浸提液在 4 ℃下离心(4 500×g/min,10 min),取上清液。采用考马斯亮蓝G-250 染色法测定提取液中的可溶性蛋白含量,计算蛋白的提取率。
1.3.6 响应面影响因素的确定
依据单因素试验的筛选结果,采用Desig-expert 8.0.6 软件,以鳞杯伞蛋白提取率为响应值,根据Box-Behnken Design 中心组合原理进行实验设计,以液料比、提取液pH 值、提取温度为变量,进行三因素三水平试验设计,如表1 所示;以鳞杯伞可溶性蛋白的提取率为响应值,进行分析试验参数。
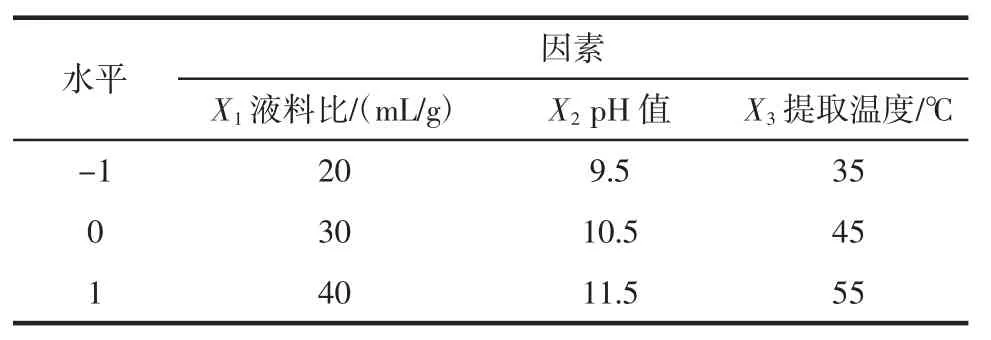
表1 响应面三因素三水平响应面试验设计Table 1 Experiment design of three factors and three levels of response surface method
1.3.7 鳞杯伞蛋白的氨基酸组成与营养价值分析
准确称取冻干的鳞杯伞粗蛋白样品200 mg,置于安瓿中加6 mol/L HCl 溶液定容至10 mL。通入氮气迅速封口后,置于110 ℃烘箱内盐酸水解22 h,将安瓿管取出后迅速冰水浴冷却至室温。然后,将蛋白水解液经滤纸过滤后,用0.01 mol/L HCl 定容至50 mL 的容量瓶,然后准确吸取水解液2.0 mL,置于60 ℃下真空旋转蒸干;继续加入0.02 mol/L HCl 溶液2.0 mL,过0.45 μm 滤膜,即得酸水解液[11]。Biochrom+氨基酸自动分析仪器,上样取20 μL 水解液,分析样品蛋白中水解氨基酸的组成与比例含量;最后,根据氨基酸平衡理论FAO/WHO 的必需氨基酸模式,通过计算氨基酸的化学评分(amino acid score,AAS)来评价鳞杯伞蛋白的营养价值[12-13]。
2 结果与分析
2.1 鳞杯伞子实体粉中基本成分分析
鳞杯伞子实体样品的主要营养成分,如表2 所示。

表2 鳞杯伞子实体的主要成分分析Table 2 Analysis of main components of Clitocybe squamulosa(Pers.)Kumm %
通过分析可以发现鳞杯伞子实体粉中脂肪含量仅有3.27%,粗纤维含量为8.16%,碳水化合物为40.96%,总蛋白含量高达38.57%。据相关报道;猴头菇蛋白的含量为26.3%,白灵菇为25%左右,香菇为19.9%,而平菇为10.5%[14],鳞杯伞子实体中蛋白的含量远高于多数的食用菌。
2.2 单因试验结果分析
2.2.1 液料比对蛋白提取率的影响
在提取温度45 ℃、提取时间40 min、提取液pH 9.5的条件下,探究提取料液比对鳞杯伞可溶性蛋白提取效果的影响,见图2。

图2 液料比对蛋白提取率的影响Fig.2 Effect of liquid-to-solid ratio on protein extraction rate
如图2 所示,当液料比在10 mL/g~30 mL/g 范围内,鳞杯伞可溶性蛋白的提取率,随液料比增加呈显著增加的趋势;当液料比达到30 mL/g 时,可溶性蛋白的溶解度达到饱和,若继续提高液料比增加可溶性蛋白质分子与水分子之间的相互作用,使得蛋白分子在等电点处不易沉淀,导致蛋白在浓缩时残留率增加[15-16]。因此,筛选最佳的液料比为30 mL/g。
2.2.2 提取液pH 值对蛋白提取率的影响
在提取温度45 ℃、提取时间40 min、液料比为30 mL/g 的条件下,探究浸提液pH 值对鳞杯伞可溶性蛋白提取效果的影响,见图3。
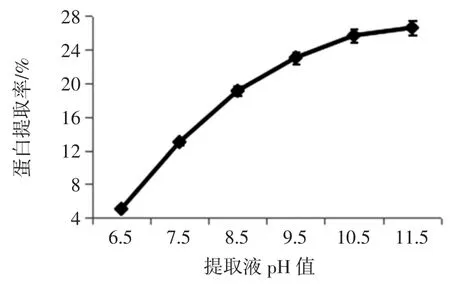
图3 提取液pH 值对蛋白提取率的影响Fig.3 Effect of pH on protein extraction rate
如图3 所示,样品可溶性蛋白的提取率,随着浸提液pH 值升高,可溶性蛋白的提取率呈上升趋势;当浸提液pH 值达到11.5 时,提取液色泽变得越来越深,呈现明显的黑褐色;可能是碱液浓度对蛋白分子中的次级键,导致脱氨、脱羧、肽键断裂,引起胱赖反应,产生有毒缩和氨基酸化合物,最终导致蛋白质营养价值降低[17]。综合考虑;可溶性蛋白最佳的提取pH 值为10.5
2.2.3 提取温度对蛋白得率的影响
在液料比为30 mL/g、提取液pH 值为10.5、提取时间40 min 条件下,探究提取温度对鳞杯伞可溶性蛋白提取效果的影响,见图4。
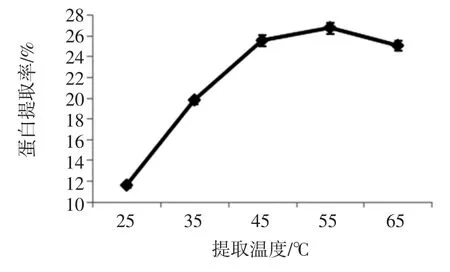
图4 提取温度对蛋白提取率的影响Fig.4 Effect of temperature on protein extraction rate
如图4 所示,随着提取温度的升高,可溶性蛋白质与水分子之间相互作用,增加了蛋白的溶解性,当提取温度在45 ℃时蛋白的提取率基本保持稳定;若继续提高蛋白的提取温度时,可能会导致部分可溶性蛋白变性[18]。因此,选取最佳的提取温度为45 ℃。
2.2.4 提取时间对蛋白得率的影响
在液料比为30 mL/g、提取液pH 值为10.5、提取温度45 ℃的条件下,探究浸提时间对鳞杯伞可溶性蛋白提取效果的影响,见图5。
如图5 所示,在鳞杯伞子实体粉在水浴震荡浸提的初期,随着提取时间延长,蛋白质提取率呈现显著增长的趋势,浸提时间到60 min 时,可溶发性蛋白的提取率保持稳定;选取蛋白浸提时间为60 min。此时,样品蛋白的溶出量达到饱和时,可溶性蛋白的溶出率已趋于平衡[19-20]。
2.3 Box-Behnken试验设计与分析
Box-Behnken 中心组合因素水平编码见表3。
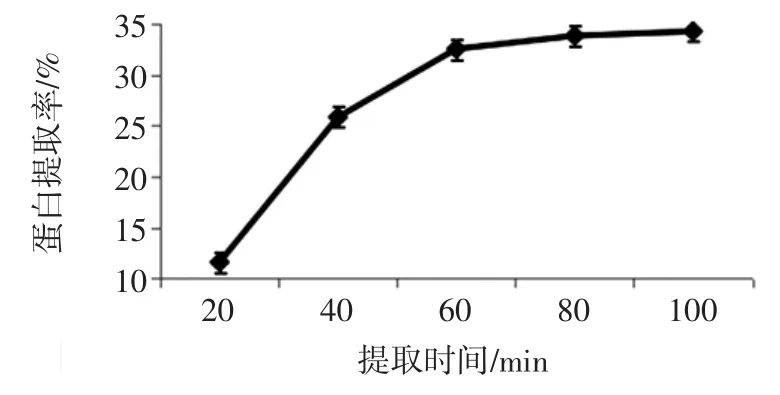
图5 提取时间对蛋白提取率的影响Fig.5 Effect of time on protein extraction rate

表3 Box-Behnken 中心组合因素水平编码Table 3 Independent variables and coded levels in Box-Behnken experimental design
2.4 Box-Behnken试验设计与回归模型方差分析结果
以 X1、X2、X3为响应变量,以鳞杯伞蛋白提取率为响应值,由表3 数据进行分析处理,得到表4 回归方程方差分析表;利用Design-Expert 8.0.6 软件进行非线性的二次多项式拟合,得到多元二次回归方程如下:
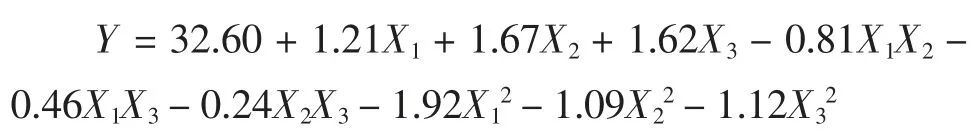
式中:Y 为鳞杯伞可溶性蛋白提取率,%;X1、X2和X3分别为液料比、提取液pH 值、提取温度作为3 个自变量的编码值。鳞杯伞可溶性蛋白提取率与回归方程预测值的相关系数R2=0.965 8,拟合状况良好,表明回归模型方案可行。
通过建立此模型对试验数据进行理论推测,回归方程的系数进行显著性检验;结果如表4 所示,经分析结果,该模型 P<0.01;其中项差异极显著项差异显著;X1X3、X2X3项差异不显著。因此,该模型有实际应用的意义,拟合的二次回归方程具有良好的显著性;可溶性蛋白的提取率失拟项P 值0.866 1>0.05,失拟项差异不显著;此外,该模型F值为21.53,由自变量F 值大小可以得出,这三个因素对蛋白提取率的影响顺序依次是X2>X3>X1,即提取液pH 值>提取温度>液料比。

表4 回归分析结果Table 4 Results of regression analysis
2.5 响应面模型条件优化及验证
利用Design-Expert 8.0.6 软件进行计算与分析,得到鳞杯伞子实体可溶性蛋白提取最佳工艺条件为:液料比为31.24 mL/g、提取液pH 值为11.06、提温度为50.51 ℃、浸提时间为60 min,在此条件下,响应值鳞杯伞蛋白提取率为33.71%。考虑到实际应用的可行性,将提取条件调整为液料比为31 mL/g、提取液pH 值为11.00、提取温度为51℃浸提时间为60 min,在此条件下做3 次平行试验的蛋白提取率为(33.65±0.17)%,经SPSS 软件显著性分析,实际蛋白得率稍低于理论值,差异不显著(P>0.05)。因此,表明采用响应面法优化的模型可靠。
2.6 鳞杯伞蛋白氨基酸组成及营养价值评价
采用碱溶酸沉法制备获得鳞杯伞蛋白中含有17种氨基酸(色氨酸未测),其中蛋白营养价值的优劣主要取决于所含必需氨基酸(essential amino acid,EAA)的种类、数量和组成比例[21]。鳞杯伞蛋白中所含的必需氨基酸组成比例越接近人体需要氨基酸的比例,则其营养价值就越高。通过测定与分析样品蛋白水解氨基酸的结果表明;此蛋白中必需氨基酸的比例接近FAO/WHO 的推荐值,能够满足人体对于氨基酸的基本需求。Biochrom+氨基酸自动分析仪测定鳞杯伞蛋白氨基酸组分色谱图如图6 所示,蛋白样品中氨基酸组分的含量及其营养价值分析见表5 所示。

图6 鳞杯伞蛋白氨基酸分析色谱图Fig.6 Clitocybe squamulosa protein amino acid analysis chromatogram
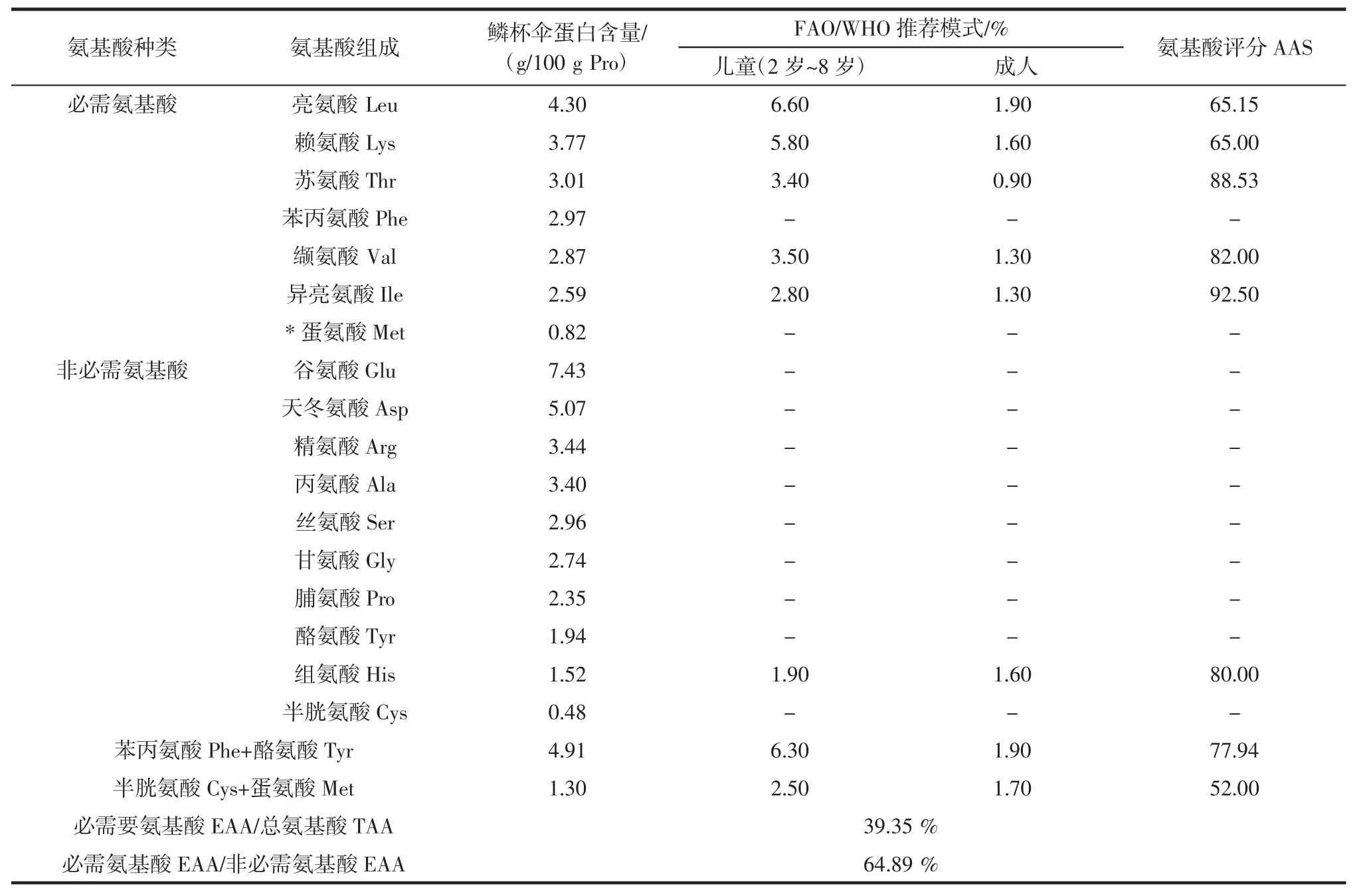
表5 鳞杯伞蛋白氨基酸的组分含量及营养价值分析Table 5 Analysis of component content and nutritional value of clitocybe squamulosa amino acids
3 结论与讨论
本研究通过单因素试验筛选碱溶酸沉法制备鳞杯伞蛋白的提取条件,并在此基础上采用Box-Behnken响应面试验设计得到最佳提取工艺参数:液料比为31.24 mL/g、提取液 pH 值为 11.06、提温度为 50.51 ℃、浸提时间为60 min,在此条件下,鳞杯伞子实体蛋白理论提取率达33.71%。通过建立的回归模型,其决定系数R2=0.965 8,回归模型显著,拟合程度好,能很好地预测碱溶酸沉法制备鳞杯伞可溶性蛋白的提取工艺参数。
通过进一步对提取的鳞杯伞蛋白氨基酸组分含量进行分析及营养价值评价;鳞杯伞蛋白中(除色氨酸外)含有17 种氨基酸,7 种是人体必需氨基酸,必需氨基酸占总氨基酸的比值EAA/TAA 为39.35%,必需氨基酸与非必需氨基酸的比值EAA/NEAA 为64.89%,均接近FAO/WHO 的推荐值。鳞杯伞蛋白氨基酸种类齐全,能够满足成人日常的需要,可以作为一种理想的蛋白质;其中鳞杯伞蛋白中所含的呈味氨基酸(谷氨酸、天冬氨酸、苯丙氨酸、丙氨酸、甘氨酸和酪氨酸)总量为总量的23.55 %,占总氨基酸的比例达到了45.59%。鳞杯伞蛋白呈味氨基酸的组成和比例含量,赋予其良好的风味与鲜味等特点,可以为进一步开发天然呈鲜味物质及其功能性风味食品的研究提供了理论依据。
