红景天当归不同配伍对免疫低下小鼠免疫功能的影响
2020-03-23史顶聪赵宏宇佟晓乐张凤清
史顶聪,赵宏宇,佟晓乐,张凤清,*
(1.长春工业大学化学与生命科学学院,吉林长春130012;2.吉林省中医药科学院,吉林长春130021;3.吉林省集安益盛药业股份有限公司,吉林集安134200)
以免疫力低下和慢性疲劳为主要症状的亚健康问题是21 世纪威胁人类健康的重大问题,亚健康状态以疲劳、活力减退、免疫力降低为主要的临床表现,发生率呈逐年增加的趋势。因此,以提高免疫力和抗疲劳来预防亚健康为切入点具有非常重要的作用。笔者通过以往药理研究发现,红景天[1-3]和当归[4-6]具有很好的活性,已有众多学者研究报道了其药理活性,如抗病毒、抗肿瘤、刺激免疫球蛋白和抗体的产生,增强机体免疫和抗氧化能力等,且抗肿瘤、免疫调节等活性已被应用于临床研究。红景天首载的藏医药著作是《四部典医》,性甘、苦、平,归肺、心经;益气活血,通脉平喘;用于气虚血瘀,胸痹心痛,中风偏瘫,倦怠气喘[7]。当归始记于《神农本草经》谓之“当归味温,主呃逆上气”被列为中品[8]。从国家食品药品监督管理总局查询已注册的国内外具有增强免疫的保健食品,红景天114 种,当归170 种,红景天当归共同使用的有6 种。在笔者查阅相关文献报道中,红景天和当归在各种保健食品中配伍比例不尽相同,效果也各有差异。笔者通过研究红景天和当归不同配伍比例对免疫低下小鼠的作用,给红景天和当归配伍产品的研究开发提供一定科学依据。
1 材料
1.1 动物
雄性 KM 小鼠 210 只,SPF 级,体重为 18 g~22 g:长春生物制品研究所有限责任公司,合格证号SCXK-(吉)2011-0003,由吉林省中医药科学院实验动物伦理委员会审核通过,符合实验动物伦理委员会规定。
1.2 仪器
JA2003B 千分之一天平:上海越平科学仪器有限公司产品;BT418/3 电子天平:深圳市博途电子科技有限公司;723 可见分光光度计:上海菁华科技仪器有限公司;DT5-3 型低速台式自动平衡离心机:北京时代北利离心机有限公司;KDC-2046 低速冷冻离心机:安徽中科中佳科学仪器有限公司;SSW-600-2S 型电热恒温水槽、BXM-30R 立式压力蒸汽灭菌器:上海博讯实业有限公司医疗设备厂。
1.3 药品与试剂
红景天由长春工业大学食品实验室提供,经吉林省中医药科学院牛志多副主任鉴定为红景天为本品为景天科植物大花红景天Rhodiola crenulata(Hook.f.et Thoms.)H.Ohba 的干燥根和根茎。当归由长春工业大学食品实验室提供,经吉林省中医药科学院牛志多副主任鉴定为当归为伞形科植物当归Angelica sinensis(Oliv.)Diels 的干燥根。印度墨水:上海源叶生物科技有限公司;无水碳酸氢钠:分析纯,天津市光复科技发展有限公司,使用时现用现配;巴比妥酸.二水、巴比妥钠:分析纯,国药集团化学试剂有限公司;氯化钠、葡萄糖、柠檬酸钠、柠檬酸、丙酮:分析纯,北京化工厂;2,4-二硝基氟苯(2,4-dinitrofluorobenzene,DNFB):分析纯,北京鼎国昌盛生物技术有限责任公司;麻油:市售。
1.4 样品制备
1.4.1 红景天
将红景天加 70 %乙醇,料液比 1 ∶10(g/mL),回流提取3 次,每次1 h,过滤,滤液合并,滤液减压回收乙醇(60 ℃,-0.06 MPa)得浓缩液,真空干燥(60 ℃,-0.08 MPa),冷却得干膏,粉碎,出膏率为28.6%,有效成分为红景天苷,干膏红景天苷含量为361 mg/100 g。
1.4.2 当归
当归:将当归加水,料液比为 1 ∶10(g/mL),浸泡30 min,水煎煮 3 次,分别为 2、1、1 h,过滤,将提取液减压旋蒸后减压干燥得干膏,粉碎得干膏粉,出膏率为36.8 %,有效成分为粗多糖,干膏粗多糖含量为2.6 g/100 g。
2 方法
2.1 分组与给药
雄性 KM 小鼠 210 只,适应 3 d,随机分为3 个部分(细胞免疫实验、体液免疫实验、非特异性免疫实验),每部分70 只。将每部分的70 只雄性KM 小鼠随机分为 7 组,每组 10 只,即对照组(C 组)、模型组(M组)、红景天组(R 组)、当归组(A 组)、红景天当归质量比 2 ∶1 配伍组(RA1 组)、红景天当归 1 ∶1 配伍组(RA2 组)、红景天当归 1 ∶2 配伍组(RA3 组)。其中,C组和M 组小鼠给予蒸馏水,R 组给予286 mg/(kg·d)红景天提取物,A 组给予368 mg/(kg·d)当归提取物,RA1组、RA2 组、RA3 组分别给予313、327、341 mg/(kg·d)红景天提取物和当归提取物不同配比的样品,各受试物组灌胃剂量均相当于生药材1 000 mg/(kg·d)。各组小鼠均在每天上午 9:00~10:00 按照 10 mL/kg 给予相应受试物,每天1 次,连续30 d,每周称1 次体重,根据体重调整灌胃量。于第 26 天开始,M 组、R 组、A 组、RA1 组、RA2 组、RA3 组小鼠分别按100 mg/(kg·d)腹腔注射环磷酰胺,造成免疫低下模型,连续4 d。
2.2 细胞免疫功能—迟发型变态反应
DNFB 溶液配制:称取DNFB 50 mg,置清洁干燥小瓶中,将预先配好的5 mL 丙酮麻油体积比为1 ∶1溶液,倒入小瓶,盖好瓶塞并用胶布密封,混匀后,备用。
第25 天灌胃后,所有小鼠腹部剪毛,范围约3 cm×3 cm,除C 组外其余组小鼠用新配置的DNFB 溶液50 μL 均匀涂抹腹部致敏,进行初次免疫,C 组以同体积丙酮、麻油的混合液均匀涂抹腹部。5 d 后,除C 组外其余组小鼠用DNFB 溶液10 μL 均匀涂抹于小鼠右耳(两面)进行攻击,C 组以等量丙酮、麻油 1 ∶1 的混合液涂抹右耳。攻击24 h 后,颈椎脱臼处死小鼠,用打孔器取下直径8 mm 的耳片,称重。用耳肿胀度表示迟发变态反应的程度。同时取胸腺和脾脏,计算脏器指数。
耳肿胀度(mg)=右耳质量(mg)-左耳质量(mg)
2.3 体液免疫功能--血清溶血素测定
水杨酸缓冲液(salicylic acid buffer,SA 缓冲液):巴比妥酸0.46 g,氯化镁0.1 g,氯化钙0.2 g,氯化钠8.38 g,碳酸氢钠0.252 g,巴比妥钠0.3 g,加蒸馏水至1 000 mL,25 ℃保存备用。
阿氏液(羊红细胞保护液):葡萄糖2.05 g,柠檬酸钠0.8 g,柠檬酸0.055 g,氯化钠0.42 g,加蒸馏水至100 mL 溶解,pH 值调到6.1,经过114 ℃高压蒸汽灭菌10 min,待冷却后,放置在4 ℃冰箱内,保存备用。
绵羊红细胞制备:绵羊站立,向上固定绵羊脖子,清除脖子部位羊毛后,颈静脉取血。将羊血放入装有灭菌玻璃珠的灭菌锥形瓶中,朝一个方向摇动,以脱纤维,制备绵羊红细胞。按羊红细胞∶阿氏液=1 ∶2 的体积比例,将阿氏液加入到绵羊红细胞中。放置4 ℃冰箱保存备用。一周更换两次保护液。
给予受试物27 d 后,取部分绵羊红细胞,移入灭菌的刻度离心管内,加入生理盐水,混匀后,2 000 r/min离心10 min,去除上清液,再加生理盐水混匀离心,反复洗至上清成清澈透明状,最后将上清弃掉,留下压积的绵羊红细胞(sheep red blood cell,SRBC),用生理盐水配成2%(体积分数)的细胞悬液,每只小鼠腹腔注射0.2 mL 的细胞悬液进行免疫。
补体制备:5 只豚鼠,禁食不禁水5 h 后,10%水合氯醛麻醉,腹主动脉采集豚鼠血,25 ℃放置1 h,2 000 r/min 离心10 min,取上清。另取部分绵羊红细胞,以生理盐水反复洗至上清成清澈透明状,将上清弃掉,留下压积的红细胞(SRBC),按 SRBC ∶豚鼠血清=1 ∶5(体积比)的比例,将SRBC 加入到豚鼠血清中,放入 4 ℃冰箱 30 min,2 000 r/min 离心 10 min,取上清,-70 ℃保存。用时以 SA 缓冲液按 1 ∶8 体积比稀释。
给予受试物30 d 后,小鼠称重,摘除眼球,取血于离心管内,放置约1 h 后,低速冷冻离心机2 000 r/min离心10 min,吸取血清备用。取小鼠血清,用SA 缓冲液稀释200 倍。吸取1 mL 的稀释后血清置试管内,依次加入0.5 mL10%(体积比)SRBC,1 mL 补体(用 SA缓冲液按1 ∶8 稀释)。另设不加血清的对照管(以SA 缓冲液代替)。置37 ℃恒温水浴中保温15 min 后,冰浴终止反应。2 000 r/min 离心10 min,取上清液1 mL,加都氏试剂3 mL,同时取10%(体积分数)SRBC 0.25 mL 加都氏试剂至4 mL,充分混匀,放置10 min 后,于540 nm处以对照管调零,分别测定各管吸光度。溶血素的量以半数溶血值(HC50)表示,按下列公式计算:
样品HC50=(样品管吸光度值/SRBC 半数溶血时管的吸光度值)×稀释倍数
2.4 非特异性免疫—碳廓清实验
各组小鼠于末次给药1 h 后,将各组小鼠称量体重,各组小鼠按0.01 mL/g 平行由尾静脉注入按1 ∶3体积比加蒸馏水稀释的印度墨汁。待墨汁注入小鼠静脉后,立即记录注入时间。小鼠注入墨汁后2、10 min,分别从小鼠内眦静脉丛取血20 μL,立即将其加到盛有2 mL 0.1%碳酸钠溶液试管中。用723 分光光度计在600 nm 波长处测光密度值(OD),以Na2CO3溶液作空白对照。
将小鼠处死,摘取小鼠肝脏和脾脏,用滤纸吸干脏器表面血污,用千分之一天平称重。以吞噬指数表示小鼠碳廓清的能力。按下式计算吞噬指数a。
K=(lgOD1-lgOD2)/(t2-t1);吞噬指数a=体重/(肝重+脾重)×K1/3
式中:K 为吞噬速率(未经矫正的吞噬指数);OD1为t1血标本的OD 值;OD2为t2血标本的OD 值;t1为注入墨汁后第一次取血时间(2 min);t2为注入墨汁后第二次取血时间(10 min)。
2.5 统计学方法
3 结果与分析
3.1 测定结果
与模型组相比较,红景天和当归不同比例对小鼠的胸腺、脾脏均有影响,红景天和当归单独作用效果不明显,结果见表1。
表1 红景天当归不同配伍对小鼠脾脏、胸腺指数的影响(n=10,)Table 1 Effects of different compatibility of rhodiola and angelica on spleen and thymus index of mice(n=10,)

表1 红景天当归不同配伍对小鼠脾脏、胸腺指数的影响(n=10,)Table 1 Effects of different compatibility of rhodiola and angelica on spleen and thymus index of mice(n=10,)
注:-表示等条件下按10 mL/(kg·d)蒸馏水灌胃;*表示P<0.05,与M组比较具有差异性;**表示P<0.01,与M 组比较具有显著差异性。
胸腺指数/(g/10 g)C 组 10 - 4.52±0.77**3.29±0.61**M 组 10 - 3.67±0.55 2.48±0.91 R 组 10 286 4.03±0.69 2.87±0.81 A 组 10 368 3.99±0.60 2.74±0.49 RA1 组 10 313 4.21±0.61*2.97±0.53*RA2 组 10 327 4.27±0.53*2.99±0.51*RA3 组 10 341 4.13±0.55*2.94±0.44*组别 小鼠只数 灌胃量/(mg/kg)脾脏指数/(g/10 g)
与C 组比较,M 组的脾脏、胸腺指数均显著降低,具有统计学意义(P<0.01),与 M 组比较,R 组和 A 组各指数均有所升高但无显著性,不具有统计学意义(P>0.05),RA1 组、RA2 组和 RA3 组脾脏、胸腺指数均明显升高,具有统计学意义(P<0.05),RA2 组各项指数略高于RA1 组和RA3 组。
3.2 细胞免疫实验测定结果
细胞免疫实验中,与模型组相比较,红景天和当归不同比例中RA2 组效果明显,其余各组作用效果不明显,结果见表2。
与C 组比较,M 组左右耳肿胀差值显著低于C组,具有统计学意义(P<0.01),与 M 组比较,R 组、A组、RA1 组、RA3 组左右耳肿胀差均高于 M 组,但不具有统计学意义(P>0.05),RA2 组左右耳肿胀差明显高于 M 组,具有统计学意义(P<0.05)。
表2 细胞免疫实验测定结果(n=10,)Table 2 Cellular immunoassay results(n=10,)

表2 细胞免疫实验测定结果(n=10,)Table 2 Cellular immunoassay results(n=10,)
注:-表示等条件下按10 mL/(kg·d)蒸馏水灌胃;*表示P<0.05,与M 组比较具有差异性;**表示P<0.01,与M 组比较具有显著差异性。
组别小鼠只数灌胃量/(mg/kg) 左右耳肿胀差/mg C 组 10 - 5.28±0.89**M 组 10 - 3.88±1.21 R 组 10 286 4.31±1.08 A 组 10 368 4.25±0.97 RA1 组 10 313 4.56±1.11 RA2 组 10 327 4.85±0.91*RA3 组 10 341 4.43±1.06
3.3 体液免疫实验测定结果
体液免疫实验中,与模型组相比较,红景天和当归不同比例对小鼠的半数溶血值(200 倍稀释)效果均较为明显,红景天个当归作用效果不明显,结果见表3。
表3 体液免疫实验测定结果(n=10,)Table 3 Results of humoral immunity test(n=10,)
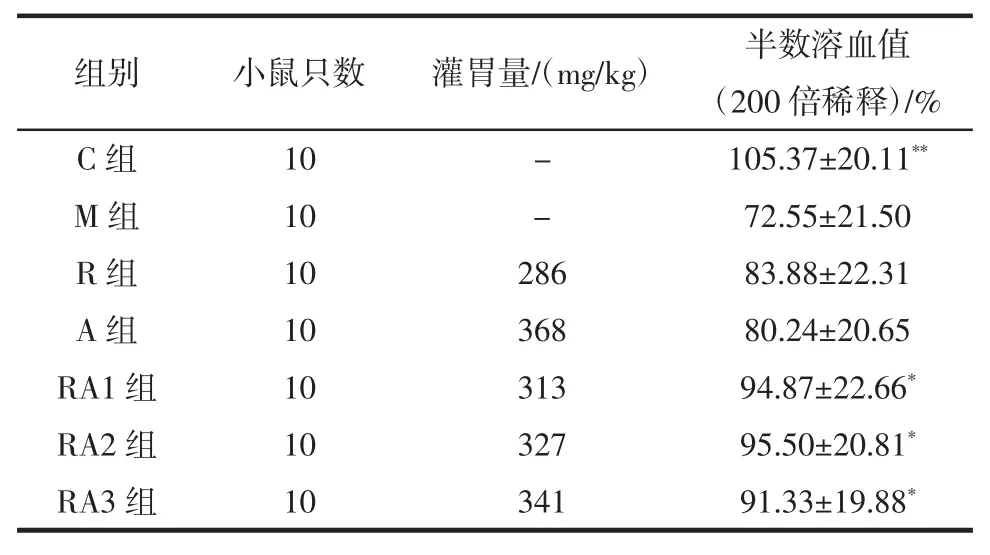
表3 体液免疫实验测定结果(n=10,)Table 3 Results of humoral immunity test(n=10,)
注:-表示等条件下按10 mL/(kg·d)蒸馏水灌胃;*表示P<0.05,与M组比较具有差异性;**表示P<0.01,与M 组比较具有显著差异性。
组别小鼠只数灌胃量/(mg/kg)半数溶血值(200 倍稀释)/%C 组 10 - 105.37±20.11**M 组 10 - 72.55±21.50 R 组 10 286 83.88±22.31 A 组 10 368 80.24±20.65 RA1 组 10 313 94.87±22.66*RA2 组 10 327 95.50±20.81*RA3 组 10 341 91.33±19.88*
与 C 组比较,M 组 HC50显著降低,具有统计学意义(P<0.01),与 M 组比较,R 组和 A 组 HC50有所升高,无统计学意义(P>0.05),RA1 组、RA2 组、RA3 组明显升高,具有统计学意义(P<0.05),RA2 组略高于RA1组和RA2 组。
3.4 非特异性免疫实验测定结果
非特异性免疫实验中,与模型组相比较,各组对小鼠的吞噬数率和吞噬指数均有明显的影响,结果见表4。
与C 组比较,M 组K 值显著降低,具有统计学意义(P<0.01),吞噬指数(α)明显降低,具有统计学意义(P<0.05),与 M 组比较,R 组、A 组、RA1 组、RA3 组吞噬速率(K)值明显升高,具有统计学意义(P<0.05),RA2 组 K 值显著升高,具有统计学意义(P<0.01),R组、A 组、RA1 组、RA2 组、RA3 组吞噬指数 α 明显升高,均具有统计学意义(P<0.05)。
表4 非特异性免疫实验测定结果(n=10,)Table 4 Non-specific immunoassay results(n=10,)

表4 非特异性免疫实验测定结果(n=10,)Table 4 Non-specific immunoassay results(n=10,)
注:-表示等条件下按10 mL/(kg·d)蒸馏水灌胃;*表示P<0.05,与M组比较具有差异性;**表示P<0.01,与M 组比较具有显著差异性。
组别 小鼠只数 灌胃量/(mg/kg)吞噬速率K(×100) 吞噬指数α 5.15±0.66*M 组 10 - 2.88±0.80 4.20±0.74 R 组 10 286 3.66±0.77*4.94±0.77*A 组 10 368 3.71±0.81*5.05±0.62*RA1 组 10 313 3.79±0.88*5.04±0.69*RA2 组 10 327 3.99±0.96**5.11±0.71*RA3 组 10 341 3.80±0.91*5.10±0.77*C 组 10 - 4.13±1.05**
4 讨论与结论
医学研究表明,免疫系统是由免疫器官、免疫细胞和免疫分子等组成。免疫系统具有抗感染的免疫防御功能,具有能够及时识别、清除体内损伤或衰老细胞的免疫自稳功能。具有能够及时识别细胞复制错误或细胞突变并将其清除的免疫监视功能[9]。研究表明,正常的免疫功能对机体有利,对异体抗原如病原微生物、细菌毒素等产生排斥反应,发挥免疫保护作用;但当免疫功能异常时可造成机体自身组织损伤,导致超敏反应、免疫缺陷及自身免疫病等[10]。本研究就细胞免疫,体液免疫和非特异性免疫三方面指标进行了动物体内实验,综合评价红景天提取物和当归提取物不同配伍对免疫功能的调节作用。
红景天能刺激B 细胞和巨噬细胞活化淋巴细胞产生白细胞介素-12[11-12](interleukin-12,IL-12),IL-12可刺激活化型 T 细胞增殖,促进 Th1 细胞分化[11,13-14];IL-12 诱导细胞毒性T 淋巴细胞(cytotoxic T lymphocyte,CTL)和NK 细胞的细胞活性并促进其分泌γ-干扰素(interferon-γ,IFN-γ)[15],促进抗原呈递、提高 NK细胞活性和巨噬细胞溶酶体活性。红景天能明显增加免疫球蛋白 G(immunoglobulin G,IgG)的含量[16-17],促发抗体依赖的细胞介导的细胞毒作用[17-18](antibodydependent cell-mediated cytotoxicity,ADCC) 效应,IgG抗体通过Fab 段与靶细胞表面抗原决定簇特异性结合后,其 Fc 段[19]可与有 FcγR 的杀伤细胞 NK 细胞结合,触发效应细胞的杀伤活性,直接杀伤靶细胞。红景天苷灌胃小鼠后能明显促进小鼠脾细胞的增殖反应,增强脾细胞对白细胞介素-2(interleukin-2,IL-2)的反应性,增加小鼠脾细胞对T 细胞分泌的淋巴因子IL-2 的分泌[11,20],从而表现出红景天苷具有明显调解和增强机体免疫力的功能。
当归在促进单核巨噬细胞活化后,作用于各种免疫效应细胞,产生相应的细胞因子并参与机体的神经、体液及内分泌系统来实现增强免疫。临床研究表明,当归多糖可以激活不同种类的免疫细胞,同时也可以激活补体系统,促进细胞因子的生成,对免疫系统起恢复调节的作用[21]。当归多糖直接作用于外周血中的免疫细胞后,髓系单核细胞表面特异性分子CDl4表达增强,同时使单核细胞表面、在免疫应答中发挥重要作用的第二信号分子CD86 分子表达也明显增加[22]。当归多糖作用于巨噬细胞后可使IL-2,白细胞介素-4(interleukin-4,IL-4),白细胞介素-6(interleukin-6,IL-6),和 IFN-γ 表达增加,IL-6 和 IFN-γ 增加迅速,IL-2 的增加要稍后一些。表明首先作用于非特异性免疫细胞如巨噬细胞和NK 细胞,随后影响辅助T细胞,同时对B 细胞也具有潜在的活化作用,增加抗体的产生[23]。
中药配伍传统意义,在中医临床上,基于病情需要根据药性的特点配伍使用,不是药物的简单相加,是以传统中医药理论为基础,辨证论治,并结合中药药性理论,遵守“君臣佐使”的配伍原则,使之成为“有制之师”,最终实现“整体综合调节”的目标[24]。因此中药药性理论是指导中医临床用药的关键[25]。现代研究表明中药配伍能够将特定组分进行整合,达到多靶点、多途径发挥药效的作用[26]。红景天刺激B 细胞和巨噬细胞分泌IL-12,IL-12 促进Th1 细胞分化,产生IFN-γ,而当归作用于巨噬细胞,使 IL-6 和 IFN-γ 迅速增加;红景天促进IL-2 和IL-12 的分泌弥补当归促进IL-2 分泌的延迟和不足,说明红景天与当归对小鼠的免疫作用有不同的靶点。
本次实验结果,M 组各项指标均显著低于C 组,具有统计学意义(P<0.01),说明本次实验造模成立,配伍组各项指标均明显高于M 组,具有统计学意义(P<0.05),说明红景天与当归配伍对免疫低下小鼠具有增强免疫的作用。本次实验配伍组各项指标均高于R 组和A 组,其中红景天当归1 ∶1 配伍组各项指标高于其余各组,红景天和当归配伍可能产生了协同作用,也印证了这一点。但其具体通过何种途径发挥作用,以及T、B 细胞在此免疫调节中的具体作用有待于今后从分子水平、体外实验等进一步阐明。
