免疫检查点抑制剂相关肾损伤
2020-03-23任贵生综述黄湘华审校
任贵生 综述 黄湘华 审校
肿瘤免疫治疗已经有了100多年的历史,但进展缓慢。直到2011年,以Allison和Tasuku Honjo的发现为基础,FDA批准首个免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)用于晚期黑色素瘤的二线治疗,标志着肿瘤免疫治疗进入了新时代[1-2]。ICIs在发挥卓越的抗肿瘤作用的同时,也不可避免地存在各种不良反应,影响患者的预后。肾脏在肿瘤患者的药物清除、容量稳定、电解质和酸碱平衡等方面发挥着关键的作用,因此研究ICIs对肾脏的影响及患者出现肾损伤后的处理具有重要意义。本文将对ICIs的肾脏损伤进行综述,以帮助临床医生更好地认识和处理这一并发症,改善患者预后。
ICIs肾脏损伤的机制
人类免疫系统的抗肿瘤作用依赖于“肿瘤免疫循环”[3],即抗原递呈细胞(APC)摄取并递呈肿瘤抗原给次级淋巴器官中的T细胞,导致细胞毒性T细胞(CTL)活化,最终识别、浸润和杀伤肿瘤细胞。这个过程需要3个重要信号通路的参与,即T细胞抗原受体(TCR)与肿瘤细胞MHC分子的结合、共刺激分子(CD28-B7)或共抑制分子的结合和细胞因子或其他的信号分子之间的结合。其中,ICIs主要作用于第2个信号通路,发挥强大的抗肿瘤作用。细胞毒性T淋巴细胞抗原4(CTLA-4)竞争性地与B7结合,阻碍CD28-B7共刺激信号的产生,抑制机体对肿瘤细胞的杀伤,而抗CTLA-4单抗可解除这种抑制作用。T细胞所表达的程序细胞死亡蛋白1(PD-1)是一种共抑制分子,而肿瘤细胞则会过表达程序细胞死亡蛋白配体1(PD-L1),两者的结合会负向调节免疫系统的抗肿瘤作用。因此,无论是抗PD-1单抗还是抗PD-L1单抗均可打断这种负向调节,重新激活免疫系统(图1)[4]。迄今,FDA已批准6种ICIs应用于临床,治疗多种恶性肿瘤(表1)[5]。

图1 ICIs的抗肿瘤机制[4]

表1 已获FDA批准的6种ICIs及其适应证[5]
ICIs:免疫检查点抑制剂;CTLA-4:细胞毒性T淋巴细胞抗原4;PD-1:程序细胞死亡蛋白1;PD-L1:程序细胞死亡蛋白配体1
事实上,ICIs的应用是一把双刃剑。免疫系统功能加强,除了发挥强大的抗肿瘤效应外,还可能导致正常组织的免疫性损伤,称之为免疫相关的不良反应(immune-related adverse events,IrAE)。传统意义上ICIs导致的irAE包括皮疹、结肠炎、肝炎和下垂体炎(表现为垂体前叶功能减退及蝶鞍占位性病变)[6],而肾损伤相对罕见。但是,随着这类药物的广泛应用,肾损伤的报道也越来越多。ICIs可能通过多种途径损伤肾脏(图2)[7]。首先,ICIs可诱导产生自身抗体,攻击肾脏。有报道发现,患者在使用伊匹单抗后出现大量蛋白尿,伴自身抗体阳性,在停伊匹单抗并换激素治疗后,患者尿检缓解,自身抗体转阴[8]。Raschi等[9]检索了FDA不良反应报告系统(FDA adverse event reporting system,FAERS),发现4870 例与ICIs相关的风湿病事件,包括2例狼疮样综合征。再者,某些正常组织可表达相应受体,与ICIs相结合,触发免疫反应。Caturegli等[10]报道了1例接受抗CTLA-4单抗后出现严重下垂体炎的患者。免疫组化显示,坏死的垂体内分泌细胞显著表达CTLA-4,同时发现垂体细胞中有抗IgG2抗体和C4d的沉积。虽然肾脏并不表达CTLA-4,但小管上皮细胞表达PD-L1,因此类似的机制可能在抗PD-L1单抗导致的肾损伤中发挥作用。此外,在接受ICIs治疗后,新生或者反应性T细胞可能会脱靶,与肾组织发生交叉反应。Johnson等[11]发现,1例接受ICIs治疗后出现心肌炎的患者心肌细胞和骨骼肌细胞中存在弥漫性CD4+T细胞和CD8+T细胞浸润,与肿瘤组织中一致,这可能与心肌细胞、骨骼肌细胞和肿瘤细胞的抗原具有一定同源性有关。目前,尚无研究阐述肾组织与肿瘤细胞是否具有相同的抗原表位。ICIs导致肾脏损伤的第4种可能机制是诱导潜伏状态的药物特异性T细胞再活化。Koda等[12]发现,在同时接受兰索拉唑和尼鲁单抗治疗时出现急性间质性肾炎(AIN)的患者体内可检出针对兰索拉唑的药物特异性T细胞。最后,ICIs可促使T细胞释放炎症因子和趋化因子,造成肾脏损伤。有研究发现,在接受伊匹单抗和尼鲁单抗治疗后出现AIN的患者血清中,TNF-α等细胞因子水平升高[4]。
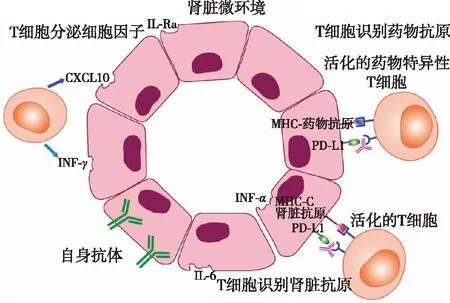
图2 ICIs损伤肾脏的机制[7]
ICIs肾脏损伤的临床表现
ICIs的肾毒性主要表现为急性肾损伤(AKI)。在过去的临床试验中,约1%~1.7%的患者使用ICIs单药治疗后出现血清肌酐(SCr)上升,不良事件通用术语评价标准(common terminology criteria for adverse events,CTCAE v3或v4)3~4级的比例约为0.2%~0.8%,而不同ICIs联合应用导致4.9%~5.1%的患者SCr上升,3~4级的比例为1.7%~2.2%[2,13-17]。在发生AKI的患者中只有约15%出现少尿或高血压[4],大部分无临床表现,因此,对于接受ICIs治疗的患者密切监测SCr非常重要,否则容易发生漏诊。
与其他药物不同的是,ICIs导致的AKI往往发生在开始用药较长时间之后。在Shirali等[18]的报道中,6例患者在接受了尼鲁单抗、帕博利珠单抗治疗的3~16个月(中位10.5个月)后发生AKI[18]。其中,4例患者有非甾体类抗炎药(NSAID)或质子泵抑制剂的使用史, 2例患者在发生AKI前曾出现下垂体炎,4例患者有白细胞尿,患者的SCr峰值为1.8~10.6 mg/dl(中位4.1 mg/dl),无一例患者需要接受肾脏替代治疗。Cortazar等[19]报道了13例接受依匹单抗、尼鲁单抗、帕博利珠单抗单药或联合治疗后发生AKI的患者,AKI发生时间为开始用药的2~6个月(中位3个月)之后。其中,8例患者有NSAID、质子泵抑制剂等药物的使用史,8例患者有下垂体炎、甲状腺炎、肠炎等肾外IrAEs,患者的SCr峰值为3.6~7.3 mg/dl(中位4.5 mg/dl),2例患者最终进展为终末期肾病(ESRD)。Mamlouk等[20]对接受ICIs后出现AKI的16例患者进行了长达10年的随访[20]。他们发现,从开始用药到发生AKI的中位时间为14周,并且接受抗PD-1单抗治疗的患者时间长于接受抗CTLA-4单抗的患者。12例患者出现白细胞尿,8例患者出现镜下血尿,10例患者出现小管性的蛋白尿,3例患者出现肾病范围内的蛋白尿。
ICIs肾脏损伤的病理特点
大部分ICIs导致的AKI肾脏病理表现为AIN,可见大量淋巴细胞、少量浆细胞和嗜酸性粒细胞浸润于间质,与其他药物导致的AIN并无明显区别[4,18,21-22]。在Cortazar等[19]的报道中,ICIs导致的AIN间质浸润的淋巴细胞主要是CD3+CD4+T细胞[19]。除了AIN外,急性肾小管损伤(ATI)也不少见。Izzedine等[23]发现,12例接受了帕博利珠单抗后出现AKI的患者中有5例病理表现为ATI[23]。
除了小管间质损伤外,ICIs引起的肾小球病变也不能忽视[24-28]。此时,患者除了SCr升高外,往往合并不同程度尿检异常甚至肾病综合征。Mamlouk等[20]发现,接受ICIs治疗后出现肾损伤的患者的肾小球病变表现多样。其中,1例患者在接受伊匹单抗和尼鲁单抗联合治疗2疗程后,SCr从1.3 mg/dl升至2.4 mg/dl,尿检提示大量蛋白尿及镜下血尿,肾活检提示IgA肾病伴有轻度急性小管间质病变。另一例患者在接受尼鲁单抗治疗6疗程后出现AKI伴大量蛋白尿,抗磷脂酶A2受体抗体阴性,肾活检提示膜性肾病(MN)合并急性小管间质病变,激素治疗后缓解。还有一例患者在接受帕博利珠单抗治疗6疗程后出现AKI伴大量蛋白尿,肾活检示刚果红染色阳性,经质谱分析确定为AA型淀粉样变性。Fadel等[8]报道了一例转移性黑色素瘤患者,在接受伊匹单抗治疗6周后出现肾病综合征,伴有ANA及A-dsDNA阳性,肾活检结果提示狼疮性肾炎Ⅴ型。在停用伊匹单抗并使用泼尼松治疗后,患者蛋白尿获得缓解,自身抗体转阴。在Izzedine等[23]的研究中,12例接受了帕博利珠单抗后出现肾损伤的患者中有2例表现为微小病变型肾病(MCD)。此外,肉芽肿性多血管炎(GPA)、血栓性微血管病(TMA)等也有报道[19,29]。
ICIs肾脏损伤的处理
由于AIN是ICIs所致AKI的主要病理类型,因此糖皮质激素是首选治疗药物。在Cortazar等[19]的研究中,13例患者有12例病理表现为AIN,其中有10例接受了糖皮质激素的治疗。这10例患者中有2例获得完全缓解(SCr下降至不超过基线水平0.35 mg/dl),9例获得部分缓解(SCr超过基线水平0.35 mg/dl,但小于两倍),1例无反应,最终进入ESRD。需要注意的是,该研究同时发现,激素减量过快易导致病情复发,而对于激素依赖的患者,激素联合免疫抑制治疗可起到较好的效果。其他的一些研究也同样证实了激素治疗的有效性[18,30]。此外,Horvat等[31]的研究发现,糖皮质激素的使用并不影响黑色素瘤患者对抗肿瘤治疗的反应及预后,但该结论是否适用于其他类型的肿瘤患者尚待进一步研究。
需要注意的是,很多原因可导致肿瘤患者发生AKI,包括缺血或肾毒性药物导致的肾小管损伤、NSAID或质子泵抑制剂等药物引起的AIN、各种各样的肾小球病变、结晶性肾病、尿路梗阻等。因此,使用ICIs后出现AKI的患者应详细询问病史、完善各项检查,必要时行肾活检,争取明确肾脏损伤是否与ICIs相关。即使病理改变以AIN为主,ICIs也可能仅仅是导致AIN的原因之一,由于停用ICIs可能会促进肿瘤的发展,因此对患者的处理一定要慎重,最好由肾脏科医生和肿瘤科医生讨论决定。在使用ICIs后SCr缓慢上升可能具有提示意义,但如果不严密监测,很可能会被忽略。如果患者同时合并下垂体炎、结肠炎等肾外IrAE,那么AKI与ICIs相关的可能性很大,但根据既往报道,ICIs所致AKI合并肾外IrAE的比例并不高[18-19]。
在临床上,可根据AKI的程度决定下一步的治疗策略。对于AKI 1期的患者,应密切监测SCr,如SCr自然下降,可不停药。对于SCr继续上升,或AKI 2期、3期的患者,应立即停药,积极寻找AKI的原因。如果考虑AKI是由其他药物的毒性或者尿路梗阻等因素引起的,在对症处理、SCr下降后可再次给予ICIs治疗;如果AKI同时合并肾外IrAE,则高度怀疑AKI是ICIs所致,可直接使用糖皮质激素;如果通过临床资料无法做出判断,则应行肾活检指导下一步治疗(图3)[32]。
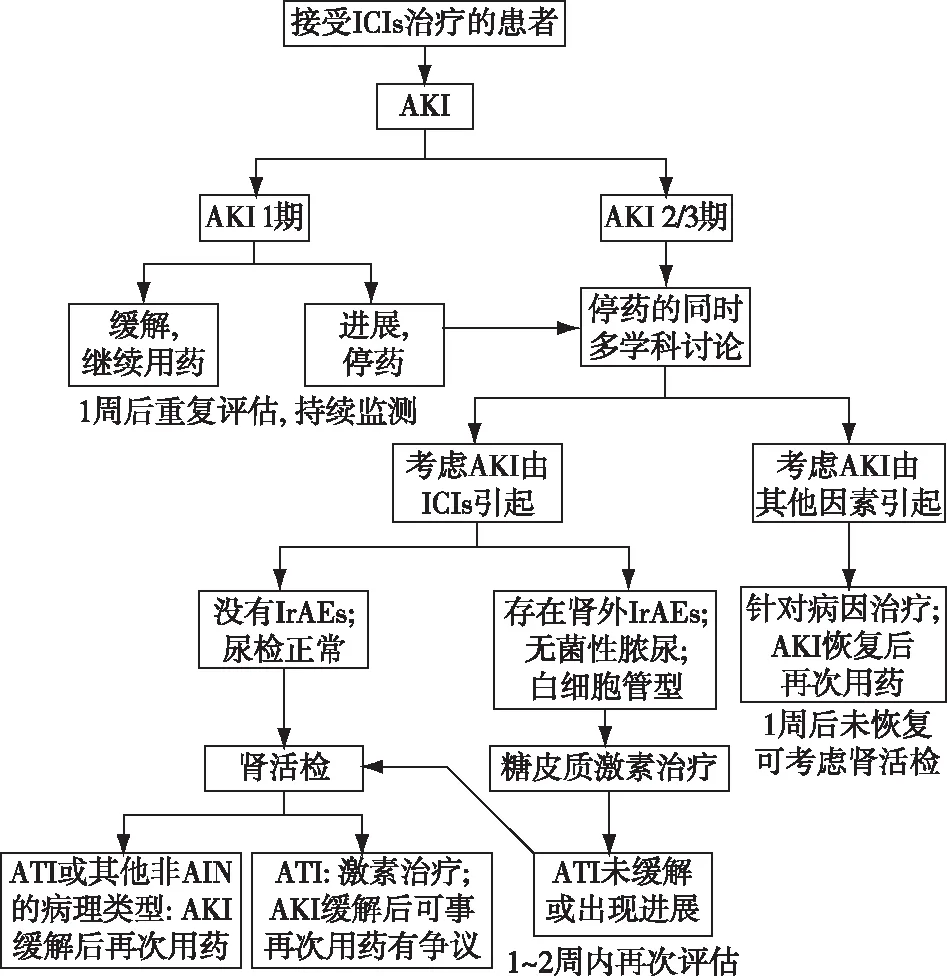
图3 接受ICIs治疗后出现AKI 的患者的处理流程[32]
小结:作为肿瘤治疗里程碑式的药物,ICIs在发挥强大抗肿瘤作用的同时可通过多种机制损伤肾脏,特别是联合用药的时候。ICIs导致的肾损伤临床上主要表现为无症状的AKI,起病隐匿,与用药间隔时间长,因此治疗过程中需要密切监测SCr。肾小管间质损伤是主要的病理表现,但有时可合并形式多样的小球病变,此时临床上可出现不同程度的尿检异常。多种因素可导致肿瘤患者出现AKI,仅从临床表现有时难以确定是否由ICIs引起,此时行肾活检有助于鉴别。治疗上,可根据SCr升高的程度决定是否需要停药及使用激素,动态监测SCr,调整治疗方案,使患者获得最好的预后。
