儿童肾移植多学科管理模式的探讨
2020-03-23刘娇娇翟亦晖方晓燕芳汤小山刘佳璐毕允力吴冰冰朱有华明朱同玉
沈 茜 刘娇娇 翟亦晖 陈 径 方晓燕 饶 佳 林 芳汤小山 刘佳璐 毕允力 吴冰冰 张 雷 朱有华 许 明朱同玉 曾 力 徐 虹
肾移植是终末期肾病(ESRD)儿童肾替代治疗的最佳选择,不仅可提高患儿长期生存率,而且可改善其生活质量,保障正常的学习和生活[1-2]。随着对儿童尿毒症治疗趋势的认识及共识的制定,肾移植受到越来越多的青睐[3-4]。自2010年人体器官捐献工作开展以来,越来越多的低龄尿毒症儿童有机会接受肾移植。然而,儿童在原发病、器官功能、免疫及生理状态等方面具有其自身特点,相应在肾移植术前评估、术中处理和术后管理等环节均有别于成人,因此儿童肾脏科-成人移植科医师有必要协同合作,以期提高儿童肾移植受者的预后。
复旦大学附属儿科医院肾脏科自2011年起与海军军医大学附属长海医院、复旦大学附属中山医院肾移植科合作开展器官捐献供肾-儿童肾移植工作,采用儿童肾脏科与成人移植科密切合作的管理方式,术前-术中-术后对肾移植儿童进行闭环管理。本研究将从儿内科角度出发,分析闭环管理模式下的儿童肾移植长期预后,重点探讨术前及术后管理在儿童肾移植中的意义及价值。
资料与方法
纳入对象回顾性分析2011年1月至2019年5月复旦大学附属儿科医院肾脏科-移植科(海军军医大学附属长海医院、复旦大学附属中山医院)闭环管理模式下开展的肾移植患儿的病例资料,包括受者年龄、性别、身高、体重、原发病、移植前肾替代治疗方式及移植前慢性肾脏病(CKD)并发症控制情况,待肾时间,随访终点移植肾及受者的存活情况,移植肾失功和受者死亡原因等资料。纳入标准:(1)年龄<18岁;(2)首次肾移植;(3)单器官肾移植。
闭环管理模式(1)移植前复旦大学附属儿科医院肾脏科全面评估和综合管理:包括原发病诊断和干预,评估肾移植术后原发病复发风险;等待肾移植期间给予慢性透析治疗,评估透析充分性并纠正CKD并发症如贫血、代谢性骨病、高血压等;移植前免疫状态评估、感染风险评估和预防接种;社会-心理评估及健康教育。(2)围手术期处理:配型成功后,至成人移植科行肾移植手术及移植早期外科并发症处理。(3)移植术后随访管理:根据患儿状态,移植后1周至4周内转诊至儿童肾脏科,进行免疫状态及血药浓度检测,与移植科医师商议后进行免疫抑制剂调整;感染、排斥反应等内科并发症的定期监测和治疗;儿童营养及生长发育状态评估(图1)。
统计学方法所有数据采用《SPSS 25.0》软件进行分析。符合正态分布的计数资料用均数±标准差,不符合正态分布的计数资料用中位数(四分位数)表示;分类变量用数值及百分数表示。受者及移植肾生存情况采用Kaplan-Meier进行生存分析。
结 果
一般资料
受者一般情况 2011年1月至2019年5月间符合入组条件的肾移植儿童共129例,其中男性67例。129例ESRD患儿中,124例(96%)患儿移植前接受透析治疗。移植年龄为10.6±3.8岁,移植时中位体重27 kg(21.5~36) kg。中位待肾时间1.3年(0.6~2.0)年。移植后中位随访时间2.0年(1.1~4.8)年。
供者信息 129例公民逝世后器官捐赠供者中,104例为儿童供者(16例为新生儿双肾整块移植);5例为成人供者;另20例供者年龄不详。儿童供者中位年龄1.5岁(11月~3岁)。
肾移植前管理
原发病诊断 129例患儿原发病可分为先天性肾脏和尿路畸形(CAKUT),遗传性肾病,肾小球肾炎,囊性肾病,其他和病因不明6大类(表1),其中86%的患儿原发病诊断明确,CAKUT和遗传性肾病为其主要病因,分别占28.6%和27.9%。
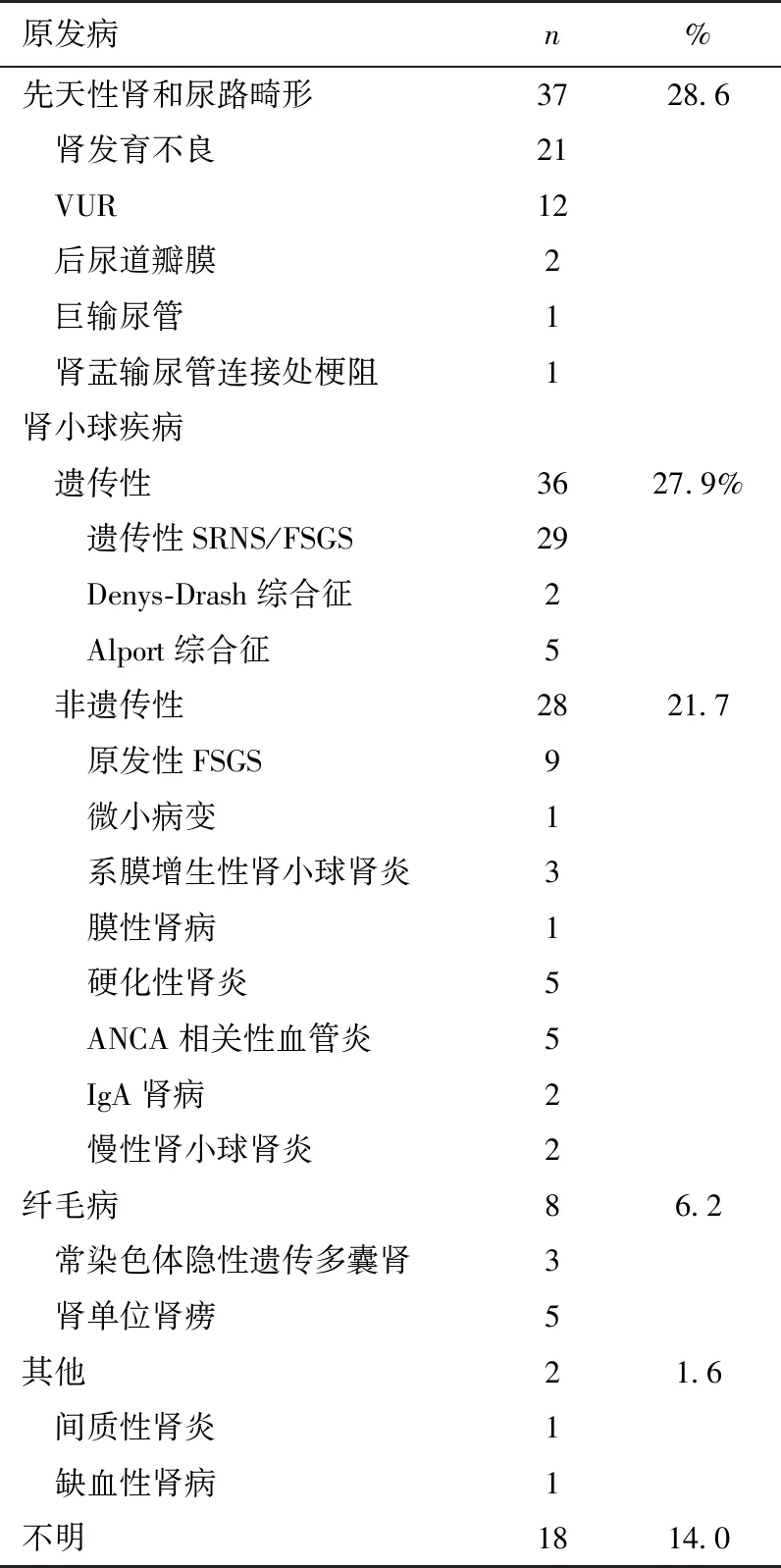
表1 129例终末期肾病患儿原发病构成比
FSGS:局灶节段性肾小球硬化;ANCA:抗中性粒细胞胞质抗体;VUR:膀胱输尿管反流;SRNS:激素耐药肾病综合征
移植前肾替代治疗 129例肾移植受者中124例移植前行血液透析(10例)或腹膜透析(114例)治疗。移植前中位透析时间1.3(0.7~2.0)年。
CKD并发症控制情况 慢性肾替代治疗期间,对CKD并发症进行纠正,肾性贫血、钙磷代谢、左室肥厚指数等均得到很好控制(表2)。
肾移植术后管理
排斥情况 根据患儿临床表现,并排除感染及移植肾血管因素,结合血供者特异性抗体(DSA)结果和(或)移植肾活检组织病理结果综合判断。术后14例(10.8%)受者(其中4例经肾穿病理确诊)发生排斥反应,包括急性排斥反应12例,慢性排斥反应2例。12例急性排斥反应患者给予甲强龙冲击及丙球治疗有效;2例因慢性排斥反应导致移植肾丢失。
感染情况 63例(48%)肾移植儿童术后随访期间发生感染,以细菌感染为主,其次为病毒感染 (表3)。其中2例因耐药菌脓毒症治疗无效死亡,1例因真菌性肺部感染合并CMV感染死亡,其余病例经积极治疗后好转。
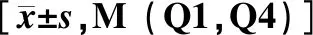
表2 移植前慢性肾脏病并发症控制情况
VMI:左心室治疗指数;Hb:血红蛋白;iPTH:全段甲状旁腺激素;*:80%为统计的严重左心室肥厚比例

表3 移植术后感染情况
有合并感染,故感染例数次>实际人数
原发病复发情况 随访过程中,有1例(0.8%)原发病复发,原发病为局灶节段性肾小球硬化(FSGS)。 该患儿移植后2周出现大量蛋白尿(尿蛋白定量7.35 g/24h),血清肌酐(SCr)为191 μmol/L,经肾活检病理提示微小病变,FSGS不能除外,结合临床,考虑FSGS复发,给予3次血浆置换+甲泼尼龙冲击+4剂利妥昔单抗等治疗,尿蛋白定量降至3.72 g/24h,SCr维持在48~57 μmol/L,目前随访2年,末次随访eGFR 106 ml/(min·1.73m2)。

表4 7例移植术后血栓栓塞导致移植肾丢失的供受者信息
N/A:不详
预后
移植肾存活情况 移植肾1年、3年、5年、7年存活率均为87% (图2)。末次随访时113例肾移植患儿肾功能维持稳定,估算肾小球滤过率81.2±29.8 ml/(min·1.73 m2);另16例移植肾丢失,其中13例(81%)移植肾丢失发生在移植后1月内。导致移植肾丢失的病因包括:移植肾原发性无功能(3例),血栓形成(7例),排斥反应(2例),死亡(4例)。7例血栓栓塞导致移植肾丢失的供受者信息见表4,分析发现导致移植肾失功的供体中有3例为双肾整块移植。截止末次随访,移植失败的患儿中,8例接受二次肾移植,移植肾功能良好;4例回归透析治疗;另4例死亡。
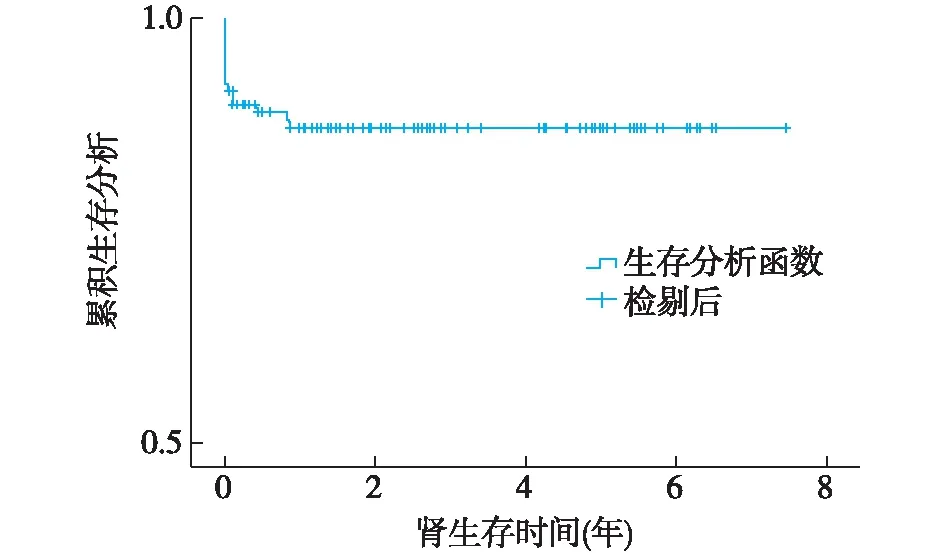
图2 Kaplan-Meier法移植肾生存分析
受者存活情况 肾移植受者1年、3年、5年、7年存活率均为96.6%(图3)。4例死亡的患儿中,因重症感染死亡3例 (2例耐药菌败血症、1例真菌性肺部感染合并CMV感染),脑血管意外死亡1例。
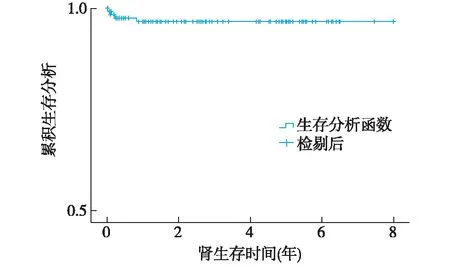
图3 Kaplan-Meier法受者生存分析
讨 论
儿童ESRD的治疗方式包括血液透析、腹膜透析和肾移植,其中肾移植作为其最佳治疗方式,受到越来越多的青睐。中国肾移植科学登记系统数据显示,1983~2012年间我国儿童肾移植受者中10岁以下患儿极少,比例不足7%[5]。本组资料显示,2011~2019年本中心儿童肾移植受者<10岁比例达57%,与既往资料相比呈现明显低龄化趋势。然而,尿毒症患儿尤其是低龄、低体重儿童有其自身特点,相应在肾移植术前评估、术中处理和术后管理等环节均有别于成人,因此有必要儿童肾脏科医师介入,与成人移植科医师密切配合,术前-术中-术后闭环管理儿童肾移植,以提高儿童肾移植预后。国外资料显示[6-9],儿童肾移植受者术后1年、5年、10年生存率分别为96%~98%、93%、88%,移植肾1年、5年、10年存活率为88%~92%、71%~85%、58%~63%。本组研究结果显示,受者1年、3年、5年、7年存活率均为96.6%,移植肾1年、3年、5年、7年存活率均为87%,与国外报道相比,总体效果相似,5年、7年人/肾存活率略优于上述报道。
本组资料显示,ESRD患儿以CAKUT和遗传性肾病为主,各占28.6%和27.9%。原发病复发是引起移植肾丢失的常见原因之一[10-11]。目前认为CAKUT和遗传性肾病因原发病复发风险较小,对肾移植预后影响较小;而FSGS、膜性肾病、IgA肾病等因存在不同程度原发病复发风险,影响移植物的长期存活[12-13]。有资料显示移植后肾小球肾炎复发的比例为3.4%~18%,且随移植时间增长[14-15]。本组资料有1例(0.8%)患儿原发病复发,复发率远低于报道水平,可能与本组患者中原发性FSGS等易复发性肾小球肾炎例数少及随访时间有限有关。对于原发病为高复发风险的肾小球肾炎肾移植患儿,在随访过程中若出现蛋白尿、血尿或难以解释的SCr升高等,需警惕原发病复发,避免因肾小球肾炎复发而引起移植物失功。
尽管肾移植是ESRD患儿肾替代治疗的最佳选择,然而由于合适供体紧缺等因素影响,依然有75%的患者在等待肾移植期间需要透析治疗过渡[6]。本组资料中绝大多数(96%)患儿移植前经过慢性透析的过渡。慢性透析患者普遍存在如钙磷代谢紊乱、甲状旁腺功能亢进、贫血、左心室肥厚、营养不良、容量负荷等影响透析患者生存率的因素[16-22]。本中心在慢性透析患者管理过程中,对影响临床转归的CKD并发症进行有效纠正,避免了等待移植过程中不良结局的发生。肾移植前对ESRD患儿进行细致的管理,积极纠正并发症,有助于改善透析结局,为患儿进行肾移植保驾护航。
感染已超过排斥反应成为移植后最常见的并发症之一,也是造成移植肾失功的重要因素[23-24]。移植前免疫状态评估、感染风险评估和预防接种可显著减少术后重症感染的发生。本组资料显示,肾移植术后感染的发生率为48%,移植术后除3例重症感染死亡外,其余病例经积极有效治疗治愈,受者存活。提示,移植后感染是儿童肾移植术后最常见且严重的并发症,需要肾脏科医师密切监测,给予有效治疗。
小结:完善的移植前准备(明确原发病、等待移植过程中给予充分有效的透析、积极纠正CKD并发症、移植前疫苗接种完善)和细致的移植后管理(免疫及感染状态检测、及时调整免疫抑制剂及控制感染)有助于提高儿童肾移植的预后。儿童肾脏科-成人移植科协同管理模式下的儿童肾移植术后移植效果满意,预后良好,是一种很好的模式,对改善儿童肾移植的预后意义重大,值得推广。
