耐力训练对兔心房肌细胞IKAch和心房颤动的影响
2020-03-21袁斗路敏谭琛姚建民李丹黄思慧武忠
袁斗,路敏,谭琛,姚建民,李丹,黄思慧,武忠
有计划的有氧耐力运动训练诱导心脏发生的生理性的适应性改变,如生理性肥厚和重构,称为运动员心脏。大多数运动爱好者或运动员均超出5~10倍或以上的推荐运动量或运动强度,部分达到了高等运动强度[1]。有规律的运动可以引起心脏机能产生良好适应性变化,并降低心血管疾病的危险性[2],而高强度运动则常伴有各样的心血管疾病[2-4],其对心脏的结构、电生理机能等可造成严重损害[5],甚至运动者出现心源性猝死;近年来多项研究[6-8]中均证实接受长时间,高强度的耐力训练者的房颤发生率明显增高。而治疗方法的选择依赖于机制的确定,为此本研究通过我们前期研究的兔运动性房颤模型[9]来力求发现了一种潜在的过度运动促进房颤发生的病理生理机制。
1 材料与方法
1.1 动物运动模型的制备实验动物选择33只成年健康新西兰大耳白兔,体重3.0~4.0 kg,雌雄不拘,由北京海淀兴旺实验动物养殖场提供。实验兔在本实验室经适应性喂养7 d后,将其随机分为3组,每组11只,包括对照组、中强度耐力运动训练组(Groups M)、高强度耐力运动训练组(Groups H)。其中对照组不做任何处理,笼内生活,自由饮食。耐力运动训练组,采用兔实验跑台(由北京智鼠多宝生物科技有限公司研制),练持续16周(第1周为适应性训练),每周5 d,每天1 h或一次性力竭(不足1 h)。Groups M:坡度0度,速度15 m/min,Groups H:坡度0度,速度30 m/min。在训练过程中为了保证训练质量,我们轻拍其背部,让其继续跑动[9]。
1.2 固有心率(IHR)的检测适应性喂养后,第一次检测各组兔IHR,以后每隔8周检测一次,共3次。实验兔用0.5%戊巴比妥经耳缘静脉麻醉后,用普罗奈尔0.5 mg/kg 耳缘静脉注射,10 min后给予阿托品 0.25 mg/kg耳缘静脉注射,观察用药后10 min内的最慢心率即为IHR。
1.3 兔电生理实验模型准备训练目标完成后,各组实验兔随机各取6只,用3%戊巴比妥经耳缘静脉麻醉后,开胸取出心脏,在温度37℃、速度20 ml/min下行Langendorff经主动脉逆向灌流,灌流液为改良的Krebs-Henseleit(K-H)缓冲液(NaCl:118,KCl:2.8, KH2PO4:1.2;CaCL2:2.5;MgSO4:0.5;丙酮酸:2.0;NaHCO3:25;葡萄糖:5.5;Na2EDTA:0.57,mmol/L)。从右心耳部置入双极特氟龙涂层的起搏电极,在基础频率3.3 Hz,电刺激脉冲的脉宽是3 ms,刺激电压幅度是起搏阈值的3倍,应用心脏程序刺激法(S1S2)起搏(Astro-Med公司Grass-S88X型刺激仪,美国)。12导联心电图采用具备Wilson终端的模拟的非接触式12导联心电图记录系统(Harvard Apparatus公司,美国)采集心电信号,所有心电信号经Biopac心电放大系统处理后存储于计算机(实验完成后分别剪取各组实验兔左心房组织标记并存于液氮罐中备用)。
1.3.1 APD90的记录及AERP的测定在左心耳远端置入单极特氟龙涂层的记录电极,待心脏稳定后,记录从左房单相APD90;测定AERP:采用S1S2刺激反向扫描法,S1S2呈8:1,步长为3 ms,基础起搏周长303 ms,S1S2偶联间期从120 ms开始以2 ms步长递减。AERP定义为S2不能引起心房激动的最长S1S2周期[10]。
1.3.2 诱发房颤测定AERP结束后,从不应期开始逐渐增加S1S2的刺激周长(增加步长2 ms)直到连续增加刺激周长不能诱发房颤为止。
1.3.3 给药方法生理盐水配置分别乙酰胆碱(Ach)、阿托品溶液,用微量注射泵经灌流系统分别向冠脉内注入乙酰胆碱(1 μm/L Ach)+不同浓度阿托品溶液(0、0.0001、0.0005、0.001、0.002 mg/ml),给药15~20 min后,药物达到终浓度,开始记录并测定电生理指标。
1.4 心房肌细胞急性分离及全细胞膜片钳取训练目标完成后各组剩余实验兔5只,共15只,用3%戊巴比妥经耳缘静脉麻醉后,开胸取出心脏,放入用氧饱和的无钙台式液(mmol/L:MgCL21.0、NaCL 137、NaH2PO40.33、HEPES 10、KCL 5.4、Glucose 10,PH用NaOH调至7.4在25℃)中冲洗,冲洗完毕后,心脏悬挂并用丝线固定在Langendorff滴灌头上,在温度37℃、速度10~12ml/min下行经主动脉逆向Langendorff灌流,先用钙台式液(在无钙台式液中加入CaCL2,使Ca浓度为1.8 mmol/L)灌流2~3 min使心脏复跳泵出心腔内残血,再用无钙台式液灌流3~5 min排出冠脉内血液并使心脏停跳,最后改用酶解液(于50 ml无钙台式液中加入Collagenase Ⅱ 20 mg和Trypsin 2 mg)循环灌流20~25 min(如图1)。待心房半透明时且呈现疏松、膨胀状态,剪下左心房分别置于KB液中并迅速剪成1 mm3的小组织块,吸管间断轻轻吹打,使细胞松散脱离组织块,在低倍显微镜下吹打至单个细胞充满视野。用150目的尼龙纱网过滤细胞悬液。分离出的单个心房肌细胞在KB液(mmol/L:KCL 39.97、KOH 80、HEPES 10.7、KH2PO425、MgSO47H2O 3、Glucose 10.09、EGTA 0.53、Taurine 19.98、L-glutamic acid 50.3,PH用KOH调至7.4在25度,或7.3在35度)中保存,室温下稳定1 h后备用(灌流液和KB液均通100% O2饱和20 min以上,灌流时仍然保持通氧状态)。分离后细胞存活率85%以上,细胞外形完整,折光性良好,横纹清晰(图2)。
实验前,吸取混匀后的细胞悬液0.5 ml滴入灌流槽中,静置10 min,待细胞自然贴壁后,再以100%O2饱和的细胞外液(mmol/L:CaCL20.65、MgCL25.0、HEPES 5.0、N-methyl-D-glucamine 149.0,PH值用HCL调至7.4)灌流5~10 min,冲洗细胞,至清晰视野后,于灌流槽中分别加入Dof 5 nm/L阻断IKr,CdCl2100 μm/L阻断ICa,L,TTX 100 μm/L阻断INa,4-AP 50 μm/L阻断Ito,Glibenclamide 10 μmol/L阻断IK-ATP)。采用全细胞膜片钳记录法[11],在电压钳制模式下记录IKAch电流,电极充满细胞内液(mmol/L:KCL 45.0、K-aspartate 85.0、Na-pytuvate 5.0、MgATP 5.0、HEPES 10.0、EGTA 10.0、Glucose 11.0,PH值用KOH调至7.4)的入液电阻为2~3 MΩ。调节电位补偿、三维操纵器使电极尖端与细胞表面形成稳定接封,给予电极内负压吸引,形成高阻封接(电阻达l GO以上)。稳定5 min后启动应用软件pClampex 10.0中的刺激程序(IK-Ach的I-V曲线的刺激方案为Vh-40 mV,Vt从-100 mV开始,以10 mV阶跃刺激至+60 mV,钳制时间300 ms,采样频率0.2 kHz),观察并记录细胞膜离子通道电流,用电流密度(pA/pF)表示离子通道电流大小(室温22~24 ℃下进行实验)。
图1 Langendorff灌流分离兔心房肌细胞
1.5 RT-PCR检测kir3.1、kir3.4 mRNA表达于液氮灌中取出各组兔左心房组织100 mg,用Trizol法提取各组左心房组织mRNA溶液,经浓度和纯度检测后,行逆转录反应(模板RNA 4 μg、50 μM反转录引物T18 4.0 μl、DEPC处理H2O至24 μl→ 混匀、70 ℃ 5 min,立即冰浴→5×buffer 8.0 μl、10 mM dNTP 2.0 μl、RNase Inhibito 1 μl、M-MuLV 2.0 μl、补足DEPC水至40 μl→42 ℃ 60 min,70 ℃ 15 min→在冰上冷却5 min备用 )获取mRNA的cDNA,以PT-PCR法将cDNA进行扩增(2×Ex TaqMix 12.5 μl、10 μM引物F/R混合物0.5 μl、Eva green 1.25 μl、l对应的模板cDNA各1 μl,其中一管不加模板用GAPDH作阴性对照,补加ddH2O至25 μl。混匀后置于PCR仪中扩增:95 ℃ 5 min预变性,95 ℃ 30 s→66 ℃ 20 s(荧光检测),40 cycles,4 ℃ pause)。采用2-△△CT法计算kir3.1、kir3.4基因的相对表达量。引物:北京中美泰和生物科技有限公司合成,引物信息(表1)。

图2 单个兔心房肌细胞

表1 引物信息
1.6 统计学方法采用SPSS 19.0统计软件进行分析。计量资料以均数±标准差(±s)表示,采用one-way 或two-way多组间比较;计数资料采用例数(百分比)表示,采用卡方检验进行组间比较。以P<0.05为差异具有统计学意义。采用Graph Pad Prism5.0绘图。
2 结果
2.1 不同训练强度对兔心脏IHR的影响训练前Group C、M、 H各组之间相互比较均无统计差异(P=0.931、P=0.948和P=0.983);8周时:与训练前比较,高强度训练组IHR低于训练前,差异有统计学意义(P<0.05);组间比较:Group Mvs. Group C and H均无统计学差异(P=0.139和P=0.099),高强度训练组兔心脏IHR低于对照组(Group H<Group C=差异有统计学意义(P=0.004);16周时:与训练前比较,训练组IHR均低于训练前,差异有统计学意义(P<0.05);随着运动强度增加,兔心脏IHR降低,Group C>Group M>Group H差异有统计学差异(P<0.05)(图3)。
2.2 不同训练强度对兔心房肌细胞APD90、ERP及AF发生率的影响不同组间,Ach背景相同,相同剂量阿托品(0~0.002 mg/ml)作用下高强度耐力运动训练组APD90、AERP小于其他两组,AF发生率高于其他两组,差异有统计学意义(Group Hvs. Group C and M,P<0.001),而Group Cvs. Group M之间无统计学差异(P=0.488);组内比较,随着阿托品剂量增加(0~0.002 mg/ml)APD90、AERP相应延长(P<0.05),AF发生率降低有统计学差异(P<0.05)(图4)。
2.3 不同强度耐力运动训练对兔心房肌细胞IKAch的作用Group H:IKAch电流密度在左房肌细胞较Group C、M显著的增大[-100 mV:(14.18±1.74)vs.(9.92±1.20)和(11.07±1.95)pA/pF;+50 mV:(10.75±1.68)vs.(5.57±0.59)和(8.25±0.85)pA/pF;P<0.003),Group M在+50 mV时电流密度增大(vs. Group C,P=0.001),在-100 mV时电流密度无显著变化(vs. Group C,P=0.249)(图5~6)。
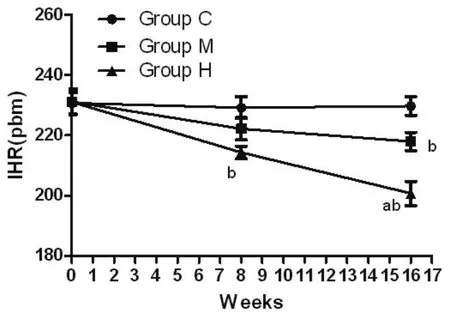
图3 不同强度的耐力运动训练下兔IHR的变化
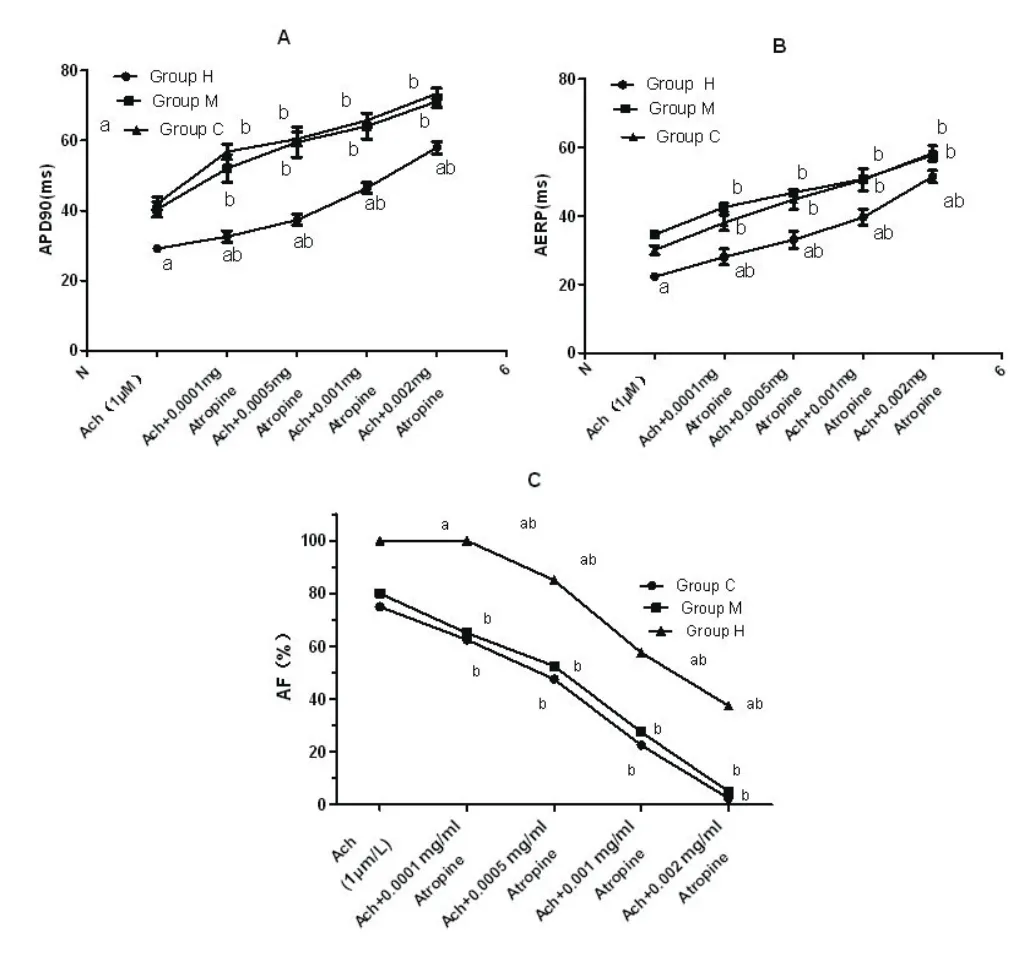
图4 Ach及Ach+不同浓度阿托品对不同强度的耐力运动训练下兔左心房APD90(A)、AERP(B)和AF发生率(C)的影响
2.4 不同强度耐力运动训练对兔心房肌细胞IKAch电流-电压曲线的影响IKAch电流内向成分随刺激脉冲的正向移动而减小,在-50 mV时反转为外向电流,在电位反转前,Group H电流密度明显增大,随着电压更负的方向移动,增大越明显,而Group M则无此现象。随着运动强度的增加反转电位以上不同钳制电压下均使IKAch电流增加,表现为电流-电压关系上移,但耐力运动训练对反转电位和整流特性没有明显影响(图7)。
2.5 不同强度耐力运动训练组兔左心房组织Kir3.1和Kir3.4 mRNA表达变化左心房组织Kir3.1和Kir3.4的 mRNA表达量均随着运动强度增加而增加(Group Hvs. Group C、M,Group Mvs. Group C,P<0.05)(表2)。

图5 兔心房组织IKAch电流密度
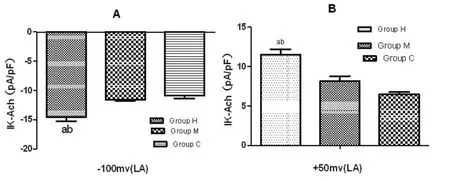
图6 不同强度的运动训练对兔左心房组织IKAch电流密度的影响:钳制电压为-100 mv(A),钳制电压为+50 mv(B)
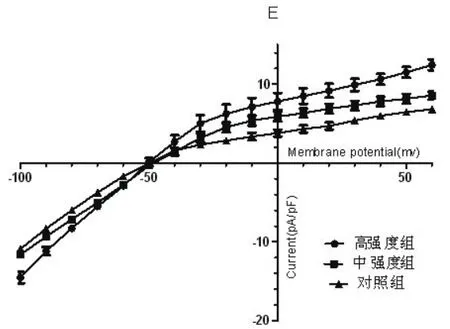
图7 不同强度的运动训练对兔左心房组织IKAch电流-电压曲线的影响
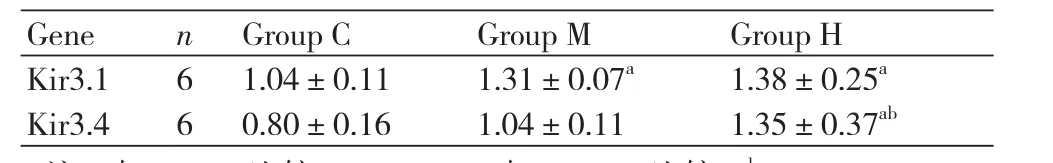
表2 不同强度的运动训练对兔心房组织Kir3.1和Kir3.4 mRNA表达量(2-△△CT)
3 讨论
有计划的有氧耐力运动训练诱导心脏发生的生理性的适应性改变,如生理性肥厚和重构,称为运动员心脏。我们的运动兔有着和人运动心脏一样的表现:心率减慢、心肌肥厚、心房增大[9]等,过度的运动且长时间刺激进一步使紊乱的生理平衡加剧,导致一系列心血管调控功能失常改变,如窦房结功能、心房电生理特性[12],目前高强度运动训练对促进房颤的机制知之甚少,本研究我们注意到了3种可能性:心房扩张[9],窦房结功能改变,迷走神经张力增强。心房扩张是运动员心脏的一个典型特征[13],心房扩张是房颤促进的决定因素[14-17]。
目前公认长期运动后心率变缓副交感神经紧张性增加,交感神经兴奋性降低导致的[18-20];交感神经主要作用于心脏的窦房结和房室结的传导性及自律性[21];多数研究表明[22,23]心脏自主神经系统可导致触发活动或折返,从而诱发房颤,由于IHR是全部阻断自主神经系统对心脏的支配后,窦房结自身频率的反映,是监测窦房结自律性功能的一项指标。有研究表明[24]反复力竭运动可引起窦房结细胞自律活动减慢,这与我们研究运动训练后IHR明显较运动前慢,且高强度组减慢幅度明显大于其他组相一致。由此我们认为长期的运动训使窦房结自律性发生改变[25],使窦房结自律性降低,使其对异位兴奋的抑制作用减弱,从而房颤易于发生。可能由于反复高强度运动可引起窦房结细胞缺血缺氧及离子通道功能活动的改变,从而窦房结节律被打乱,引起房颤[24]。
KAch是由Kir3.1和Kir3.4所编码的钾离子通道,主要存在于哺乳动物心房组织中,能被迷走神经兴奋所释放的Ach激活,是受G蛋白调节的,是心房相对特异性的钾离子通道,是调节心房肌膜电位和动作电位复极为主要功能,降低心肌收缩力、兴奋性和自律性[26-28]。
房颤的发生与IKAch的关系,说法不一。诸多学者研究[29,30]发现房颤患者心房肌细胞中IKAch显著增高,认为IKAch与房颤的发生有着密切关系;但亦有许多研究者[31,32]研究持反向观点。本研究在灌流液中加入IKAch激活剂Ach记录结果显示高强度组实验兔房颤的可诱导性显著高于其他两组;同时在Ach背景下加入不同浓度IKAch抑制剂阿托品记录表明同组实验兔随着阿托品剂量增加房颤的可诱导性降低,但在相同阿托品剂量下,高强度组实验兔房颤的可诱导性高于其他两组,APD、AERP随着运动强度的增加而缩短,随着阿托品剂量的增加而相应延长;Ach激活IKAch能导致房颤的发生,阻断IKAch能减少房颤的发生,此结果与Kovoor等[33]研究结果相一致。因此我们可认为高强度的耐力运动训练使兔心脏心肌细胞膜KAch数量增加或功能增强。为此我们进一步研究表明随着运动强度的增加实验兔心房肌细胞膜Kir3.1和Kir3.4的mRNA表达增加且单个心房肌细胞IKAch电流密度也相应提高,高强度的耐力运动训练使兔心脏心房肌细胞膜上KAch数量增加和KAch功能增强;而房颤发生机制[34-38]之一:心脏迷走神经张力增加,释放的神经递质Ach与心房肌细胞膜上M2受体结合,在GTP结合蛋白作用下激活的KAch通道;增加细胞内K+外流,加快细胞复极,致使APD、AERP缩短,多波折返的发生,并且心房传导减慢和心房扩大使AERP离散度的增加,从而使心房的异位激动增加,进而心房内差异性传导突出,形成心房内的折返或微折返,最终诱发房颤。
我们认为实验兔在长期的高强度耐力运动训练后,心房扩大,心迷走神经分布增多且不均,而心房肌细胞膜长期的接受大量乙酰胆碱刺激,以致Kir3.1和Kir3.4的mRNA表达水平增加、与其所编码的KAch通道数量增加、功能增强,为房颤的诱发及维持提供结构及物质基础。又由于心房扩大、心房内迷走神经末梢分布不均一,IKAch激活亦不均一,缩短APD和AERP,心房折返波长缩短,最终导致的房颤发生。
