利拉鲁肽对结肠癌细胞增殖、凋亡及转录活化因子6 通路的影响
2020-03-21智会张志永
智会,张志永
结肠癌是临床较为常见的恶性肿瘤之一,是世界范围排名第3的恶性肿瘤。对结肠癌的早期治疗手段主要以切除和放化疗为主,但癌细胞的转移和化疗药物产生的抗性是结肠癌治疗过程中亟待解决的问题。近年来发现糖尿病合并肿瘤病人增多,胃肠道癌症与肥胖伴糖尿病病人发病风险相关,这可能与胰岛素生长因子受体1(insulin growth factor receptor 1,IGFR-1)、胰高血糖素样肽-1(glucagon like peptide 1,GLP-1)通路相关[1-2]。部分研究报道,胰岛素通过IGFR-1 促进细胞增殖,增加肿瘤的发生风险[3]。近年来肠促胰素效应的降糖药GLP-1 类似物——利拉鲁肽在临床上应用广泛。研究报道GLP-1 类似物促进前列腺癌细胞、乳腺癌细胞的凋亡,抑制其增殖[4-5]。但GLP-1 类似物对人结肠癌细胞的作用鲜有报道。研究发现转录活化因子6(transcription activator 6,ATF6)是内质网应激(endoplasmic reticulum stress,ERS)的主要靶点,活化的ATF6可促进ERS相关因子的表达促进细胞凋亡[6]。故本实验于2016 年5 月至2018 年5 月探讨利拉鲁肽作用人结肠癌HCT116 细胞后对其增殖、凋亡及ATF6 通路的影响,以期为癌症的治疗提供理论依据。
1 材料与方法
1.1 材料 人结肠癌细胞HCT116中国医学科学院提供,利拉鲁肽原药粉剂(批号20171106)购于上海华谊药厂有限公司,RPMI1640 培养基(批号20181206)、胎牛血清(批号20181109)、0.25%胰蛋白酶(批号20181209)购于美国HyClone公司,DMSO(批号20181207)购于美国Amresco 公司,MTT 试剂盒(批号20181011)购于上海碧云天生物技术有限公司,细胞凋亡试剂盒(批号20180916)购于BD 试剂公司,Trizol 试剂盒(批号20180508)购于invitrogen公司,冻存管(货号NB-362J)、96孔板(货号HD-9J45)、细胞计数板(货号KDN73)购于Fisher Lab-Serv 公司,PVDF 微孔滤膜(货号N-67DNA)购于美国Bio-Rad 公司,BCA 蛋白试剂盒(批号20180916)购于上海碧云天生物技术有限公司,β-肌动蛋白抗体(批号20181109)、ATF6抗体(20181107)、CCAAT-增强子结合蛋白(C/EBP)同源蛋白(CHOP)抗体(批号20181206)、casepase-3 抗体(20181207)、21KD 蛋白(Bax)抗体(20181209)购于美国Proteintech公司,二抗辣根过氧化物酶(HRP)标记的羊抗鼠IgG(批号20181102)购于美国Pierce公司,ECL化学发光试剂盒(批号20171209)购于Amersham Pharmacia Biotech。高压灭菌锅(型号YX280A)购于日本SAKURA公司,多功能酶标仪(型号M-10082)购于美国Bio-Rad公司,FACS流式细胞仪(型号EPICS XL)购于美国BD公司,二氧化碳恒温培养箱(型号ND-28NJ)购于美国Thermo Fisher Scientific 公司,凝胶成像系统(型号GenoSen2000)购于美国UVP公司,离心机(型号BU-289)、微量加样器(型号PG-2415)、荧光定量仪(型号NG-J28)购于德国Eppendorf公司。
1.2 方法
1.2.1 细胞培养与处理 细胞培养:人结肠癌细胞HCT116,10%胎牛血清,置于37 ℃、5%二氧化碳的培养箱中培养,2~3 d 换液1 次,当细胞融合度达到80%左右时,弃掉培养基,适量磷酸缓冲盐溶液(PBS)清洗,使用1 mL 0.25%的胰蛋白酶进行消化,1 000 r/min 离心收集细胞,调整细胞浓度为1×106/mL,接种到96孔板中培养。
实验分组及处理:细胞悬液于96 孔板中培养,实验组按照利拉鲁肽浓度0、10、100、1 000 nM加入96孔板中培养24、48、72 h,每组设置3个复孔。
药物溶解:称取3.7 g利拉鲁肽粉剂溶解于1 mL多肽稀释液中,配置成终浓度为1 mM的储存液,分装后-20 ℃保存备用[7]。
1.2.2 人胆囊收缩素/缩胆囊素八肽(CCK-8)检测细胞增殖 HCT116细胞悬液以2×105/mL 接种于96孔板中,每孔100 μL,孔周边用灭菌双蒸水(dd H2O)填充,37 ℃、5%二氧化碳孵育箱中培养,24 h后观察细胞进入对数生长期,弃掉培养基,分别以0、10、100、1 000 nM利拉鲁肽作用细胞24、48、72 h,每个组做3个复孔;弃培养基,每孔加入10 μL CCK-8试剂及100 μL培养基,37 ℃、5%二氧化碳培养箱中培养2 h,弃掉孔内液体,全自动酶标仪检测450 nm波长处各孔吸光度(OD)值,取均值,以空白对照孔调零,计算利拉鲁肽对细胞的抑制率。
1.2.3 流式细胞仪检测细胞周期 将对数生长期细胞制备成单细胞悬液,以2×105/mL 接种于12 孔板,每孔1 mL,培养24 h 贴壁后,分别以0、10、100、1 000 nM利拉鲁肽作用细胞,每24小时换新鲜加药培养液,药物作用72 h 后,弃掉培养基,PBS 洗涤2次,1 000 r/min 离心5 min,300 μL PBS 重悬细胞沉淀,然后加入700 μL无水乙醇,4 ℃避光过夜。细胞固定后预冷PBS 洗2 次,1 000 r/min 离心5 min,500 μL PBS 重悬细胞沉淀,用冷PBS 洗2 次,离心,500 μL PBS 重悬细胞沉淀,加入核酸酶(RNAase)2.5 μL,2 μL 0.2%聚乙二醇辛基苯基醚(TritonX-100)室温30 min,冰上孵育15 min,加入100 μg/mL 的碘化丙啶(PI)500 μL,4 ℃避光染色30 min,流式细胞仪测细胞周期。
1.2.4 细胞凋亡检测 采用流式细胞仪检测处理72 h 的细胞凋亡情况。0.25%胰蛋白酶进行消化,室温1 000 r/min离心5 min收集各组细胞;设置浓度为0、10、100、1 000 nM利拉鲁肽,每个浓度设置3个重复,培养72 h 后收集细胞,PBS 洗涤细胞两次,调整细胞为2×105/mL;吸取1 mL 细胞悬液于离心管中,1 000 r/min离心5 min,弃上清,PBS洗涤2次,沉淀中加入200 μL 膜联蛋白V 结合缓冲液(Binding Buffering)悬浮细胞,上机前加入5 μL PI 和5 μL 膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC),室温避光反应5~15 min,再加400 μL 缓冲液,1 h 内使用流式细胞仪检测细胞凋亡情况。
1.2.5 蛋白质印迹法(Western Blot)检测蛋白表达采用蛋白质印迹法检测各细胞中Bax、半胱胺酸蛋白酶-3(Caspase-3)、ATF6 p50、CHOP蛋白含量的表达,取0、10、100、1 000 nM利拉鲁肽作用72 h后细胞,RIPA裂解液裂解细胞,提取细胞中总蛋白,BCA法测定蛋白浓度,记录562 nm处OD值,计算样品浓度,SDS变性蛋白;取等量蛋白样品(每孔50 μg),SDS-PAGE电泳凝胶,跑胶完成后湿转至聚偏二氟乙烯膜(PVDF膜)上,5%脱脂奶封闭1 h,稀释一抗4 ℃孵育过夜,洗膜3次/5 min,二抗孵育1 h,洗膜3次/5 min,ECL显影液显影,以β-肌动蛋白(β-actin)为内参。
1.3 统计学方法 数据采用SPSS 19.0统计软件进行分析。多组间比较采用单因素方差分析+LSD-t检验。均以P<0.05表示差异有统计学意义。
2 结果
2.1 不同浓度利拉鲁肽对结肠癌细胞增殖的影响 将对数期生长的HCT116 细胞分别加入0、10、100、1 000 nM浓度的利拉鲁肽,在加药后24、48、72 h 进行CCK-8 检测,结果显示:与对照组相比,利拉鲁肽各浓度间增殖率均有显著变化(P<0.05)。比较同一时间点,随着药物浓度的增加0、10、100、1 000 nM 各组细胞的增殖率分别为(97.16±35.67)%、(81.69 ± 33.37)%、(76.12 ± 30.23)%、(70.65 ± 28.89)% ;(86.17 ± 33.98)%、(58.68 ±26.77)%、(39.74±10.67)%、(30.17±9.24)%;(83.82±31.19)%、(38.77±10.19)%、(22.98±6.78)%、(16.63±6.12)%,均呈下降趋势,提示利拉鲁肽对HCT116细胞的抑制作用增强呈明显的剂量依赖作用。比较同一浓度,随着时间推移,24,48,72 h各时间点细胞增殖率分别为(97.16±35.67)%、(86.17±33.98)%、(83.82±31.19)%;(81.69±33.37)%、(58.68±26.77)%、(38.77±10.19)%;(76.12±30.23)%、(39.74±10.67)%、(22.98±6.78)%;(70.65±28.89)%、(30.17±9.24)%、(16.63±6.12)%,利拉鲁肽作用于HCT116 细胞均有抑制作用,且随着时间的延长抑制作用显著增强(P<0.05),提示利拉鲁肽对HCT116 细胞的抑制作用存在时间依懒性。见图1。
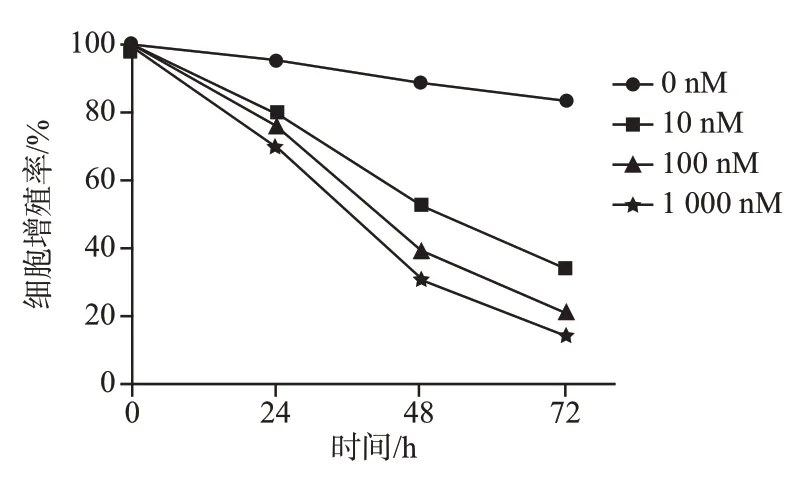
图1 不同浓度利拉鲁肽对结肠癌细胞增殖情况检测
2.2 不同浓度利拉鲁肽对结肠癌细胞周期分布的影响 不同浓度利拉鲁肽作用于HCT116 细胞72 h后,采用流式细胞术检测细胞周期,检测结果显示:10、100、1 000 nM浓度的利拉鲁肽组的G2/M期细胞比例较0 nM 组显著减少(P<0.05),且随着浓度的增加呈现下降趋势。见图2。
2.3 不同浓度利拉鲁肽对结肠癌细胞凋亡的影响 不同浓度利拉鲁肽作用于结肠癌细胞HCT116 72 h 后,采用流式细胞术检测细胞凋亡,结果显示:0、10、100、1 000 nM 利拉鲁肽作用下细胞凋亡率分别 为(9.06 ± 0.98)%、(10.45 ± 1.12)%、(13.89 ±1.54)%、(56.08±14.33)%,依次升高(P<0.05)。与0 nM 组比较,10、100、1 000 nM 浓度的利拉鲁肽组细胞的凋亡率依次显著升高(P<0.05);与10 nM组比较,100、1 000 nM 组凋亡率依次o 显著升高(P<0.05);与100 nM 组比较,1 000 nM 组凋亡率显著升高(P<0.05),表明利拉鲁肽浓度越高对HCT116 细胞的促凋亡作用越明显。见图3。
2.4 利拉鲁肽对凋亡因子Bax、Caspase-3 的影响对培养72 h 的HCT116 细胞进行蛋白质印迹法检测,结果显示,10、100、1 000 nM 浓度利拉鲁肽作用于细胞后,细胞中Bax 蛋白表达量分别为(0.69±0.13)、(0.93±0.24)、(1.19±0.25),显著升高(P<0.05),1 000 nM 组Bax 蛋白表达量显著高于10 nM组(P<0.05),100、1 000 nM两组间差异无统计学意义(P>0.05);Caspase-3 蛋白表达量分别为(0.26±0.06)、(0.76±0.15)、(1.15±0.16)依次显著升高(P<0.05),100、1 000 nM 组Caspase-3 蛋白表达量显著高于10 nM组(P<0.05),1 000 nM组Caspase-3蛋白表达量显著高于100 nM 组(P<0.05)。表明在1 000 nM范围内随着浓度的增加细胞凋亡蛋白表达逐渐上升。见图4。
2.5 利拉鲁肽对ATF6 p50、CHOP的影响 对各浓度培养72 h的HCT116细胞进行蛋白质印迹法检测,结果显示,10、100、1 000 nM 浓度利拉鲁肽作用于细胞后,细胞中ATF6 p50 蛋白表达量分别为(0.69±0.11)、(0.96±0.09)、(1.20±0.08);CHOP 蛋白表达量分别为(0.27±0.06)、(0.79±0.08)、(0.99±0.09),均显著升高(P<0.05)。100、1 000 nM 组ATF6 p50、CHOP蛋白表达量显著高于10 nM组(P<0.05),1 000 nM 组ATF6 p50、CHOP 蛋白表达量显著高于100 nM组(P<0.05)。见图5。
3 讨论
糖尿病作为慢性代谢障碍性疾病,可引起组织器官的异常,多项研究表明,2型糖尿病病人恶性肿瘤的发病率是正常人的2 倍,特别在胰腺癌、乳腺癌、结肠癌中[7]。这可能与2 型糖尿病治疗药物及类似物影响肿瘤的增长相关[8]。GLP-1是一种由肠道L 细胞分泌的肠促胰素,其受体在胃、肠、胰腺等多种组织中分布[9]。利拉鲁肽是一种新的GLP-1受体激动剂,GLP-1 主要通过胃、肠、胰腺及中枢神经系统的GLP-1受体介导[10]。以往对GLP-1的研究主要在糖尿病领域,近年来发现利拉鲁肽可通过抑制p38丝裂原活化蛋白激酶(p38MAPK)信号通路抑制乳腺癌细胞的增长[11]。癌细胞无限增殖、凋亡减少是治疗的主要挑战,因此抑制癌细胞增殖,诱导其凋亡成为治疗癌症的新的切入点。结肠癌在我国的发病率逐渐升高,本研究通过对利拉鲁肽作用后人结肠癌HCT116 细胞增殖、凋亡的观察分析利拉鲁肽对结肠癌细胞的作用。
研究报道,小鼠结肠癌CT26细胞表面存在GLP-1受体,GLP-1 受体激动剂通过激活GLP-1 受体减少糖原合成酶激酶3 的表达,抑制细胞的增殖[12]。细胞实验证明GLP-1 受体激动剂可减少CT26 细胞集落的形成,提示GLP-1 受体激动剂抑制细胞的增殖[13]。本研究CCK-8 结果显示,利拉鲁肽作用后HCT116 细胞的增殖受到抑制,且呈时间剂量的依懒性,表明利拉鲁肽对人结肠癌细胞的增殖有抑制作用,可有效控制癌细胞的无限增殖。以上实验结果与体外实验报道的GLP-1 受体激动剂-艾塞那肽改变小鼠结肠癌CT26细胞的形态,抑制细胞增殖结果一致[14]。越来越多研究表明,调控细胞周期可影响细胞体外增殖活性[15]。细胞周期检测结果显示利拉鲁肽作用后细胞G2/M 期细胞比例减少,且随着浓度的增加比例逐渐减少,提示利拉鲁肽阻滞结肠癌细胞HCT116细胞停滞在G2/M期,细胞增殖周期异常,阻滞细胞无限增殖。
肿瘤细胞中ERS 可因不同的环境改变而发生,ERS 可促进癌细胞适应应激环境,抵抗某些化疗药物,但ERS 时间过长则会启动凋亡通路,因此通过ERS促进细胞的凋亡是治疗肿瘤的新靶点[16]。ATF6是ERS的重要靶点,其是内质网上的Ⅱ型跨膜蛋白,C 端位于内质网腔中,可感受ERS[17]。ERS 发生时ATF6 被运送到高尔基体水解,继而释放结构域,激活CHOP,激活后的CHOP可促进细胞的凋亡[18]。本研究结果显示利拉鲁肽作用HCT116 细胞后,ATF6 p50、CHOP蛋白表达升高,细胞凋亡率显著升高,且随着浓度的增加而增加,提示利拉鲁肽可通过促进ATF6 通路的激活发挥促凋亡作用,抑制肿瘤的发展。研究发现,ERS通过促进CT-26细胞的凋亡发挥抗癌作用[19]。肝癌HepG2 细胞中,ATF6 通路激活,促进CHOP的表达,进而诱导细胞的凋亡[20]。细胞凋亡过程涉及一系列基因的表达,高表达CHOP能够抑制Bcl蛋白家族中抗凋亡蛋白Bcl-2的表达,同时Bax蛋白表达增加,迁移至线粒体和核膜上,使线粒体膜通透性增加,激活Caspase-3分子,进而产生Caspase级联反应而诱发细胞凋亡[21]。本研究中蛋白质印迹法检测显示凋亡因子Bax、Caspase-3 蛋白均显著增加,提示利拉鲁肽可能是通过ATF6通路调控Bcl-2/Bax 表达,促进Caspase-3 凋亡因子激活而实现对结肠癌细胞HCT116凋亡的诱导作用。
综上所述,利拉鲁肽能够显著抑制结肠癌细胞HCT116 体外增殖,引起细胞周期阻滞,通过激活ATF6通路促进细胞凋亡,发挥抗肿瘤作用。然而利拉鲁肽诱导结肠癌细胞凋亡作用机制十分复杂,其抗肿瘤的具体作用机制尚需深入研究。

图2 流式细胞术检测不同浓度利拉鲁肽组(A为0 nm、B为10 nm、C为100 nm、D为1 000 nm)结肠癌HCT116细胞周期图3 不同浓度利拉鲁肽(A为0 nm、B为10 nm、C为100 nm、D为1 000 nm)作用下结肠癌细胞凋亡情况检测图4 不同浓度利拉鲁肽细胞中21KD蛋白(Bax)、半胱胺酸蛋白酶-3(Caspase-3)蛋白表达情况图5 不同浓度利拉鲁肽细胞中转录活化因子6通路蛋白ATF6 p50、CCAAT-增强子结合蛋白(C/EBP)同源蛋白(CHOP)蛋白表达情况
