苄基四氮唑衍生物的合成及抗菌活性研究
2020-03-20郑贤静金成华梁承武
郑贤静,金成华*,梁承武
(1.延边大学药学院,吉林 延吉 133002;2.吉林医药学院药学院,吉林 吉林 132013)
四氮唑类化合物是含有四个氮原子的五元芳香杂环化合物,是一类在药物有机合成中非常重要的中间体,目前四氮唑化合物应用最为广泛的包括1位取代、5位取代和1,5位取代四氮唑衍生物[1]。四氮唑化合物结构修饰主要在1,5号位上进行,并且在抗菌领域以及抗高血压领域主要发挥作用的也是1,5号位修饰的四氮唑化合物,作为中间体进行研究[2]。
近年来在抗菌药物领域,四氮唑化合物结构作为侧链结构修饰被引入头孢类抗生素的应用中,特别是第三代、第四代头孢类抗生素头孢类药物,如氟氧头孢、头孢咪唑、头孢呱酮头孢替安等,都表现出良好的抗菌活性[3]。
溴化锌可以催化以苄基叠氮和苯甲酰氰为原料的[2+3]环加成,这是一种合成四氮唑的实用方法,操作简便、产率高[4]。本研究合成出7个苄基四氮唑类衍生物,并用生长速率法测定化合物的杀菌活性。
1 材料与方法
1.1 路线设计
本实验主要针对四氮唑化合物1,5号位修饰进行合成研究,如scheme 1,以苯甲酰氯和苄基氯为原料,通过亲核取代反应合成出苯甲酰氰化合物(2)和苄基叠氮化合物(4)[5],最终以溴化锌为催化剂合成化合物5。在scheme 2所示,以不同的合成路线,以苯甲酰氯为原料,先与叠氮化钠进行[2+3]环合为四氮唑类化合物[6],然后与苄基氯进行亲核取代,最终合成化合物5等衍生物。
Scheme 1(a):三甲基氰硅烷,碘化锌,100 ℃,2 h;(b)叠氮化钠,N,N-二甲基甲酰胺,甲苯,75 ℃,3.5 h;(c):溴化锌2,N,N-二甲基甲酰胺,回流20 h。
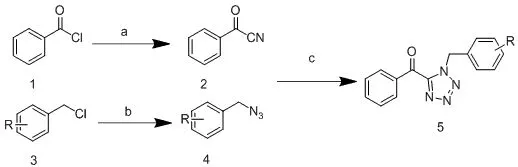
R=a:-H,b:4-CH3,c:4-OCH3,d:4-Cl,e:4-F,f:4-Br,g:4-OH
Scheme 2(a):三甲基氰硅烷,碘化锌,100 ℃,2 h;(c):溴化锌2,N,N-二甲基甲酰胺,回流,20 h;(d)叠氮化钠,N,N-二甲基甲酰胺,甲苯,75 ℃,5 h。
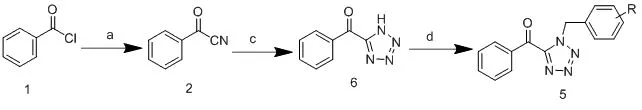
R=a:-H,b:4-CH3,c:4-OCH3,d:4-Cl,e:4-F,f:4-Br,g:4-OH
1.2 仪器与试剂
JH21O2电子天平;IBUCHI旋转蒸发仪;DZF-6050型真空干燥箱;KQ-C玻璃仪器气体烘干箱;DLSB-5/25 ℃(KEER)冷凝器;BHX-9240A型电热恒温鼓风干燥箱;SHZ-Ⅲ循环水真空泵(南京科尔仪器设备有限公司);Bruker Avance-500型核磁共振谱仪(均以CDCl3为溶剂,TMS为基准物质)。
苯甲酰氯(98%,天津市凯信化学工业有限公司);苄基氯(98%,国药集团化学试剂有限公司);叠氮化钠;二甲基甲酰胺(99%);三甲基氰硅烷(98%,麦克林);碘化锌;溴化锌(天津市光复精细化工研究所),其余试剂均为分析纯级别。
测试中所用到的革兰阳性菌包括:金黄色葡萄球菌(S.Aureus4220)、耐喹诺酮金黄色葡萄球菌、耐加氧西林金黄色葡萄球菌、白色念珠菌(Candidaalbicans7535)、变形链球菌(Streptococcusmutans3289)。革兰阴性菌:大肠杆菌(E.coli1924)。其中对照药选取加替沙星(Gatifloxacin)和莫西沙星(Moxifloxacin)作为参考。
1.3 合 成
1.3.1苯甲酰氰(2)的合成
安装回流反应装置,加入1.05 g(10.46 mmol)三甲基氰硅烷,将苯甲酰氯1.5 g(10.46 mmol)缓慢滴加入三甲基氰硅烷中,加入催化剂量的碘化锌16.73 mg(50 μmol),搅拌条件下加热到100 ℃,反应2 h,薄层色谱监测反应完全。加入10.46 mL冰水,用乙酸乙酯10 mL萃取3次,合并油相,并用无水硫酸钠干燥,过滤,减压除去乙酸乙酯,得无色的油状物质化合物(2),收率为70%。
1.3.2苄基叠氮(4)的合成
先安装200 mL的两口瓶,置于冰浴条件下,加入5.00 g(37.5 mmol)的苄基氯,加入4.93 g(3.753 mmol)的叠氮化钠,加入溶剂16.11 mL的DMF和16.11 mL的甲苯,搅拌条件下加热到70 ℃。保温3.5 h,反应结束,用薄层色谱检测。加入150 mL去离子水,用甲苯(16.11 mL)萃取3次,合并油相甲苯,并用无水硫酸钠干燥1 h,过滤,减压除去甲苯。得化合物(4),收率为68%。
1.3.3苯基(1H-四唑-5-基)甲酮(6)的合成
安装100 mL的两口瓶,将叠氮钠0.742 g(11.42 mmol)加入到苯甲酰氰1.00 g(9.52 mmol)中,加入溶剂(DMF 5 mL),加入催化量的溴化锌,搅拌下加热回流20 h,并用薄层色谱监测。降温到常温,放入冰水中出现黄色的固体,加入0.73 mL HCl固体溶解,继续搅拌2 h,又重新析出固体,然后过滤并用水洗。得终产物(6),收率为62%。
1.3.4(1-苄基-1H-四唑-5-基)(苯基)甲酮(5)的合成通法
安装100 mL的两口瓶,将叠氮化苄基1.55 g(11.42 mmol)加入到苯甲酰氰1.00 g(9.52 mmol)中,加入溶剂(DMF 5 mL),加入催化量的溴化锌,搅拌下加热回流20 h,并用薄层色谱监测。降温到常温,再放入冰水中会出现黄色的固体,加入0.95 mL HCl固体溶解,继续搅拌2 h,又重新析出固体,然后过滤并用水洗,得终产物(5)。
1.4 体外抗菌活性筛选
最低抑菌浓度(minimal inhibitory concentration,MIC)是细菌在体外培养基上接种,在18~24 h内能够抑制其生长所需的最低药物浓度。这是一项常用的衡量化合物抗菌活性的重要指标。本实验对合成的化合物进行MIC活性的测试,并且对比它们结构与活性的关系。
具体细筛操作过程:将5 mg的待测样品溶于782 μL的DMSO中。在2 mL的MHB(Mueller-Hinton broth)培养基中将20 μL待测菌种接种培养至对数期,之后在培养皿中用培养基将细菌稀释为105CFU/mL。首先取100 μL的培养基于待测的96孔板中,根据二倍稀释法原理,获得一系列的样品浓度为64~1 mg/L。之后向每个微孔内加入100 μL的待测菌稀释液,然后将96孔板放入650 nm的酶标仪中,观察记录其吸光度。37 ℃的培养箱内培养20~24 h后,再将96孔板放入酶标仪中,记录此时的吸光度。同一块96孔板,根据前后吸光度的变化,运用相应的公式,计算出每种药品的MIC值。实验平行进行3次。
2 结 果
2.1 合成实验结果
通过合成,共得到了7个的苄基四氮唑结构的化合物,化合物的结构经1H NMR和质谱确证。
(1-benzyl-1H-tetrazol-5-yl)(phenyl)methanone(5a):yellow solid,yield 72%;m.p.80~83 ℃;1H NMR(300 MHz,DMSO-d6)δ 8.40(d,2H),7.83-7.80(m,1H),7.55(m,2H),7.37-7.33(m,5H),3.46(s,2H)。m/z 265.28(M+)。
[1-(4-methylbenzyl)-1H-tetrazol-5-yl](phenyl)methanone(5b):yellow solid,yield 78%;m.p.91~93 ℃;1H NMR(300 MHz,DMSO-d6)δ 8.39(d,2H),7.88-7.85(m,1H),7.58(m,2H),7.11(d,2H),7.01(d,2H),5.46(s,2H),2.19(S,3H)。m/z 279.41(M+)。
[1-(4-methoxybenzyl)-1H-tetrazol-5-yl](phenyl)methanone(5c):yellow solid,yield 66%;m.p.101~103 ℃;1H NMR(300 MHz,DMSO-d6)δ 8.40(d,2H),7.85-7.82(m,1H),7.57(m,2H),7.10(d,2H),7.00(d,2H),5.44(s,2H),3.91(S,3H)。m/z 295.47(M+)。
[1-(4-chlorobenzyl)-1H-tetrazol-5-yl](phenyl)methanone(5d):yellow solid,yield 65%,m.p.105~107 ℃,1H NMR(300 MHz,DMSO-d6)δ 8.33(d,2H),7.73-7.71(m,1H),7.58(m,2H),7.12(d,2H),7.02(d,2H),5.48(s,2H)。m/z 299.70(M+)。
[1-(4-bromobenzyl)-1H-tetrazol-5-yl](phenyl)methanone(5e):yellow solid,yield 79%,m.p.118~121 ℃,1H NMR(300 MHz,DMSO-d6)δ 8.29(d,2H),7.77-7.70(m,3H),7.58-7.56(m,2H),7.03-7.05(d,2H),5.47(s,2H)。m/z 344.38(M+)。
[1-(4-fluorobenzyl)-1H-tetrazol-5-yl](phenyl)methanone(5f):yellow solid,yield 80%,m.p.104~106 ℃,1H NMR(300 MHz,DMSO-d6)δ 8.35(d,2H),7.72-7.70(m,1H),7.58-7.56(m,2H),7.14-7.11(m,4H),5.46(s,2H)。m/z 283.34(M+)。
[1-(4-hydroxybenzyl)-1H-tetrazol-5-yl](phenyl)methanone(5g):yellow solid,yield 56%,m.p.78~80 ℃,1H NMR(300 MHz,DMSO-d6)δ 9.08(s,1H),8.31(d,2H),7.73-7.71(m,1H),7.58-7.56(m,2H),6.95-6.92(d,2H),6.63-6.61(d,2H),5.49(s,2H)。m/z 281.30(M+)
2.2 抗菌实验结果
本研究根据新药设计拼合原理,共计合成了7个苄基四氮唑结构的化合物。实验选用了3个不同取代基的化合物进行抑菌活性研究,探究推电子效应与吸电子效应对苄基四氮唑类衍生物抗菌活性的影响。结果如表1所示,化合物5 d对所测细菌都表现出较好的抗菌活性,其对革兰氏阳性菌金黄色葡萄球菌4220和对革兰氏阴性菌大肠杆菌1924的最低抑菌浓度均达到8 mg/L,弱于阳性对照药加替沙星和莫西沙星。另外,化合物5 d对真菌白色链球菌7535的抑菌浓度达到16 mg/L。
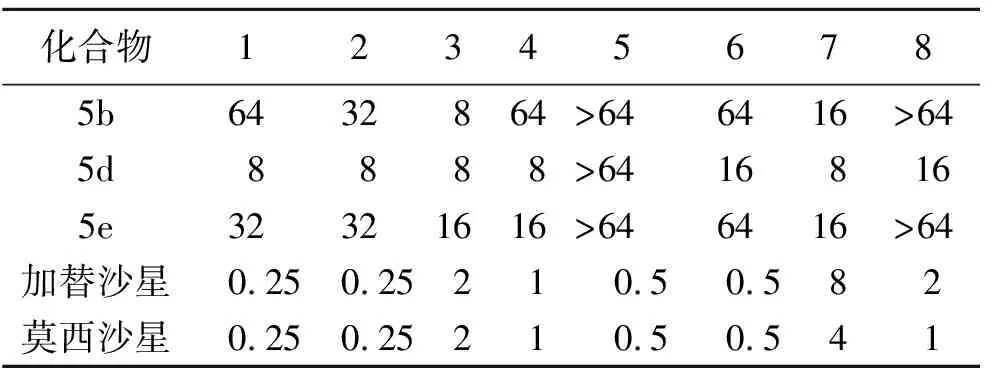
表 1 化合物对不同细菌的MIC(mg/L)
1.StaphylococcusaureusRN4220;2.Streptococcus mutans 3289;3.EscherichiacoliKCTC1924;4.Pseudomonasaeruginosa2742;5.SalmonellaentericaserovarTyphimurium2421;6.Candidaalbicans7535;7.Quinolone-resistantS.aureusCCARM3505;8.Methicillin-resistantS.aureusCCARM3506
3 讨 论
四氮唑化合物的特性在作为官能团时与羧酸相似,解离常数pKa值比较相近,空间结构的平面离域体系也比较相近,可以很好地替代羧酸一类生物药物在生物代谢过程中的作用。正因为四氮唑类化合物具有这些特殊的功能和结构,所以关于四氮唑的研究越来越多[7]。20世纪50年代对于四氮唑化合物的合成及研究发展迅速,合成出的四氮唑类化合物大约300多种,使得其在药物、农业、化学和供能材料等方面得到广泛应用[8]。
构效关系研究发现:苯环上Cl取代时,化合物表现出抗菌活性;苯环上取代基活性关系:4-Cl>4-F>4-CH3;苯环上的吸电子基团活性大于供电子基团。
