从泡菜中分离的植物乳杆菌P51降解亚硝酸盐影响因素的动态研究
2020-03-20苏容容熊蝶袁岚玉冯武陈加平
苏容容,熊蝶,袁岚玉,冯武,陈加平
(华中农业大学 食品科学技术学院,武汉 430070)
亚硝酸盐在食品加工中普遍存在,对人体有一定潜在的危害,过量食用会导致体内摄入的亚硝酸盐含量超标,引发一系列的安全问题。亚硝酸盐可与胺和酰胺反应生成N-亚硝基化合物,将增加胃癌、食道癌、鼻咽癌和膀胱癌的患病患病风险[1-3]。同时,亚硝酸盐还可将血红蛋白中的Fe2+氧化成Fe3+,导致高铁血红症[4]。因此,有效控制食品中亚硝酸盐含量,提高其食用安全性已经成为人们研究的热点问题。
目前报道的降解亚硝酸盐的方法有很多种,但最简单、安全、有效的方法是利用乳酸菌控制发酵食品和腌制品中的亚硝酸盐[5]。近些年来,国内外不少学者从泡菜和肉制品中分离出了具有降解亚硝酸盐作用的乳酸菌[6-10]。Dodds和Collins-Thompson从商业肉制品中分离出乳酸菌,经鉴定后基本为同型发酵乳酸菌,并发现乳酸的产生和pH的降低可能是培养基中亚硝酸盐降解的主要原因。杨晶等人研究发现从泡菜中分离的植物乳杆菌发酵产生的有机酸对亚硝酸盐具有降解作用。张庆芳等人研究发现乳酸菌产生的酸和亚硝酸盐还原酶对亚硝酸盐的降解起着重要作用。不同种类的乳酸菌降解亚硝酸盐效果和降解机理存在差异性。因此,本文研究从泡菜中分离的植物乳杆菌P51降解亚硝酸盐的影响因素,分析其降解亚硝酸盐的作用机制,为乳酸菌发酵制品的应用和控制生产过程中亚硝酸盐含量提供了重要参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种及培养基
植物乳杆菌P51:实验室前期从重庆、四川、陕西和湖北四地家庭自制泡菜中分离筛选出来的菌株。
MRS肉汤培养基:蛋白胨10.0 g,牛肉浸粉8.0 g,酵母浸粉4.0 g,葡萄糖20.0 g,磷酸氢二钾2.0 g,柠檬酸氢二铵2.0 g,乙酸钠5.0 g,硫酸镁0.2 g,硫酸锰0.04 g,吐温-80 1.0 g,蒸馏水1000 mL,pH值5.7±0.2,121 ℃灭菌20 min,备用。
1.1.2 试剂
氯化钠、磺胺、盐酸萘乙二胺、盐酸、亚硝酸钠(均为分析纯):上海国药集团化学试剂公司;乳酸(分析纯):北京索莱宝科技有限公司。
1.2 仪器与设备
SHP-250型生化培养箱 上海精宏实验设备有限公司;Microfuge 20R型高速冷冻离心机 美国贝克曼库尔特有限公司;M200 Pro型光吸收酶标仪 瑞士帝肯集团公司;VD-1320型超净工作台 北京东联哈尔仪器制造有限公司;YX-24LDJ型手提式压力蒸汽灭菌锅 江阴滨江医疗设备有限公司;UV1800型紫外-可见分光光度计 日本岛津公司;PHS-3C型数显pH计 上海仪电科学仪器股份有限公司。
1.3 方法
1.3.1 亚硝酸盐含量测定
采用格力斯反应比色法测定培养基中亚硝酸盐含量,将发酵液离心(10000 r/min,5 min,4 ℃),取上清液稀释到合适的浓度后取1 mL于具塞比色管中,分别加入显色剂0.2%磺胺溶液、0.1%盐酸萘乙二胺溶液、44.5%盐酸溶液各1 mL,摇匀,在暗处反应5 min,用超纯水定容至10 mL,混匀,在538 nm下测定吸光值[11]。亚硝酸盐标准曲线也采用类似的方法进行绘制,然后根据标准曲线计算发酵液中的亚硝酸盐含量,并计算降解率。
降解率(%)=(初始培养基中NaNO2含量-发酵液中NaNO2含量)/初始培养基中NaNO2含量×100%。
1.3.2 菌悬液的制备
取保存于4 ℃冰箱中植物乳杆菌P51的斜面,用接种环在MRS琼脂培养基上划线,置于恒温培养箱中37 ℃培养24 h,然后取单菌落接种于MRS液体培养基中,置于恒温培养箱中37 ℃培养16 h。经冷冻离心(10 ℃,20 min,6000 r/min)弃去上清液,用生理盐水重悬2次后调整到菌浓度为1×108CFU/mL。
1.3.3 温度对植物乳杆菌P51降解亚硝酸盐的影响
将植物乳杆菌P51活化后,用0.85%的生理盐水制备成菌悬液。按照2%的接种量,分别接种于50 mL含200 μg/mL NaNO2的MRS肉汤培养基中,分别于25,28,30,35,37 ℃下厌氧培养,并在0,4,8,12,24,36,48 h取样,测定发酵液中亚硝酸盐含量和pH值。同时以不接种的培养基作为空白对照。
1.3.4 NaCl浓度对植物乳杆菌P51降解亚硝酸盐的影响
将植物乳杆菌P51活化后,用0.85%的生理盐水制备成菌悬液。按照2%的接种量,分别接种于50 mL含200 μg/mL NaNO2的MRS肉汤培养基中,在培养基中分别添加NaCl含量为0%、2%、4%、6%、8%、10%,于37 ℃下厌氧培养,并在0,4,8,12,24,36,48 h取样,测定发酵液中亚硝酸盐含量和pH值。同时以不接种的培养基作为空白对照。
1.3.5 亚硝酸盐浓度对植物乳杆菌P51降解亚硝酸盐的影响
将植物乳杆菌P51活化后,用0.85%的生理盐水制备成菌悬液。按照2%的接种量,分别接种于50 mL含100,150,200,250,300 μg/mL NaNO2的MRS肉汤培养基中,于37 ℃下厌氧培养,并在0,4,8,12,24,36,48 h取样,测定发酵液中亚硝酸盐含量和pH值。同时以不接种的培养基作为空白对照。
1.3.6 培养基初始pH值对植物乳杆菌P51降解亚硝酸盐的影响
将植物乳杆菌P51活化后,用0.85%的生理盐水制备成菌悬液。按照2%的接种量,分别接种于50 mL含200 μg/mL NaNO2的不同pH值的MRS肉汤培养基中,培养基的pH分别用乳酸调节为4,4.5,5,5.5,6,于37 ℃下厌氧培养,并在0,4,8,12,24,36,48 h取样,测定发酵液中亚硝酸盐含量和pH值。同时以不接种的培养基作为空白对照。
1.3.7 乳酸降解亚硝酸盐的变化
将MRS肉汤培养基的pH分别用乳酸调节为4,4.5,5,5.5,6,然后加入亚硝酸钠溶液使培养基的NaNO2浓度为200 μg/mL,于37 ℃下培养,并在0,4,8,12,24,36,48 h取样,测定培养液中亚硝酸盐含量。
1.3.8 植物乳杆菌P51发酵上清液降解亚硝酸盐的效果
将植物乳杆菌P51活化后,用0.85%的生理盐水制备成菌悬液。将植物乳杆菌P51菌悬液加入到MRS肉汤培养基中,在不同时段分别取pH 4.5和pH 4的发酵液,将不同pH值的发酵液离心后过0.22 μm的滤膜,得到发酵上清液,再将亚硝酸钠溶液分别加入到pH 4.5和pH 4的发酵上清液中使其NaNO2浓度为200 μg/mL,于37 ℃下厌氧培养,并在0,4,8,12,24,36,48 h取样,测定培养液中亚硝酸盐含量。
1.4 数据分析
采用Excel 2010处理数据和统计分析,采用Origin 8.0进行绘图。实验数据均重复3次,以平均值±标准偏差表示,以p<0.05表示有显著差异,具有统计意义。
2 结果与分析
2.1 植物乳杆菌P51在不同温度下降解亚硝酸盐的变化

图1 不同温度下接种植物乳杆菌P51后培养液pH的变化Fig.1 Changes of pH values in culture solution afterinoculation with Lactobacillus plantarumP51 at different temperatures
由图1可知,随着发酵时间的增加,25,28,30,35,37 ℃ 5个温度下接种植物乳杆菌P51后培养液的pH呈现先快速下降后趋于稳定的趋势。其中,37 ℃时培养液的pH下降速度最快,其次是35,30,28 ℃,25 ℃下降最慢。在8 h内37 ℃从5.83下降到4.01, 35 ℃从5.83下降到4.05,30 ℃从5.84下降到4.55,28 ℃从5.83下降到4.59,25 ℃仅仅从5.83下降到5.43。这可能是由于植物乳杆菌P51的最适生长温度为37 ℃,温度越高,植物乳杆菌P51的生长情况越好,代谢情况越好,产酸又多又快,温度越低越不利于植物乳杆菌P51的生长代谢,从而导致其产酸量下降,发酵液的pH变化缓慢。

图2 不同温度下植物乳杆菌P51降解亚硝酸盐的变化Fig.2 Changes of nitrite degradation by Lactobacillus plantarum P51 at different temperatures
由图2可知,随着发酵时间的延长,不同温度下亚硝酸盐的降解率在不断增加,48 h内5个温度下的亚硝酸盐降解率达到99%以上。其中,接种植物乳杆菌P51在37 ℃温度下降解亚硝酸盐的速度最快,其次是35,30,28,25 ℃降解亚硝酸盐的速度最慢。这与发酵液中pH变化是一致的,且当发酵液的pH在4左右时亚硝酸盐的降解率在急速上升,与林浩等人的研究结果一致[12]。这可能是由于温度的变化导致植物乳杆菌P51产酸和产生的亚硝酸盐还原酶发生改变,温度越低,亚硝酸盐还原酶活性越低,还原的亚硝酸盐越少,温度越低,产酸量越少,发酵液的pH值越高,越不利于分解亚硝酸盐[13]。而温度越高越接近植物乳杆菌P51的最适生长温度,产酸和酶活都会大大提高,从而更快地降解培养液中的亚硝酸盐。
2.2 植物乳杆菌P51在添加不同含量NaCl的培养基中降解亚硝酸盐的变化

图3 不同食盐含量下接种植物乳杆菌P51后培养液中pH的变化Fig.3 Changes of pH values in culture solution afterinoculation with Lactobacillus plantarum P51under different salt content
由图3可知,随着发酵时间的延长,添加不同NaCl含量的培养液中pH值呈不断下降趋势,且NaCl含量越低,培养液中pH值下降越快。在0%~6%范围内,NaCl含量越低,培养液的pH值越低,且在4~24 h发酵液的pH值下降速率明显高于其他时间段,48 h发酵液的pH值接近3.7。这可能是由于此时植物乳杆菌处于对数生长期,产酸量大使得培养液的pH值下降快。当NaCl含量为8%和10%时,培养液的pH值在48 h内变化缓慢,48 h发酵液的pH值分别为5.03和5.31。这可能是由于高含量的NaCl使得植物乳杆菌P51的生长受到抑制,从而导致培养液的pH值变化缓慢。
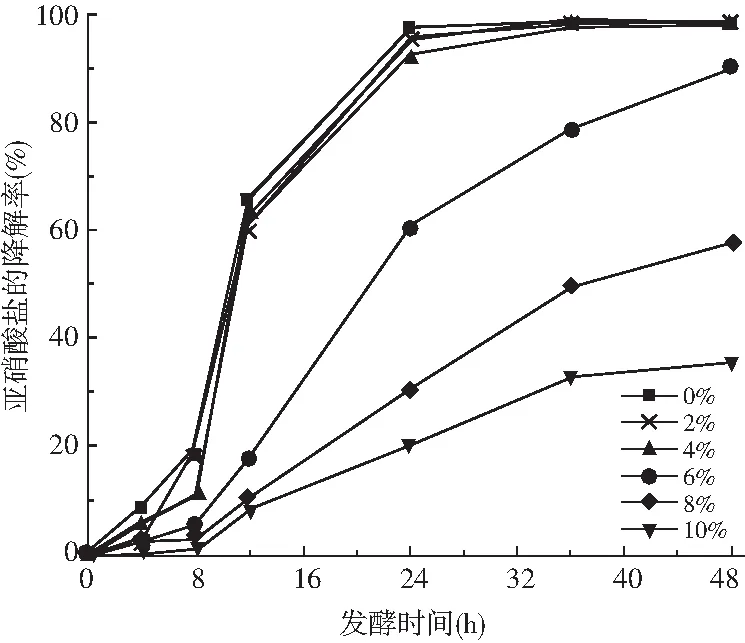
图4 不同食盐含量下植物乳杆菌P51降解亚硝酸盐的变化
由图4可知,植物乳杆菌P51在不同NaCl含量的培养液中,培养液中亚硝酸盐含量不断减少。其中,低浓度的NaCl(0%~4%)对植物乳杆菌P51降解亚硝酸盐的效果没有很大影响,说明从泡菜中分离的植物乳杆菌P51具有一定的耐食盐能力,具备应用到发酵食品和腌制食品中的潜力。当NaCl含量为6%时,该菌株降解亚硝酸盐的效果不如低浓度,而当NaCl含量高于8%,植物乳杆菌P51降解亚硝酸盐的效果受到明显抑制。这可能是由于高浓度的NaCl抑制了植物乳杆菌P51的生长繁殖,影响其生成亚硝酸盐还原酶的量[14]。
2.3 植物乳杆菌P51在含有不同亚硝酸盐浓度的培养基中降解亚硝酸盐的变化
由图5可知,随着发酵时间的延长,含有不同浓度的亚硝酸盐培养液中的pH值呈不断下降趋势,且亚硝酸盐浓度越低,培养液中pH下降越快。在亚硝酸盐浓度低于200 μg/mL时,培养液的pH值从最初的5.8下降到3.7左右,而当亚硝酸盐浓度为250 μg/mL和300 μg/mL时,培养液的pH值从最初的5.8分别降低至4.01和4.42。这可能是由于当亚硝酸盐浓度高于200 μg/mL时植物乳杆菌的生长受到抑制,产酸速率比较慢,从而导致培养液的pH变化缓慢。此外,在4~12 h,培养液的pH下降速率明显高于其他的时间段,可能是由于植物乳杆菌P51在该时间段处于对数生长期,生长繁殖速度加快,产酸速率加快,导致培养液的pH迅速降低。
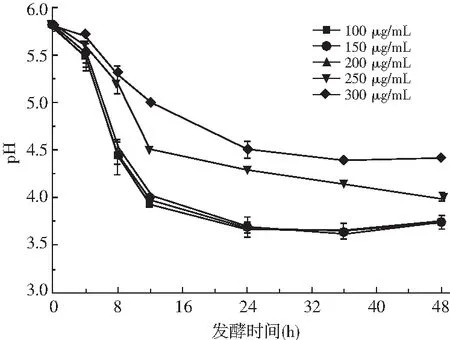
图5 不同NaNO2浓度下接种植物乳杆菌P51后培养液pH的变化Fig.5 Changes of pH values in culture solution afterinoculation with Lactobacillus plantarum P51under different nitrite concentration

图6 不同NaNO2浓度下植物乳杆菌P51降解亚硝酸盐的变化Fig.6 Changes of nitrite degradation by Lactobacillus plantarum P51 under different nitrite concentration
由图6可知,接种植物乳杆菌P51可以降低不同浓度的亚硝酸盐,当亚硝酸盐浓度低于200 μg/mL时,该菌株能够很好地降解亚硝酸盐,最终亚硝酸盐的降解率达到99%以上,说明植物乳杆菌P51在亚硝酸盐浓度为200 μg/mL时降解亚硝酸盐速率最快,当高于该浓度时菌株的生长会受到抑制,亚硝酸盐降解率会变低。
2.4 植物乳杆菌P51在不同初始pH值的培养基中降解亚硝酸盐的变化

图7 不同起始pH下接种植物乳杆菌P51后培养液pH的变化Fig.7 Changes of pH values in culture solution afterinoculation with Lactobacillus plantarum P51at different initial pH values
由图7可知,随着发酵时间的延长,当培养基的起始pH≥4.5时发酵过程中pH值呈现先快速下降后趋于平缓的趋势;当培养基的起始pH为4时,发酵过程中pH值基本没有变化。其中,在12 h内培养基起始pH为6,5.5,5时发酵液的pH值变化明显, pH为6时发酵液的pH降低速度最快,其次是pH为5.5,最慢的是pH为5,培养基起始pH为6时发酵液的pH值由6迅速降低至4.16,培养基起始pH为5.5时发酵液的pH值由5.5迅速降低至4.19,培养基起始pH为5时发酵液的pH值由5迅速降低至4.26,而当培养基起始pH为4.5,4时发酵液的pH值基本不改变。这可能是由于该菌株最适的pH为6,培养基的起始pH值越低越不利于植物乳杆菌P51的生长,导致其不能正常产酸,从而导致发酵液的pH变化缓慢。在48 h时培养基起始pH为6,5.5,5,4.5时发酵液的pH值趋于3.7,而培养基起始pH为4时发酵液的pH值波动很小,pH值不发生变化。由图7可知,发酵液的pH值可以降低到3.7左右,但在pH为4的培养基中培养液却没有变化,这可能是由于高浓度的亚硝酸盐含量和低pH值双重影响导致植物乳杆菌P51在起始pH为4的培养基上不能生长,从而不能产酸,降低培养液的pH值。
由图8可知,接种植物乳杆菌P51在不同起始pH的培养基培养时,发酵液中的亚硝酸盐降解速率曲线不同,在起始pH为6,5.5时该菌株降解亚硝酸盐的速率相当,pH 5时该菌株降解亚硝酸盐速率相比pH 6和pH 5.5时缓慢一些,在8~24 h之间亚硝酸盐的降解率明显高于其他时间段。这可能是由于在这个时间段植物乳杆菌P51处于对数生长期,其生长繁殖快,产酶、产酸量大,导致培养液中亚硝酸盐被大量降解,使得最终的降解率接近100%。当培养基起始pH为4,4.5时发酵前8 h植物乳杆菌P51的生长受到抑制,但亚硝酸盐的降解率呈直线式增加,亚硝酸盐的降解率分别为78.28%和53.69%,在8 h内亚硝酸盐的降解率高于其他时间段。这可能是由于在较低的酸性环境下,H+可以和NO2-发生歧化反应使得亚硝酸盐被大量分解,且pH值越低,亚硝酸盐的降解率越高[15]。随着亚硝酸盐底物的减少,降解率逐渐变缓。24 h时亚硝酸盐的降解率分别为93.57%和85.51%,48 h时亚硝酸盐的降解率分别为98.54%和96.86%。

图8 不同起始pH下植物乳杆菌P51降解亚硝酸盐的变化Fig.8 Changes of nitrite degradation by Lactobacillus plantarum P51 at different initial pH values
2.5 乳酸降解亚硝酸盐的变化
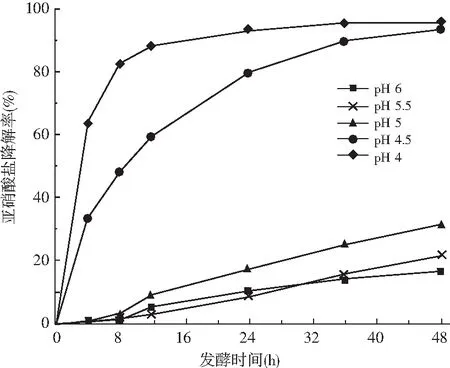
图9 不同起始pH下未接菌的培养液中亚硝酸盐的变化Fig.9 Changes of nitrite in culture solution withoutinoculating bacteria at different initial pH values
由图9可知,随着培养基起始pH值不断降低,亚硝酸盐的降解率在不断增大。当培养基的起始pH为4,4.5时,亚硝酸盐的降解率随着时间的变化非常显著,而培养基的起始pH为6,5.5,5时,亚硝酸盐的降解率随着时间的变化不明显。培养基起始pH为4,4.5时,发酵前12 h发酵液中亚硝酸盐降解率分别达到88.28%和59.66%,最终48 h时亚硝酸盐降解率为95.92%和93.84%。而培养基起始pH为6,5.5,5时,在发酵48 h亚硝酸盐的降解率分别为16.6%、21.46%和31.44%。在不接种植物乳杆菌P51时,当培养基的起始pH为4,4.5时培养液中的亚硝酸盐还能够不断被降解,最终的降解率超过90%,可以进一步印证乳酸可以和亚硝酸盐发生歧化反应使培养液中亚硝酸盐被大量降解。而培养基起始pH>4.5时亚硝酸盐的降解率不到35%,也可以进一步印证植物乳杆菌P51具有很强的降解亚硝酸盐的能力。
2.6 植物乳杆菌P51发酵上清液降解亚硝酸盐效果

表1 不同pH值的发酵上清液在不同时间内降解亚硝酸盐效果Table 1 Effect of fermented supernatant with different pHvalues on nitrite degradation at different time
注:同一行中不同的字母表示相同培养时间不同处理间存在显著性差异(p<0.05)。
由表1可知,随着培养时间的不断增加,不同pH值的发酵上清液降解亚硝酸盐的速率在上升,且pH 4.5的发酵上清液和pH 4的发酵上清液降解亚硝酸盐的速率具有显著性差异。说明接种植物乳杆菌P51所得的发酵液pH值越低,降解亚硝酸盐的效果越好,再根据前面亚硝酸盐的降解率和pH的变化可以进一步印证植物乳杆菌P51降解亚硝酸盐主要依靠酸降解。
3 结论
从泡菜中分离得到植物乳杆菌P51,研究温度、NaCl含量、NaNO2浓度以及培养基起始pH值对其降解亚硝酸盐的影响。根据实验结果分析可知植物乳杆菌P51能够高效降解培养液中的亚硝酸盐,在培养温度为37 ℃,起始pH为6时降解亚硝酸盐效果最好,且其对食盐和亚硝酸盐具有较好的耐受性,其中添加4%的食盐含量,亚硝酸盐浓度为200 μg/mL时植物乳杆菌P51降解亚硝酸盐效果最佳。分析植物乳杆菌P51高效降解亚硝酸盐的原因主要是通过酸降解。
通过对泡菜中分离得到的植物乳杆菌P51的研究可以发现其具有良好的应用价值,将其应用到泡菜和发酵肉制品中可以大大提高这些产品的安全性。同时本结果也为深入研究乳酸菌降解亚硝酸盐机理提供了参考依据。最后,该研究可以为家庭制作泡菜中亚硝酸盐含量安全问题提供一条便捷的解决途径,即在泡菜中添加醋也可以很好地降解泡菜中亚硝酸盐,可以让人们吃上放心、安全的泡菜食品。
