高效液相色谱串联质谱法同时检测粪便中三种抗抑郁药物*
2020-03-16邵一帆张安琪陈天姣李海北陈郑珊师丹阳梁永兵程春燕孙栋良李君文
邵一帆, 张安琪, 陈天姣, 李海北, 陈郑珊, 尹 静, 杨 栋, 师丹阳, 梁永兵, 程春燕, 谭 蓉, 孙栋良, 李君文, 金 敏
(军事科学院军事医学研究院环境医学与作业医学研究所, 天津 300000)
重度抑郁症是一种可遗传的精神类疾病,其主要的临床特点为情绪低落、欣快感不足、睡眠改变、食欲改变等。抗抑郁药物通常分为三环类抗抑郁药、四环类抗抑郁药、单胺氧化酶抑制剂、五羟色胺再摄取抑制剂、五羟色胺和去甲肾上腺素再摄取抑制剂及其它类抗抑郁药物。
5-羟色胺再摄取抑制剂(selective serotonin reuptake inhibitor, SSRIs)类抗抑郁药物,其与经典的三环类抗抑郁药和单胺氧化酶抑制剂相比,具有更好的临床疗效、耐受性和安全性,是目前治疗抑郁症的重要药物[1]。5-羟色胺再摄取抑制剂类抗抑郁药物的化学结构存在很大差异,但其机制相同,通过抑制神经元对5-羟色胺再摄取的机制发挥作用,同时也对其他转运蛋白受体有一定的结合能力[2],引起一定的副作用,其影响主要是肠道紊乱、焦虑、性功能障碍、认知障碍以及5-羟色胺综合征[3]。SSRIs类药物在体内主要通过细胞色素P450(cytochrome P450, CYP)酶进行转化,同时也会对多种CYP亚型活性进行抑制,从而影响体内与CYP代谢相关的其他药物的代谢[4]。因此,监测其在体内的药物浓度能够在保持良好疗效的同时减少不良反应,更能提示潜在的治疗风险[5]。
目前,生物体内血清SSRIs类药物的定量检测方法主要以高效液相色谱串联质谱方法(HPLC-MS)为主[6-8],检测方法较为成熟,而针对生物粪便中SSRIs类药物的含量检测却未见报道。本研究以氟西汀、度洛西汀和艾司西酞普兰等3种临床常用SSRI类药物为研究对象,建立高效液相色谱串联质谱方法检测其在粪便中的含量。通过本文研究,不仅有助于开展抗抑郁药粪便残留的环境风险评估,也有利于定量检测肠道内抗抑郁药物的浓度及分布,研究机体对抗抑郁药的吸收和代谢。
1 材料与方法
1.1 药品与试剂
乙腈、正己烷、异丙醇(乙腈为HPLC纯,其余为分析纯,购置于天津市科密欧化学试剂有限公司),度洛西汀(Duloxetine)标准品、艾斯西酞普兰(Escitalopram)标准品和氟西汀(Fluoxetine)标准品为化学对照品(中国药品生物制品检定所)。度洛西汀、艾斯西酞普兰、氟西汀药物(灌胃用,北京百灵威科技有限公司)
1.2 仪器
Agilent6410B高效液相色谱-三重四级杆串联质谱仪,配有电喷雾离子(ESI)源,MassHunter工作站(美国Agilent公司);XW-80A漩涡振荡器(上海沪西分析仪器厂);vcx 750手持式超声波细胞破碎仪(美国Sonics公司,功率750W);Universal 320R高速离心机(德国Hettich公司);Milli-Q超纯水机(美国Milipore公司)。
1.3 实验动物
8周龄SPF级成年雄性C57BL/6N小鼠12只,体重20±2mg,购自北京维通利华动物技术有限公司。实验小鼠饲养于军事科学院军事医学研究院环境医学与作业医学研究所SPF级屏障环境中,实验过程由本单位实验动物福利伦理委员会审查通过(IACUC of AMMS-04-2020-027)。实验动物自由饮水和进食,昼夜节律12 h。
1.4 高效液相色谱条件
色谱柱为Agilent ZORBAX SB-C18液相色谱柱(2.1 mm×100 mm,3.5 μm),流动相A为超纯水,流动相B为乙腈,流速0.2 ml/min,柱温40℃,进样量5 μl。梯度洗脱程序见表1。
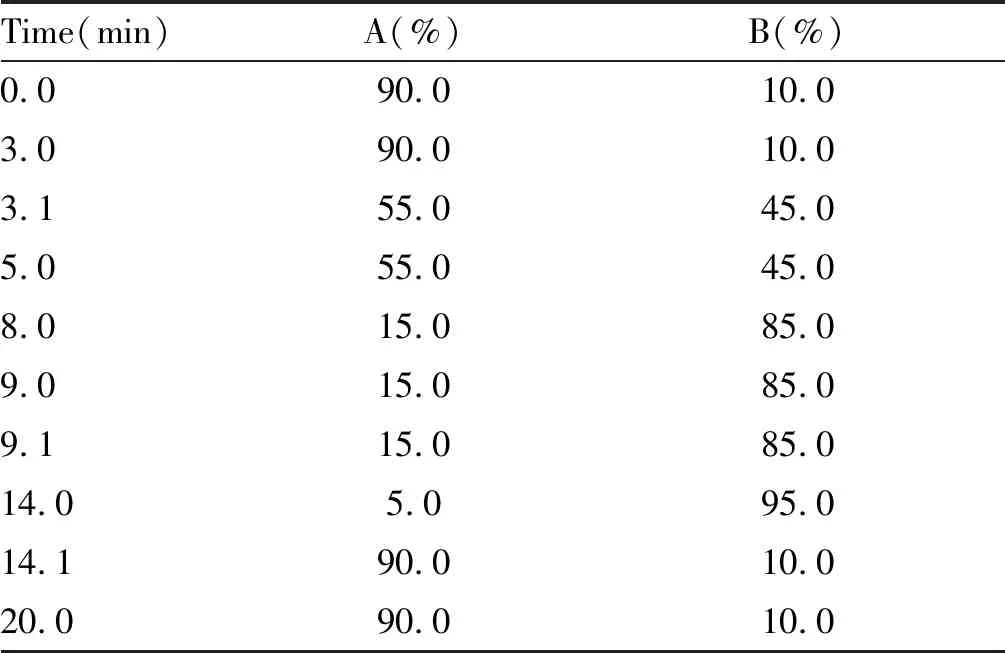
Tab. 1 Gradient elution procedure for HLPC
1.5 质谱条件
通过正离子监测模式(ESI+),对度洛西汀、氟西汀、艾斯西酞普兰分别进行监测(参数见表2)。ESI+模式的毛细管电压: 4.0 kV,干燥气温度: 350℃,干燥气流量:10L/min,碰撞室氮气压力: 0.004Pa,雾化气压力40 psi,检测模式为多重反应监测(MRM),三种标准溶液MRM色谱图见图1。
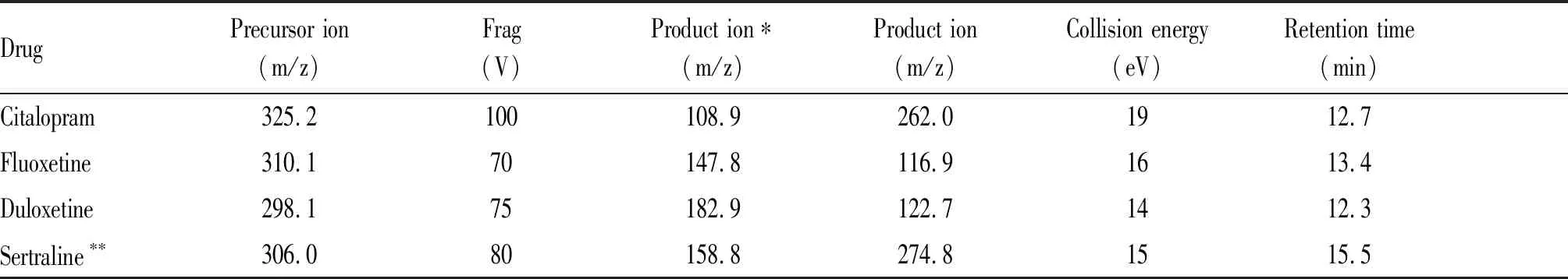
Tab. 2 MS Parameters of SSRI Drugs
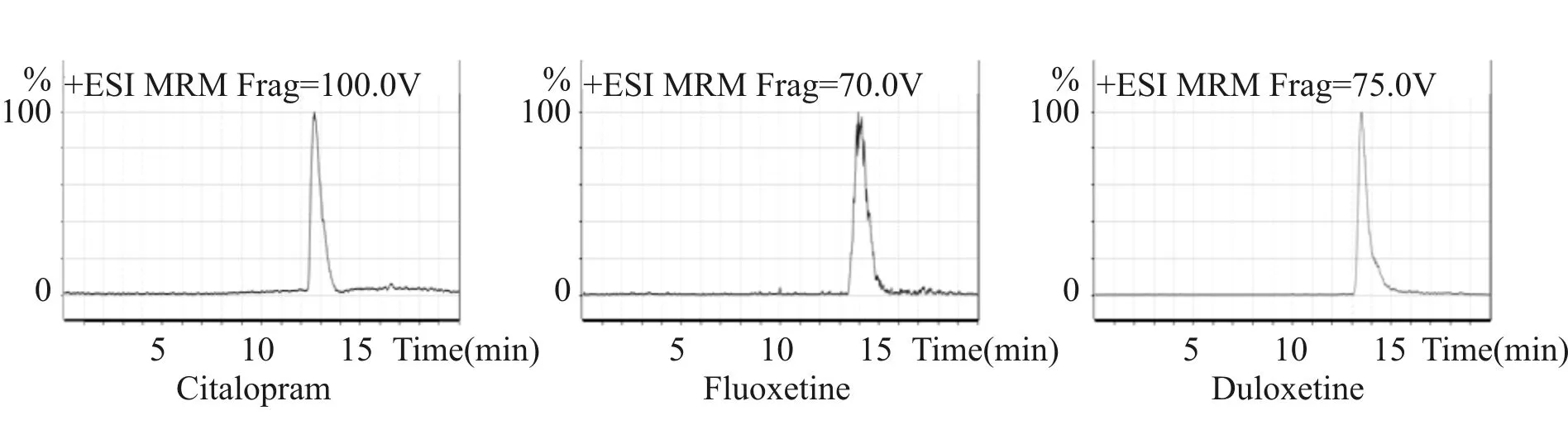
Fig. 1 MRM chromatograms of 3 drugs standard in the feces matrix
1.6 样品的前处理
精确称量100 mg小鼠粪便并加入1 ml去离子水后,用手持式超声波细胞破碎仪(输出功率80 W)均质1 min;加入3 ml正己烷-异戊醇,旋转震荡30 s后,用手持式超声波细胞破碎仪继续均质1 min;9 000 r/min离心10 min,吸取上层有机层至5 ml离心管内;30℃下使用氮气进行吹干后,加入1 ml乙腈复溶,超声1 min,旋转震荡30 s,加入舍曲林(内标)使其终浓度为10 μg/L;0.22 μm滤膜过滤后,样品待测。
1.7 标准曲线的绘制
标准溶液的配制:取适量度洛西汀、氟西汀、艾斯西酞普兰标准溶液并转移至10.0 ml容量瓶中,用乙腈稀释至终浓度分别为1 mg/L、400 mg/L、100 mg/L,于4℃冰箱避光保存。将内标舍曲林标准品采用同上方法稀释至1 mg/L备用。
称取100 mg空白粪便(未进食抗抑郁药物),按照1.4所述方法处理后,得到粪便基质空白溶液。将混合标准液逐级稀释成(以度洛西汀浓度计) 1 000 μg/L、500 μg/L、250 μg/L、100 μg/L、50 μg/L系列溶液后,在各溶液中加入终浓度为10 μg/L的内标舍曲林,充分混匀,经0.22 μm滤膜过滤后,利用HPLC-MS法进行药物浓度测定。以混合标准品溶液各组分的峰面积与内标峰面积之比(y)对各组分浓度(x)绘制标准曲线。
1.8 回收率与精密度测定
称取100 mg空白粪便样品并加入不同浓度的度洛西汀、氟西汀或艾斯西酞普兰标准溶液,震荡30 min,使药物与空白粪便样品充分混合后,使用萃取剂处理样品并进行药物检测。其中,回收率为HPLC-MS法检测出的药物浓度与实际加标药物浓度比值(%),精密度为采用HPLC-MS法测定空白粪便加标样品5次后,获得的平行数据的相对标准偏差(RSD)。
1.9 实际粪便样品测定
将12只C57BL/6N小鼠随机分为西酞普兰组、氟西汀组、度洛西汀组、对照组四组,参照临床用药剂量,每日分别给予艾斯西酞普兰(10 mg/kg)、氟西汀(20 mg/kg)、度洛西汀(20 mg/kg)、生理盐水进行灌胃,并于第28日收集粪便进行药物浓度检测。
2 结果
2.1 流动相的选择
分别使用超纯水-乙腈、1%甲酸水溶液-乙腈作为高效液相色谱流动相,观察它们对各种药物的分离效果。结果表明,1%甲酸水溶液--乙腈作为流动相时,各组分药物的保留时间为4~6 min,且3种药物保留时间间隔<0.3 min,无法充分分离;但以超纯水-乙腈作为流动相时,各组分药物的保留时间为12~14 min,且各药物组分充分分离。因此,本研究选用超纯水-乙腈为流动相。
2.2 样品预处理的优化
对于样品预处理,我们比较了乙腈、正己烷-异丙醇(95∶5,v/v)作为预处理萃取剂的加标回收率。结果表明,乙腈作为萃取剂时,对艾斯西酞普兰、氟西汀、度洛西汀的平均回收率分别为75.9%、 57.8%、49.8%,而采用正己烷-异丙醇(95∶5,v/v)混合液作为萃取剂时,三者的平均回收率分别为 94.0%、82.4%、79.9%,与前者相比,回收率有所提高,因此,本研究选择正己烷-异丙醇混合液作为样品预处理萃取剂。
2.3 线性关系、检出限与定量限
在对应的线性范围内,艾斯西酞普兰、氟西汀、度洛西汀三种药物的相关系数(r)分别为0.9950、0.9999、0.9985,均呈现较好的线性关系。在空白粪便基质中添加低浓度的混合标准液,按上述方法进行测定,以定量离子对3倍信噪比(S/N)的响应值对应的混合标准液浓度定为检出限(LOD),艾斯西酞普兰、氟西汀、度洛西汀三种药物的检出限分别为0.001 μg/g、1 μg/g、0.1 μg/g。以定量离子对10倍信噪比的响应值对应的混合标准液浓度定为定量限(LOQ),三者定量限分别为0.005 μg/g、2 μg/g、0.5 μg/g(表3)。

Tab. 3 Linear ranges, calibration equations, correlation coefficients (r), limits of detection (LOD) and limits of quantification (LOQ) for 3 SSRI drugs in feces
2.4 方法的回收率与精密度
向空白粪便样品中加入高、中、低三种已知浓度的混合标准液,按照建立的方法,对粪便样品分别平行测定5次。结果表明(表4),建立的HPLC-MS法对粪便中艾斯西酞普兰的回收率为84.9%~ 116.5%,RSD为2.80%~6.90%,对氟西汀回收率为61.6%~82.4%,RSD为3.27%~5.36%,对度洛西汀回收率为72.7%~83.1%,RSD为2.82%~12.9%。
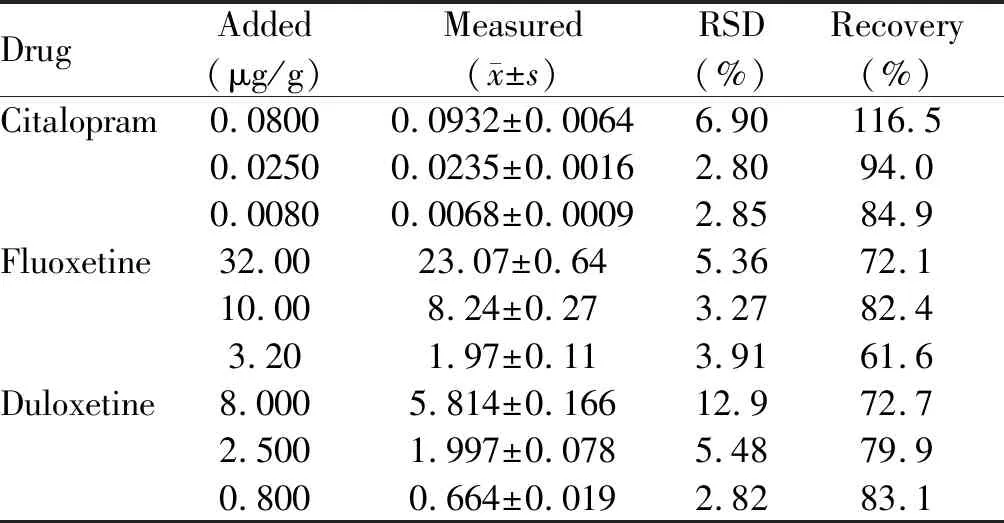
Tab. 4 Rcoveries and RSDs of 3 SSRI Drugs in feces
2.5 实际粪便样品的测定
西酞普兰组小鼠粪便的药物含量为0.025± 0.003 μg/g,氟西汀组小鼠粪便的药物含量为 12.04±1.07 μg/g,度洛西汀组小鼠粪便的药物含量为 3.44±1.37 μg/g,而生理盐水组未检出上述3种药物。
3 讨论
应用于SSRIs类药物的定量检测方法主要以HPLC或HPLC-MS方法为主[6-8],其中液相色谱串联三重四极杆质谱法因其高灵敏度和高选择性已经成为药物定量检测的金标准方法。气相色谱串联质谱虽然也能够进行SSRIs类药物的检测[9, 10],但由于大部分药物及其代谢产物的极性较大,不能直接用气相色谱法进行分析,相对于液相色谱,需要在检测之前对药物进行衍生化,因此,气相色谱串联质谱定量检测SSRIs类药物具有一定局限性。
随着HPLC-MS检测SSRIs类药物浓度方法增多,利用该方法对[11]生物体内药物含量[12]检测已经趋近成熟,但以上技术主要以血浆、尿液等成分较为单一的介质为检测对象。药物在体内主要经过肝脏代谢,代谢产物经肾脏排出,而未经吸收的药物则主要经肠道由粪便排出。由于肠道菌群与人类宿主健康关系密切,而药物有可能破坏肠道菌群所处肠道内环境稳态平衡,从而引发代谢性疾病[13],同时,部分SSRIs类药物也具有促进细菌产生抗生素多重耐药性的特点[14],因此检测粪便中药物的含量被越来越多的人所重视。同时,粪便中含有大量的食物残渣和肠道微生物[15],其基质的复杂性大大增加了样品预处理难度和检测结果的准确性。曾桥等[16]利用HPLC-MS建立了粪便中残留物的分析方法,实现对多种抗生素含量进行检测,戚婧等[17]利用HPLC-MS对粪便中黄连碱的药物含量进行定量检测。然而目前,针对生物粪便中的SSRIs类药物含量检测却未见报道。
本文通过优化粪便样品预处理过程,建立了能够检测粪便三种抗抑郁药物(艾斯西酞普兰、氟西汀、度洛西汀)的HPLC-MS方法,该方法采用手持式超声波细胞破碎仪预处理方法减少粪便基质干扰[18],能够同时检测三种抗抑郁药物含量,而且方法简单、准确,药物回收率高。该技术将为今后开展抗抑郁药粪便残留的环境风险评估提供技术储备,更为开展机体对抗抑郁药的吸收和代谢研究奠定基础。
