SmacN7诱导乳腺癌细胞MDA-MB-157凋亡的作用及其机制*
2020-03-16吕紫嫣张肖艳蒋盼若陈佳玉
吕紫嫣, 张肖艳, 陈 弘, 蒋盼若, 陈佳玉
(绍兴文理学院医学院, 浙江 绍兴 312000)
SmacN7作为体内促凋亡蛋白Smac(second mitochondria-derived activator of caspase)的活性基团,是最小的促凋亡单位,其低表达常导致肿瘤等疾病的发生。已有研究证明Tat-SmacN7通过降低XIAP表达水平以及增加乳腺癌细胞SK-BR-3辐射敏感性促进其凋亡[1];Tat-SmacN7也可以提高Caspase-3、-8、-9的活性,通过细胞凋亡线粒体途径增加食管癌细胞株EC109和非小细胞肺癌细胞株NCL-H460的辐射敏感性[2]。此外,Smac类似物Birinapant和P38抑制剂联合应用于急性髓细胞白血病的治疗;Smac类似物LCL161和Fasl联合应用能促进大部分头颈部肿瘤细胞株凋亡;Smac类似物JP1584和TRAIL联合使用可协同抑制胆管癌肿瘤细胞的侵袭和转移[3]。
乳腺癌是女性最常见的恶性肿瘤之一,其发病率在中国逐年增高,死亡率在女性恶性肿瘤中排第一;全球范围内,乳腺癌患者占癌症病例总数的25%以及所有与癌症相关的女性死亡率的15%[4]。乳腺癌是一种以遗传因素和环境因素相互作用为特征的复杂疾病,已经确定的危险因素包括超重、吸烟以及生殖等因素[5],作为威胁女性健康已久的一种疾病,它的治疗从起初的单纯手术切除治疗逐渐发展到手术与放疗、化疗结合的综合性治疗,但是化疗药物常常引起剧烈的全身毒性反应并且常常发生耐药进而导致治疗失败[6]。现在由于精准医学的提出,人们渐渐地把目光转向特异性好、作用位点明确、效果好、副作用小的基因治疗,这避免了放疗和化疗对机体正常组织细胞的损害。但SmacN7对乳腺癌细胞MDA-MB-157的作用相关研究很少,机制尚不明确,本研究旨在探讨SmacN7对乳腺癌细胞MDA-MB-157的作用及其作用机制,寻找关键基因,以期为乳腺癌的治疗提供新靶点。
1 材料与方法
1.1 材料
乳腺癌细胞MDA-MB-157为绍兴文理学院医学院实验室保存。一抗和酶标二抗购于武汉BOSTER Biotech公司;PCR各引物由上海Sangon Biotech公司合成;AnnexinV-FITC/PI双染试剂盒购于美国BD公司;Cell titer 96®AQueousNon-Radioactive Cell Proliferation Assay(MTS)试剂盒购于美国Promega公司;LDH试剂盒为上海Roche Applied Science公司产品;胰蛋白酶、胎牛血清、PBS、RPMI-1640培养液均源于美国Gibco公司;TRIzol、SuperScript® III First-Strand Synthesis System由美国Invitrogen公司提供;JC-1、hoechst 33342、BCA蛋白浓度测定试剂盒和RIPA裂解液(强)购于上海Beyotime公司。4周龄雄性BALB/C小鼠购自浙江省实验动物中心。
1.2 细胞培养
乳腺癌细胞MDA-MB-157培养于含有10%胎牛血清的RPMI-1640培养液中,放入37 ℃、5% CO2培养箱中孵育,每2~3 d用0.25%胰蛋白酶传代1次,实验均选用对数生长期细胞。
1.3 细胞增殖实验
用RPMI-1640培养液调整MDA-MB-157细胞密度至5×104cell/ml,以100 μl/well接种于96孔板,放置在37℃、5% CO2培养箱中培养3 h。待细胞贴壁后,加入SmacN7,使其终浓度分别为0,2.5,5,10,20 μmol/L,设三复孔,继续放入37℃、5% CO2条件中孵育24 h、48 h、72 h。当孵育结束时,在每孔中加入20 μl MTS细胞增殖检验试剂,37℃、5% CO2再孵育3 h。用酶联免疫检测仪测定各孔在490 nm波长的吸光度(OD值)。
1.4 流式细胞仪检测细胞凋亡、细胞周期
MDA-MB-157细胞以5×104cells/well接种于6孔板中,放置在37℃、5% CO2培养箱中培养至80%融合时,弃培养液,设三复孔,分别加入含0, 2.5,5,10,20 μmol/L浓度SmacN7的RPMI-1640培养液继续培养24 h,分别按照FITC/PE、PI染色试剂盒说明书对细胞进行染色,用流式细胞仪检测细胞凋亡与细胞周期 。
1.5 Hoechst33342染色观察MDA-MB-157细胞核型
将密度为5×105cell/ml的MDA-MB-157细胞以1 ml/well种植于6孔板中,37 ℃、5% CO2培养箱中培养至80%融合时,弃培养液,设三复孔,分别加入含0,10,20 μmol/L浓度SmacN7的RPMI-1640培养液继续再培养24 h,用PBS洗涤细胞3次,加入10 ng/ml的hoechst33342试剂1 ml染色15 min,PBS洗涤,滴1滴甘油。以紫外光340 nm波长激发,倒置荧光显微镜下看各组MDA-MB-157细胞经不同浓度药物作用后的凋亡形态。
1.6 JC-1染色检测线粒体膜电位
将密度为5×105cell/ml的MDA-MB-157细胞以2 ml/well接种于6孔板中,37℃、5% CO2培养箱中培养至细胞贴壁,弃培养液,设三复孔,分别加入含0,2.5,5,10,20 μmol/L浓度SmacN7的RPMI-1640培养液继续培养24 h。按照说明书对细胞进行JC-1染色,染色完成后用胰蛋白酶消化细胞,PBS洗涤细胞3次,流式细胞仪分析线粒体膜电位。
1.7 LDH释放水平检测
将MDA-MB-157细胞以每孔2×105cells接种于96孔板,放置在37℃、5% CO2培养箱中培养至80%融合,弃培养液,设三复孔,分别加入含0,2.5,5,10,20 μmol/L浓度SmacN7的RPMI-1640培养液继续培养24 h,收集细胞和培养上清液,按LDH试剂盒说明书上的方法测定LDH水平。LDH释放率(%)=培养液LDH含量 /(培养液LDH含量+细胞裂解液LDH含量)×100%
1.8 QPCR检测细胞内各基因mRNA水平
将MDA-MB-157以每孔5×105cells接种于6孔板,待细胞生长至90%融合时,弃培养液,设三复孔,分别加入含0,10 μmol/L浓度SmacN7的RPMI-1640培养液继续培养24 h,收集各组细胞,提取总RNA,据qPCR试剂盒说明反转录成cDNA,PCR扩增待测基因及内参基因,各基因引物序列见表1。Real time PCR反应条件:94℃预变性2 min;95℃变性30 s,60℃退火30 s,72℃延伸30 s,35次循环;最后72℃ 10 min。凝胶成像仪记录PCR产物经电泳分离结果,用2-△△CT法表示。
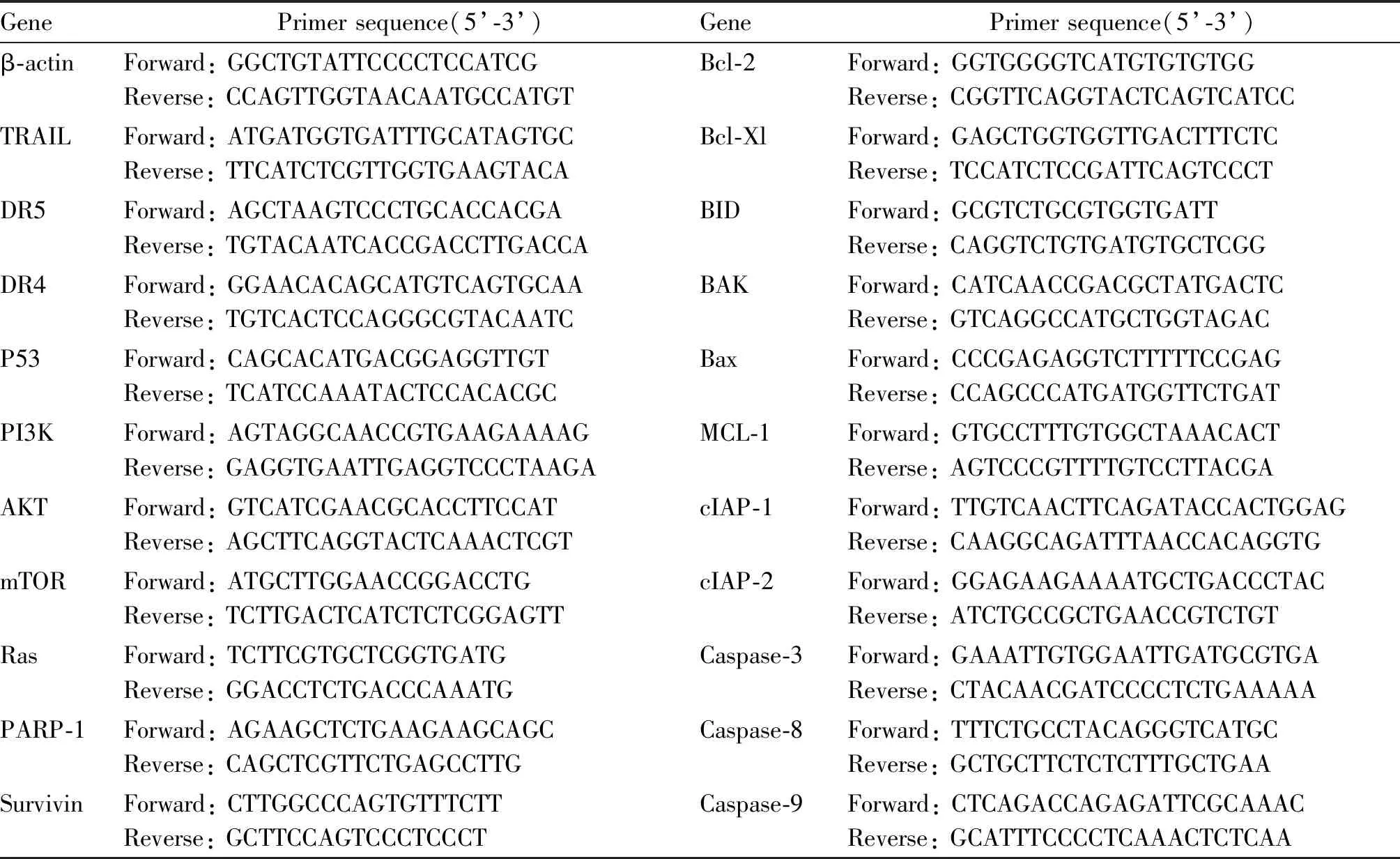
Tab. 1 Primer sequences for qPCR
1.9 抑瘤实验
4周龄雄性BALB/C小鼠在无菌条件下适应一周,随机分成5组,每组20只。取对数生长期的MDA-MB-157细胞,600 g离心5 min,去上清,PBS清洗,重复上述操作2次,用生理盐水调整细胞浓度至1 × 107cells/ml,对BALB/C小鼠进行腹股沟注射,每只0.1 ml,于细胞接种两天后皮下分别注射0、1、5、25、125 mg/kg剂量的SmacN7,两天1次,于首次SmacN7注射后的第20日取10只小鼠的瘤组织并称重。剩余小鼠继续饲养,记录其生存期。
1.10 统计学处理
2 结果
2.1 SmacN7对MDA-MB-157细胞增殖的影响
细胞增殖活性测定结果如表2所示,SmacN7对乳腺癌细胞MDA-MB-157的增殖有显著的抑制作用(P<0.01)。

Tab. 2 Effects of SmacN7 on the proliferation activity of MDA-MB-157 cells (n=3)
2.2 SmacN7对MDA-MB-157细胞凋亡与细胞周期的影响
流式细胞术检测结果如表3所示,MDA-MB-157细胞经2.5 μmol/L、5 μmol/L、10 μmol/L、20 μmol/L的SmacN7作用后,凋亡率显著增加(P< 0.01);Sub-G1期细胞数量明显增多(P<0.01),提示SmacN7可影响MDA-MB-157细胞的细胞周期,诱导细胞凋亡。

Tab. 3 The apoptosis results detected by flow cytometry(%, n=3)
2.3 Hoechst33342染色观察MDA-MB-157细胞凋亡
结果如图1所示,0 μmol/L剂量组MDA-MB-157细胞核呈圆形,边缘光滑整齐,淡蓝色;染色质均质淡染。而乳腺癌细胞MDA-MB-157经10 μmol/L及20 μmol/L的SmacN7作用24 h后,细胞数量减少,细胞核固缩、碎裂,出现典型的凋亡小体,且20 μmol/L SmacN7组细胞数量减少及细胞核型改变较10 μmol/L SmacN7组明显。
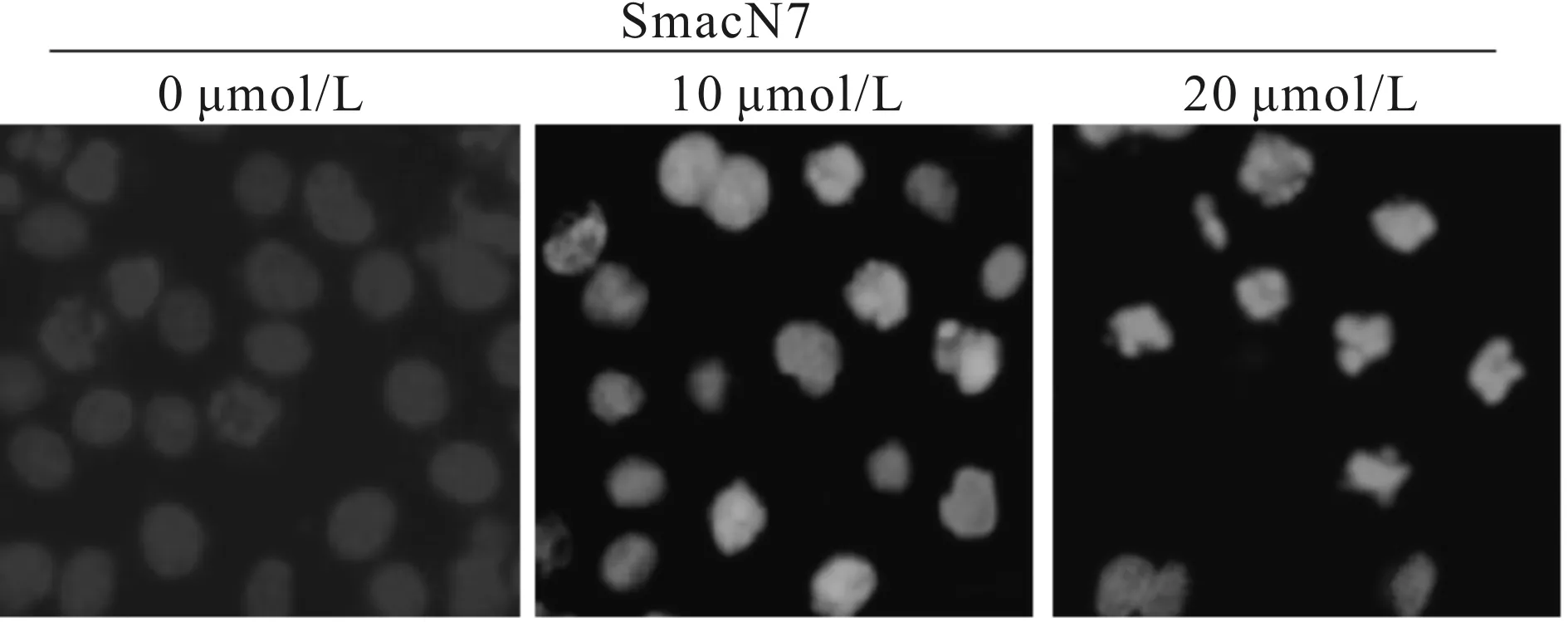
Fig. 1 The results of hoechst 33342 staining (×20)
2.4 SmacN7对细胞线粒体膜及LDH释放的影响
流式分析结果见表4,MDA-MB-157细胞经2.5 μmol/L、5 μmol/L、10 μmol/L、20 μmol/L的SmacN7作用后,其线粒体膜电位可显著降低(P< 0.01),提示SmacN7促进乳腺癌细胞MDA-MB-157凋亡可能的机制是通过影响其线粒体膜电位;LDH浓度均显著升高,表示SmacN7对乳腺癌细胞MDA-MB-157具有显著的细胞毒性 (P<0.01)。
Tab. 4 The results of JC-1 staining of cell mitochondrial membrane potential and LDH release experiment n=3)
2.5 SmacN7影响MDA-MB-157细胞相关基因转录水平
如表5所示的qPCR结果表明,应用SmacN7后,MDA-MB-157细胞内TRAIL、DR4、DR5、p53、PARP-1、Bax、BID、BAK、caspase-3 、caspase-8 、caspase-9基因的转录水平明显上升(P<0.01),PI3K、AKT、Ras、mTOR、Bcl-2、Bcl-xL、MCL-1、cIAP-1、cIAP-2基因的转录水平明显下降(P<0.01)。
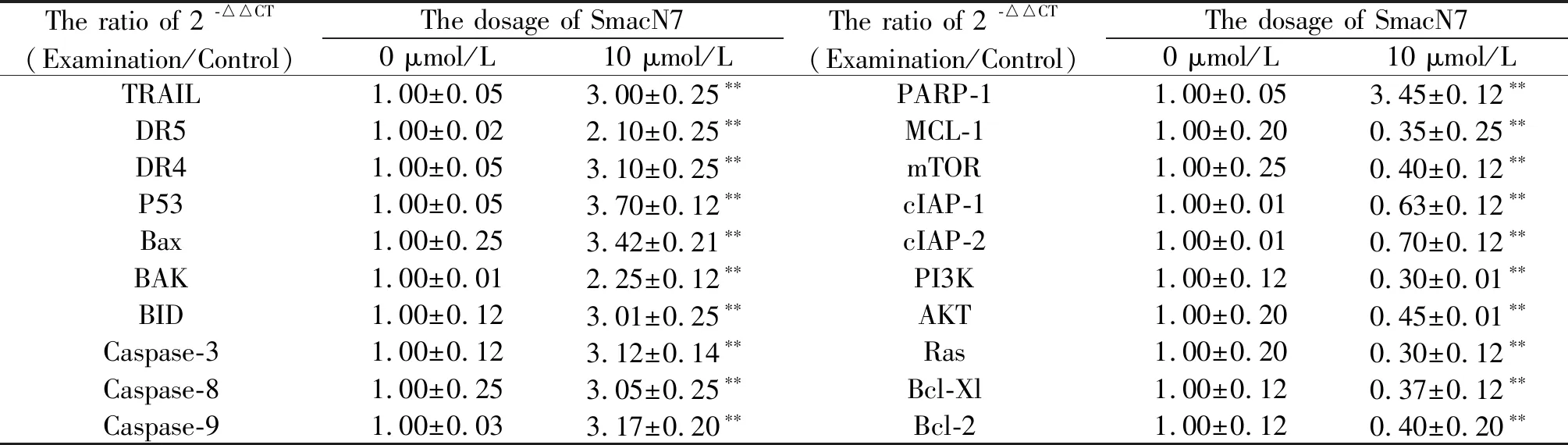
Tab. 5 The qPCR results (n=3)
2.6 抑瘤实验
抑瘤实验结果如表6所示,与未注射SmacN7组小鼠相比,注射1 mg /kg、5 mg /kg、25 mg /kg、125 mg /kg的SmacN7小鼠肿瘤重量显著降低(P<0.01),且其降低与SmacN7剂量呈正相关。注射0~25 mg /kg的SmacN7小鼠的生存期显著延长(P< 0.01),而SmacN7注射量达125 mg /kg时,小鼠生存期缩短。

Tab. 6 The results of tumor suppression and survival time of tumor-bearing mice n=10)
3 讨论
近年来,Smac对乳腺癌发生发展的影响成为热门研究,一些研究指出Smac在乳腺癌细胞凋亡过程中发挥重要作用[7],其表达下降会导致肿瘤快速增长[8]。Smac相关制剂已用于血液系统肿瘤和实体瘤的I期临床试验,深入研究其与乳腺癌的关系和机制能进一步为临床研究提供依据[7]。本研究表明,SmacN7作用于乳腺癌细胞MDA-MB-157不仅使死亡受体DR4、DR5基因的转录水平上调,而且上调Caspase-3、Caspase-8、Caspase-9基因的转录水平。此前有研究指出,DR4、DR5表达的增加能提高TRAIL在细胞凋亡中的敏感性,后者可通过Caspase-8启动线粒体信号通路从而引起细胞凋亡[9]。本研究中,SmacN7使TRAIL与死亡受体DR4、DR5结合,而后死亡受体上的死亡域吸引衔接蛋白并激活Caspase-8从而Caspase-3被激活。Caspase-3可剪切底物PARP-1[10],而PARP-1是一种重要的DNA修复酶[11],其失去活性后乳腺癌细胞MDA-MB-157将发生凋亡。此外,线粒体中Bcl-2家族成员通过调节抑凋蛋白和促凋蛋白在细胞死亡和存活中发挥重要作用[12,13],在Caspase-8的作用下,Bid形成有活性的tBid并进入线粒体,使其渗透转运孔PTP开放从而引起线粒体跨膜电位降低、膜通透性增加,释放大量Cyt-C到细胞质中,并与ATP形成复合体,该复合体与细胞质中的凋亡酶激活因子Apaf-1结合,由ATP提供能量聚集更多Apaf-1并暴露Apaf-1的N端Caspase募集域使caspase-9聚集于此,形成Cyt-C-Apaf-1-Caspase-9凋亡体[14],随后Caspase-3被激活,诱导乳腺癌细胞MDA-MB-157凋亡;同时线粒体膜通透性增加也使Smac/DIABLO释放入胞质[15],有研究指出Smac上的活性基团SmacN7能与IAP家族(如cIAP1、cIAP2)特异性结合使IAP家族丧失抑制Caspase-9和Caspase-3的作用[16],本研究中SmacN7作用于乳腺癌细胞MDA-MB-157使cIAP1、cIAP2基因的转录水平下调,从而阻断IAP家族抑制凋亡的作用,促进乳腺癌细胞MDA-MB-157凋亡。
此外,本研究也显示SmacN7可以下调PI3K/AKT途径中主要蛋白PI3K、AKT、mTOR的基因转录水平。有研究表明,Ras作为PI3K/AKT途径的上游通过与生长因子/促分裂原表面的受体结合而活化[17],从Ras-GDP转化为Ras-GTP后可激活PI3K,后者催化底物生成第二信使其磷酸化AKT的C’端疏水区Ser473从而激活AKT,活化的AKT可直接下调p53的表达,也可以通过其丝氨酸和苏氨酸残基磷酸化后激活mTOR[18],进而调节能量代谢、mRNA翻译以及蛋白质的合成,抑制p53的表达[19]。而p53作为抑癌基因通过Bcl家族发挥促进细胞凋亡的作用[20],它能与Bax基因启动子区结合转录激活促凋蛋白Bax,使其形成同源低聚体以C端为向导嵌入到线粒体外膜;能与MCL-1竞争性结合Bak形成p53-Bak复合体使Bak寡聚化,增加线粒体膜的通透性;也能抑制Bcl-2的表达。癌细胞中P53通常由于上游或下游机制的丧失而沉默[21],本研究中SmacN7作用于乳腺癌细胞MDA-MB-157可通过Ras抑制PI3K/AKT途径从而使上调p53基因转录水平,促进细胞周期停滞和细胞凋亡。
综上,SmacN7主要通过TRAIL介导的死亡受体途径和线粒体介导的内源性凋亡途径抑制乳腺癌细胞MDA-MB-157增殖,诱导其凋亡,对乳腺癌有一定的治疗作用,为临床乳腺癌的治疗提供了实验依据。
