miR-140-3p靶向ANK2基因对子宫肌瘤细胞增殖、迁移和侵袭的影响及其作用机制研究
2020-03-20惠雪莲舒瑾董鹂芸赵娟
惠雪莲,舒瑾,董鹂芸,赵娟
西安市中医医院妇科,陕西 西安 710021
子宫肌瘤是女性生殖器官常见的良性肿瘤,其病因与遗传、激素、子宫本身等多种因素有关[1]。近年来,子宫肌瘤的发病率呈增长趋势[2]。研究表明,子宫肌瘤细胞受到刺激后异常的增殖、迁移和侵袭是其发生发展的主要原因[3],但关于细胞增殖、迁移和侵袭的机制未完全阐明,探究影响子宫肌瘤细胞增殖、迁移和侵袭的分子机制,可为该疾病的治疗提供新途径。微小RNA (microRNA,miRNA) 可在转录本后水平调控靶基因的表达,影响细胞的生长、凋亡、分化等生物学行为,在肿瘤的发生发展中起重要作用[4]。研究显示,miR-140-3p在脊索瘤[5]、非小细胞肺癌[6]、哮喘[7]等多种疾病中异常表达,可作为疾病诊治的靶点及预后判断标志物。目前,miR-140-3p在子宫肌瘤中表达及作用还未知。生物信息学软件预测显示,锚蛋白B (ankyrin-B,ANK2) 的3'非翻译区 (3' untranslated region,3'UTR) 含有与miR-140-3p核苷酸序列结合的位点,提示ANK2 可能是miR-140-3p 的靶基因。ANK2属于细胞骨架蛋白家族成员,参与细胞增殖、运动、活化等多种细胞学行为,其过表达与肝癌[8]、胃癌[9]等肿瘤的发生发展密切相关,但ANK2 对子宫肌瘤细胞生物学行为的影响还未知。本研究主要探讨了miR-140-3p对子宫肌瘤细胞增殖、迁移和侵袭的影响及其是否通过调控ANK2 表达发挥作用,以期为子宫肌瘤的靶向治疗提供新靶点。
1 资料与方法
1.1 一般资料 收集2016 年2 月至2018 年9 月在西安市中医医院病理科证实为子宫肌瘤的59 例手术切除标本为研究对象。患者年龄29~55 岁,平均 (41.58±6.12) 岁;病程3~86 个月,平均 (29.67±5.91) 个月。纳入标准: (1) 病理类型为子宫肌瘤; (2) 手术前未进行治疗。同时收集41 例同时期因子宫肌瘤切除全子宫的正常子宫肌组织作为对照,患者年龄31~53岁,平均 (40.02±6.35) 岁;病程2~84 个月,平均 (29.29±5.83) 个月。手术切除后的宫颈组织置于无RNA 酶的EP 管中,放入液氮罐中保存备用。本研究经本院伦理委员会批准,患者自愿签署知情同意书。
1.2 细胞和实验试剂 胎牛血清 (fetal bovine serum,FBS) 和RPMI 1640 培养基 (美国Gibco 公司) ,胰蛋白酶和四甲基噻唑蓝 (methylthiazoletrazolium,MTT) (美国Sigma公司) ,逆转录试剂盒和PCR试剂盒 (深圳晶美生物工程有限公司) ,Trizol 试剂和LipofectamineTM2000试剂盒 (美国Invitrogen公司) ,PCR引物 (上海生工生物工程有限公司) ,miR-140-3p 模拟物 (mimcs) 及模拟阴性序列 (miR-NC) 、miR-140-3p 抑制剂 (anti-miR-140-3p 组) 及抑制剂阴性序列 (anti-miR-NC) 、ANK2的小干扰RNA (si-ANK2) 及乱序无意义阴性序列 (si-NC) 、ANK2 过表达载体 (pcDNA-ANK2) 及空载体 (pcDNA) (上海吉凯基因公司) ,细胞周期蛋白D1 (CyclinD1) 和P21 单克隆抗体 (武汉博士德生物技术有限公司) ,基质金属蛋白酶2 (matrix metalloproteinase 2,MMP-2) 和E-钙黏附素 (E-cadherin) 多克隆抗体 (美国Abcam 公司) ,二喹啉甲酸 (bicinchoninicacid,BCA) 蛋白检测试剂盒和双荧光素酶活性检测试剂盒 (上海碧云天生物技术有限公司) 。
1.3 实验方法
1.3.1 子宫肌瘤细胞培养 参照文献方法培养子宫肌瘤细胞[10]。在无菌条件下,取约1 cm3子宫肌瘤组织置于培养皿,加入含双抗的磷酸盐缓冲液 (phosphate buffered saline,PBS) ,浸泡3~5 min 后,漂洗3次。剪碎组织,加入适量浓度为0.2%的Ⅰ型胶原酶,37℃消化2~3 h。完全培养基终止消化后,200目滤网过滤,收集滤液。1 000 r/min离心5 min,吸弃上清液,加入含10%FBS的RPMI 1640培养基,置于37℃、CO2体积分数5%、湿度97%的培养箱中培养。根据细胞生长状况,及时更换新鲜培养基。待细胞融合至80%左右时,PBS 清洗细胞,加入0.25%胰蛋白酶溶液消化,进行传代培养。
1.3.2 细胞转染和分组 对数生长期的子宫肌瘤细胞接种于6孔板中,每孔1×105个细胞。待细胞融合至60%时,参照LipofectamineTM2000试剂盒操作说明,分别 将miR-140-3p mimcs (miR-140-3p 组) 、miR-NC (miR-NC 组) 、anti-miR-140-3p (anti-miR-140-3p 组) 、anti-miR-NC (anti-miR-NC 组) 、si-ANK2 (si-ANK2组) 、si-NC (si-NC 组) 以及miR-140-3p mimcs 与pcDNA-ANK (miR-140-3p+pcDNA-ANK2组) 、miR-140-3p mimcs 与pcDNA (miR-140-3p+pcDNA 组) 转染 至 细胞。转染48 h后,实时荧光定量PCR (real-time quantitative PCR,RT-qPCR) 检测miR-140-3p 或蛋白印迹 (Western blot) 检测ANK2 蛋白水平验证转染效果,并收集细胞用于后续实验。
1.3.3 RT-qPCR检测miR-140-3p和ANK2 mRNA表达水平 Trizol 试剂提取组织或细胞中总RNA,微量核酸仪检测RNA的纯度和浓度后,参照逆转录试剂盒书名数,将RNA 逆转录为cDNA。然后以cDNA 为模板进行扩增。扩增条件:95℃5 min,95℃10 s,60℃30 s,72℃30 s,共35 个循环。miR-140-3p 上游5'-ACACTCCAGCTGGGAGGCG-3',下游5'-CTCAA CTGGTGTCGTGGA-3';U6上游5'-CTCGCTTCGGCA GCACA-3',下游5'-AACGCTTCACGAATTTGCGT-3';ANK2 上游5'-GTAAGTCCGTAGTAACC GCG-3',下游5'-CCGACTGTGCCAAGCTGC-3';GAPDH 上 游5'-GCAATGCTGCTAACGT GCAGCT-3',下 游5'-CTGAGTGTCCCGAAACGTGCT-3'。miR-140-3p 以U6为内参,ANK2 以GAPDH 为内参,采用2-△△Ct法计算miR-140-3p和ANK2 mRNA的相对表达水平。
1.3.4 MTT检测细胞增殖 转染后的各组细胞,调整浓度为2.5×104个/mL,每孔200 μL接种于96孔板中。每组设置3个复孔。培养箱中培养48 h后,每孔加入20 μL 的MTT 试剂 (5 g/L) ,培养箱中继续孵育4 h。小心吸弃培养基,每孔加入150 μL二甲基亚砜,轻轻振荡混匀,酶标仪490 nm 处测定吸光度值 (absorbance,A) 。以未转染的细胞作为对照组,计算各组细胞存活率。细胞存活率 (%) =A实验组/A对照组×100%。
1.3.5 Transwell 检测细胞迁移和侵袭 转染后的各组细胞,调整浓度为5×104个/mL。细胞迁移实验:Transwell 上室加入100 μL 细胞悬液,下室加入500 μL含FBS 的RPMI 1640培养基。培养48 h 后,用4%多聚甲醛固定30 min,结晶紫染色15 min,倒置显微镜观察,随机选取5 个视野,计数。细胞侵袭实验:将Matrigel 基质胶用RPMI 1640 培养基以1:8 比例稀释,并铺于Transwell 上室,自然晾干后100 μL 细胞悬液,后续操作同细胞迁移实验。
1.3.6 Western blot 法 检 测 细 胞 中ANK2、CyclinD1、p21、MMP-2 和E-cadherin 蛋白水平 转染后的各组细胞,培养48 h后,收集细胞,PBS清洗两次。加入含蛋白酶抑制剂的蛋白裂解液,提取细胞中总蛋白,BCA法对蛋白进行定量。取适量蛋白溶液于沸水中煮沸5 min使其变性。然后以每孔30 μg蛋白行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳。电泳后,湿转至聚偏乙烯二氟膜。转膜后,置于5%脱脂牛奶中封闭2 h。分别加入稀释后的ANK2 (1:800) 、CyclinD1 (1:400) 、p21 (1:400) 、MMP-2 (1:600) 和E-cadherin (1:800) 抗体,4℃孵育过夜。加入辣根过氧化酶标记的二抗IgG (1:200) ,室温孵育1 h。加入化学发光试剂ELC,避光显影,凝胶成像系统曝光拍照。Image J 软件分析蛋白条带灰度值,以GAPDH 为内参,目的蛋白与GAPDH 条带灰度值的比值表示目的蛋白相对表达水平。
1.3.7 双荧光素酶报告基因实验验证miR-140-3p与ANK2调控关系 生物信息学软件预测显示,ANK2的3'UTR与miR-140-3p的核苷酸序列存在连续的结合位点。采用PCR技术扩增含miR-140-3p结合位点的ANK2 的3'UTR 序列,并将其插入荧光素酶报告质粒psi CHECK-2 载体中,构建ANK2 野生型质粒 (WT-ANK2) 。通过基因定点突变技术将结合位点突变后,插入psi CHECK-2 载体,构建ANK2 突变型质粒 (MUT-ANK2) 。分别将WT-ANK2、MUT-ANK2 与miR-140-3p mimic、miR-NC 共转染至子宫肌瘤细胞。转染12 h 后,吸弃培养基,更换新鲜培养基。培养箱中继续培养至48 h,0.25%胰蛋白酶消化,收集细胞,检测荧光素酶活性,具体操作参照双荧光素酶活性检测试剂盒说明书,结果以荧光虫活性/海肾荧光强度比值表示各组的荧光素酶活性。
1.4 统计学方法 应用SPSS22.0 软件对实验数据进行分析,计量资料以均数±标准差表示,两组间比较采用独立样本t 检验,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q 检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 子宫肌瘤组织中miR-140-3p 和ANK2 mRNA表达水平 与正常子宫肌组织比较,子宫肌瘤组织中miR-140-3p 水平降低,ANK2 mRNA 水平升高,差异均具有统计学意义 (P<0.05) ,见表1。

?
2.2 过表达miR-140-3p 对子宫肌瘤细胞增殖、迁移和侵袭的影响 与miR-NC 组比较,miR-140-3p组细胞中miR-140-3p 水平升高,差异具有统计学意义 (P<0.05) ,表明miR-140-3p mimics 转染成 功 (P<0.05) ,细胞中miR-140-3p 过表达。与miR-NC 组比较,miR-140-3p 组细胞存活率、迁移和侵袭细胞数降低,CyclinD1 和MMP-2 蛋 白 水 平 降 低,p21 和E-cadherin蛋白水平升高,差异均具有统计学意义 (P<0.05) ,见图1、表2和表3。
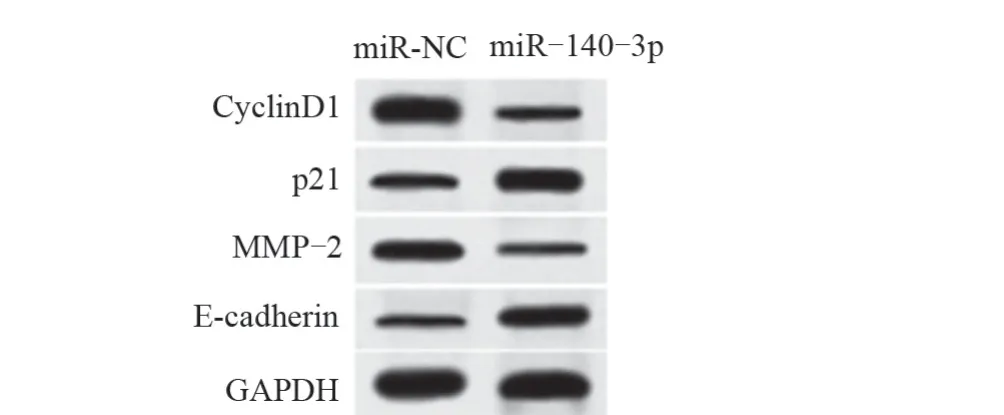
图1 Western blot 法检测过表达miR-140-3p 对子宫肌瘤细胞CyclinD1、p21、MMP-2和E-cadherin蛋白表达的影响
表2 过表达miR-140-3p对子宫肌瘤细胞增殖的影响 (,n=9)

表2 过表达miR-140-3p对子宫肌瘤细胞增殖的影响 (,n=9)
组别miR-NC miR-140-3p t值P值miR-140-3p 1.01±0.09 2.67±0.23 20.163<0.01细胞存活率 (%) 99.63±3.28 62.37±1.59 30.666<0.01 CyclinD1蛋白0.98±0.11 0.23±0.04 19.223<0.01 p21蛋白0.29±0.05 0.82±0.08 16.854<0.01
表3 过表达miR-140-3p对子宫肌瘤细胞迁移和侵袭的影响 (,n=9)

表3 过表达miR-140-3p对子宫肌瘤细胞迁移和侵袭的影响 (,n=9)
组别miR-NC miR-140-3p t值P值迁移细胞数139.25±12.34 72.58±8.19 13.505<0.01侵袭细胞数115.21±10.69 53.91±6.18 14.893<0.01 MMP-2蛋白0.53±0.06 0.19±0.03 15.205<0.01 E-cadherin蛋白0.21±0.05 0.57±0.07 12.555<0.01
2.3 抑制ANK2表达对子宫肌瘤细胞增殖、迁移和侵袭的影响 与si-NC 组比较,si-ANK2 组细胞中ANK2 蛋白水平降低,差异具有统计学意义 (P<0.05) ,表明ANK2小干扰RNA转染成功,细胞中ANK2表达受到抑制。与si-NC 组比较,si-ANK2 组细胞存活率、迁移和侵袭细胞数降低,CyclinD1 和MMP-2 蛋白水平降低,p21 和E-cadherin 蛋白水平升高,差异均具有统计学意义 (P<0.05) ,见图2和表4和表5。
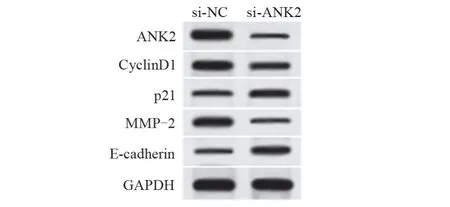
图2 Western blot法检测抑制ANK2表达对子宫肌瘤细胞CyclinD1、p21、MMP-2和E-cadherin蛋白表达的影响
表4 抑制ANK2表达对子宫肌瘤细胞增殖的影响 (,n=9)
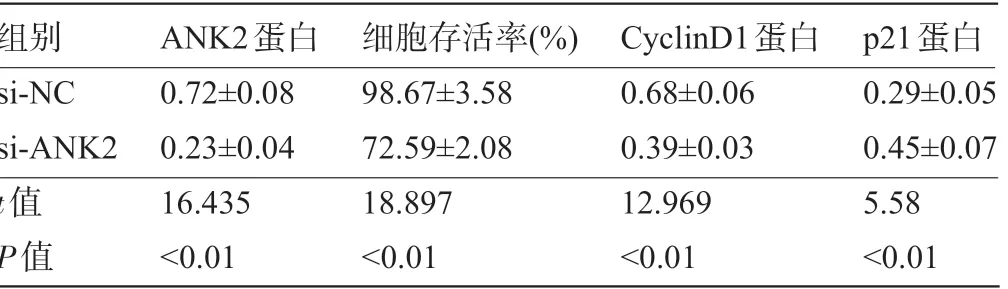
表4 抑制ANK2表达对子宫肌瘤细胞增殖的影响 (,n=9)
组别si-NC si-ANK2值P值ANK2蛋白0.72±0.08 0.23±0.04 16.435<0.01细胞存活率 (%) 98.67±3.58 72.59±2.08 18.897<0.01 CyclinD1蛋白0.68±0.06 0.39±0.03 12.969<0.01 p21蛋白0.29±0.05 0.45±0.07 5.58<0.01
表5 抑制ANK2表达对子宫肌瘤细胞迁移和侵袭的影响,n=9)

表5 抑制ANK2表达对子宫肌瘤细胞迁移和侵袭的影响,n=9)
组别si-NC si-ANK2 t值P值迁移细胞数142.58±12.86 75.69±8.54 12.999<0.01侵袭细胞数123.67±11.24 58.39±6.58 15.036<0.01 MMP-2蛋白0.59±0.04 0.21±0.04 20.153<0.01 E-cadherin蛋白0.19±0.03 0.43±0.05 12.348<0.01
2.4 miR-140-3p 靶向调控ANK2 表达 Target scan 生物信息学软件预测显示,ANK2 的3'UTR 存在与miR-140-3p 结合的核苷酸序列见图3A。双荧光素酶活性检测结果显示,miR-140-3p mimics 可降低WT-ANK2 的 荧 光 素 酶 活 性 (P<0.05) ,而 对MUT-ANK2 荧光素酶活性无显著影响 (P>0.05) ,表明miR-140-3p 可与ANK2 的3'UTR 靶向结合,见表6。miR-140-3p 组ANK2 蛋白 水 平 低于miR-NC 组,anti-miR-140-3p 组ANK2 蛋白水平高于anti-miR-NC组,差异均有统计学意义 (P<0.05) ,说明miR-140-3p在子宫肌瘤细胞中靶向负调控ANK2 表达见图3B和表7。
表6 双荧光素酶活性检测结果 (,n=9)
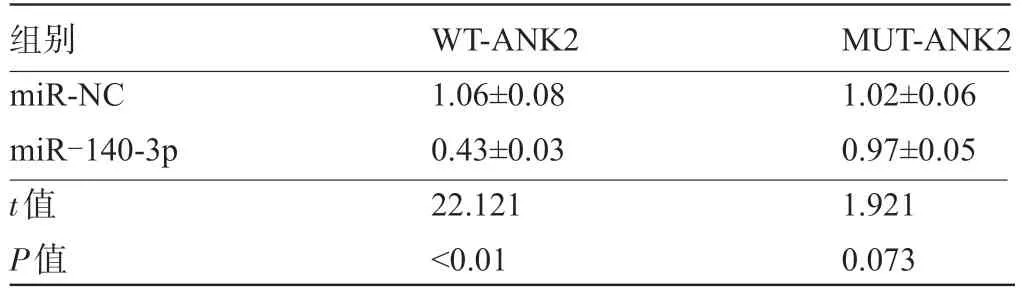
表6 双荧光素酶活性检测结果 (,n=9)
组别miR-NC miR-140-3p t值P值WT-ANK2 1.06±0.08 0.43±0.03 22.121<0.01 MUT-ANK2 1.02±0.06 0.97±0.05 1.921 0.073

图3 miR-140-3p靶向调控ANK2表达

注:与miR-NC组比较,aP<0.05;与anti-miR-NC组比较,bP<0.05。
2.5 过表达ANK2 逆转过表达miR-140-3p 对子宫肌瘤细胞增殖、迁移和侵袭的影响 与miR-140-3+pcDNA组比较,miR-140-3p+pcDNA-ANK2组细胞存活率、迁移和侵袭细胞数升高,CyclinD1和MMP-2蛋白水平升高,p21 和E-cadherin 蛋白水平降低,差异均具有统计学意义 (P<0.05) ,见图4、表8和表9。

图4 Western blot检测过表达ANK2逆转miR-140-3p对子宫肌瘤细胞CyclinD1、p21、MMP-2和E-cadherin蛋白表达的影响
表8 过表达ANK2逆转过表达miR-140-3p对子宫肌瘤细胞增殖的影响 (,n=9)
组别miR-140-3p+pcDNA miR-140-3p+pcDNA-ANK2 t值P值ANK2蛋白0.15±0.02 0.58±0.06 20.397<0.01细胞存活率 (%) 61.23±1.41 87.39±3.02 23.547<0.01 CyclinD1蛋白0.21±0.04 0.58±0.05 17.355<0.01 p21蛋白0.53±0.06 0.25±0.04 11.649<0.01
表9 过表达ANK2逆转过表达miR-140-3p对子宫肌瘤细胞迁移和侵袭的影响 (,n=9)
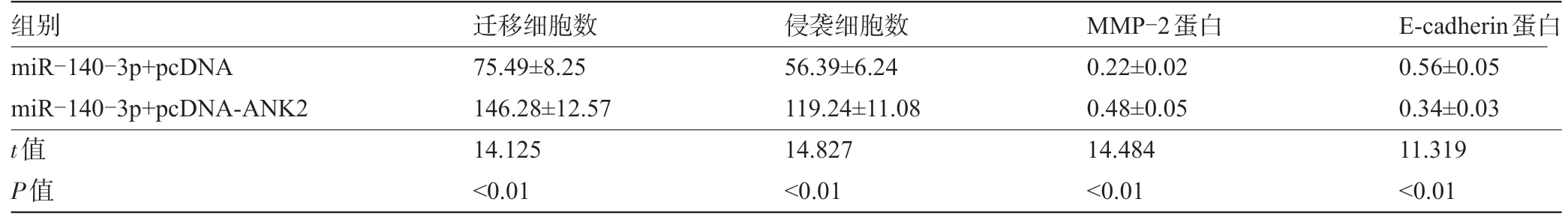
表9 过表达ANK2逆转过表达miR-140-3p对子宫肌瘤细胞迁移和侵袭的影响 (,n=9)
组别miR-140-3p+pcDNA miR-140-3p+pcDNA-ANK2 t值P值迁移细胞数75.49±8.25 146.28±12.57 14.125<0.01侵袭细胞数56.39±6.24 119.24±11.08 14.827<0.01 MMP-2蛋白0.22±0.02 0.48±0.05 14.484<0.01 E-cadherin蛋白0.56±0.05 0.34±0.03 11.319<0.01
3 讨论
miRNA 是一类小分子单链非编码RNA,长度为18~25 个核苷酸,其通过与靶基因mRNA 的3'UTR 结合,抑制靶mRNA 翻译或降解靶mRNA,进而调控靶基因的表达,参与肿瘤的发生发展。miR-140-3p是近年来新发现的一种miRNA,其在多种肿瘤中表达降低,发挥抗肿瘤作用。如DONG 等[11]研究显示,miR-140-3p过表达可抑制非小细胞肺癌细胞的生长、迁移和侵袭,并诱导细胞凋亡。SUN 等[12]研究显示,miR-140-3p 在乳腺癌细胞中表达降低,过表达miR-140-3p 抑制了乳腺癌细胞的增殖,促进细胞凋亡。目前,miR-140-3p 对子宫肌瘤细胞增殖、迁移和侵袭的影响还未知。
本研究显示,miR-140-3p在子宫肌瘤组织中表达降低,提示miR-140-3p 可能参与子宫肌瘤的发生发展。过表达miR-140-3p 后,子宫肌瘤细胞存活率及迁移和侵袭细胞数降低,提示miR-140-3p 过表达可抑制子宫肌瘤细胞增殖、迁移和侵袭。CyclinD1是细胞周期调控蛋白之一,可促进细胞由G1期向S 期转变,加速细胞增殖[13]。p21是肿瘤抑制因子,其表达增加可抑制细胞增殖。本研究显示,miR-140-3p过表达可降低子宫肌瘤细胞中CyclinD1 蛋白水平,提高p21蛋白水平,提示过表达miR-140-3p 通过调控CyclinD1和p21蛋白表达抑制子宫肌瘤细胞增殖。基质金属蛋白酶参与降解细胞外基质和基底膜,促进细胞迁移和侵袭。E-cadherin 是钙黏附蛋白家族成员,其表达下调或丧失可导致细胞间黏附降低,易于脱落,进而迁移和侵袭[14]。本研究显示,miR-140-3p过表达可降低子宫肌瘤细胞中MMP-2蛋白水平,提高E-cadherin 蛋白水平,提示过表达miR-140-3p 通过调控MMP-2 和E-cadherin 蛋白表达抑制子宫肌瘤细胞迁移和侵袭。
为了进一步探讨过表达miR-140-3p 抑制子宫肌瘤细胞增殖、迁移和侵袭的分子机制,本研究通过生物信息学软件预测显示,ANK2可能是miR-140-3p的靶基因,并通过双荧光素酶报告基因实验证实了miR-140-3p 在子宫肌瘤细胞中靶向负调控ANK2 表达。ANK2是锚蛋白家族成员之一,参与肿瘤发生和发展过程。CHEN等[15]研究显示,胰腺癌中ANK2表达升高,沉默ANK2降低了胰腺肿瘤细胞的增殖、迁移和侵袭能力,ANK2是治疗胰腺癌的潜在靶标。王翠艳等[16]研究显示,沉默ANK2可抑制胃癌细胞SGC-7901增殖和转移,阻滞细胞周期进程。目前,ANK2对子宫肌瘤细胞增殖、迁移和侵袭的影响还未知。
本研究显示,子宫肌瘤组织中ANK2 mRNA水平表达升高,与相关研究结果一致[8],提示ANK2也参与子宫肌瘤的发生发展。通过转染ANK2小干扰RNA至子宫肌瘤细胞,结果显示,抑制ANK2表达可降低子宫肌瘤细胞的增殖、迁移和侵袭能力,说明抑制ANK2表达可降低子宫肌瘤的发展进程,提示ANK2可能是子宫肌瘤治疗的分子靶点。此外,本研究还显示,过表达ANK2 逆转了过表达miR-140-3p 对子宫肌瘤细胞增殖、迁移和侵袭的抑制作用,提示miR-140-3p 通过下调ANK2表达抑制子宫肌瘤细胞的增殖、迁移和侵袭。
综上所述,miR-140-3p在子宫肌瘤组织中表达降低,过表达miR-140-3p 可抑制子宫肌瘤细胞的增殖、迁移和侵袭能力,其作用机制与下调ANK2表达有关,miR-140-3p/ANK2 轴可能为子宫肌瘤的靶向分子治疗提供了潜在靶点。