儿茶酚抑素抑制血管钙化的作用及机制
2020-03-20樊小容谭小青张旭升黄战军蔡博治
樊小容,谭小青,张旭升,黄战军,蔡博治
1.深圳市龙岗区人民医院心血管内科,广东 深圳 518172;
2.汕头大学医学院第一附属医院分子心脏病学实验室,广东 汕头 515041
血管钙化为过量钙盐沉积于血管壁,是主动的、多因素调节的过程[1],多种活性因子参与调控血管钙化的发生发展。血管钙化作为导致临床心血管事件的重要危险因素已成为共识,防治血管钙化显得特别重要,因此,寻求新的活性因子不仅可作为血管钙化机制的重要补充,也为防治血管钙化提供新的策略。儿茶酚抑素 (catestatin,CST) 是由肾上腺嗜铬细胞产生的嗜铬颗粒蛋白A,由21个氨基酸组成的多肽结构,通过抑制交感肾上腺系统儿茶酚胺的释放,可调节心血管系统作用如舒张血管、调节血压及心肌收缩力等[2],然而对血管钙化的影响尚未见国内外学者报道,因此,本实验将探讨CST 对大鼠血管钙化的作用以及可能相关机制。
1 材料与方法
1.1 实验动物和相关试剂来源 SD大鼠24只,雄性,8周龄,购自北京维通利华实验动物技术有限公司。CST购自Tocris生物科技有限公司;维生素D3由Sigma公司生产,尼古丁由Merck公司生产;钙离子测试盒和ALP试剂盒购自南京建成生物工程研究所;MCP-1试剂盒和TNF-α试剂盒购自北京华英生物研究所。
1.2 动物模型的制备与取材 按随机数表法将24 只雄性SD 大鼠分为正常组、钙化组和钙化+CST组,每组8 只。正常组大鼠在造模当天予生理盐水肌注和花生油灌胃处理;钙化组大鼠在实验当天予维生素D3(300 000 U/Kg 在大腿肌肉注射1 次) ,并用尼古丁灌胃 (25 mg/kg,早晚各1次) ;钙化+CST组大鼠在造模后第二天开始用CST 2 nmol/ (kg·d) 腹腔内注射。然后三组大鼠常规饲养4周,麻醉后取材,分离主动脉组织,其中一部分组织多聚甲醛固定后制作蜡块,其余组织锡纸包裹并标记,-80℃储存。低温离心分离血清,-80℃保存。
1.3 Von Kossa染色 取大鼠胸主动脉做石蜡切片,1%硝酸银溶液浸泡,紫外线照射后,5%硫代硫酸钠溶液浸泡,碱性品红染色。
1.4 ALP 活性及钙离子含量测定 将大鼠主动脉组织剪碎并匀浆后,取上清检测,用甲基百里香酚蓝比色法检测钙离子含量,用磷酸苯二钠法检测ALP活性,详细步骤见试剂盒说明书。
1.5 血清单核细胞趋化蛋白-1 (MCP-1) 、肿瘤坏死因子-α (TNF-α) 含量测定 采用放射免疫法检测大鼠血清MCP-1和TNF-α含量,具体步骤详见试剂盒说明书。
1.6 统计学方法 应用Graph Pad Prism 4 统计软件分析数据,计量资料以均数±标准差表示,多组间比较用单因素方差分析,组间两两比较采用q 检验,以P<0.05表示差异有统计学意义。
2 结果
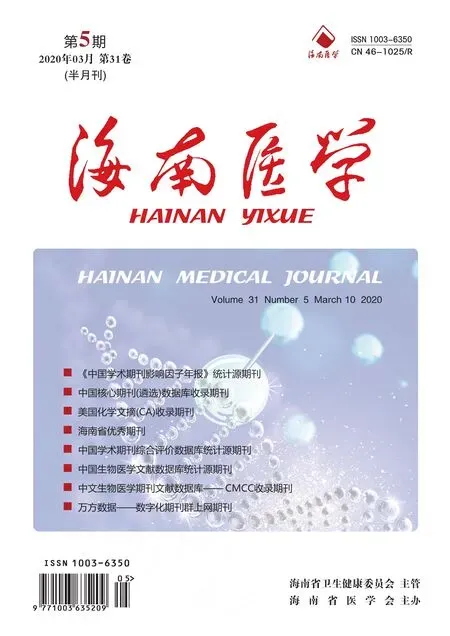
2.1 三组大鼠的血管钙化指标比较 与正常组大鼠比较,钙化组大鼠主动脉中膜可见较多黑色颗粒表达 (Von Kossa 染色) ,提示钙盐沉积明显,用CST 干预后,主动脉组织钙盐沉积明显减少,见图1。与此同时,钙化组大鼠主动脉组织的钙离子含量及ALP活性明显升高,与正常组比较差异均有统计学意义 (P<0.05) ;经CST干预后,钙化+CST组大鼠的钙离子含量及ALP活性较钙化组明显减轻,与钙化组大鼠比较差异均有统计学意义 (P<0.05) ,见表1。
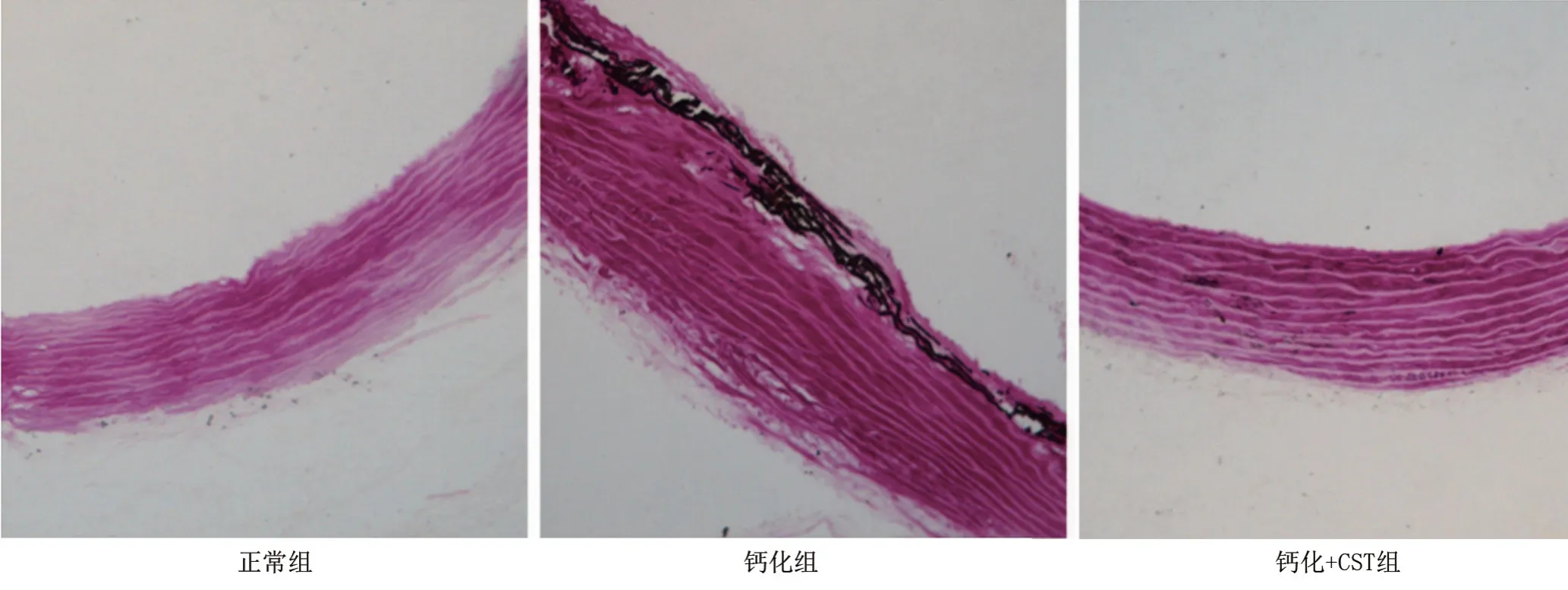
图1 大鼠主动脉Von Kossa染色,黑色颗粒为钙盐沉积 (×100)
表1 三组大鼠主动脉组织钙含量与ALP活性比较
表1 三组大鼠主动脉组织钙含量与ALP活性比较
注:与正常组比较,aP<0.05;与钙化组比较,bP<0.05。
组别正常组钙化组钙化+CST组F值P值只数8 8 8钙含量 (mmol/g蛋白) 0.38±0.13 0.94±0.11a 0.78±0.09ab 108.46<0.05 ALP活性 (U/g蛋白) 112.82±13.52 217.50±14.43a 179.88±12.75ab 217.84<0.05
2.2 三组大鼠血清MCP-1和TNF-α浓度比较 钙化组大鼠血清MCP-1 和TNF-α浓度明显高于正常组大鼠,差异均有统计学意义 (P<0.05) ,经CST 干预后,钙化+CST 组大鼠的血清MCP-1 和TNF-α浓度较钙化组大鼠明显下降,差异均具有统计学意义 (P<0.05) ,见表2。
表2 三组大鼠的血清MCP-1和TNF-α浓度比较
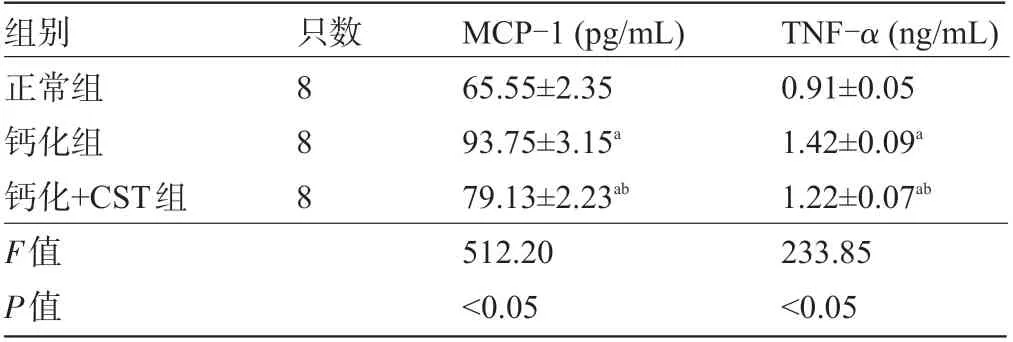
表2 三组大鼠的血清MCP-1和TNF-α浓度比较
注:与正常组比较,aP<0.05;与钙化组比较,bP<0.05。
组别正常组钙化组钙化+CST组F值P值只数8 8 8 MCP-1 (pg/mL) 65.55±2.35 93.75±3.15a 79.13±2.23ab 512.20<0.05 TNF-α (ng/mL) 0.91±0.05 1.42±0.09a 1.22±0.07ab 233.85<0.05
3 讨论
血管钙化与骨组织的骨化过程类似,细胞表型转化是关键 (由收缩型血管平滑肌细胞转变为成骨细胞型) ,同时合并局部骨相关蛋白和活性因子分泌增多,ALP 活性升高,促进钙盐沉积;促进钙化因子与抑制钙化因子在血管钙化的发展过程中起着至关重要的调节作用。研究已证实,在病理情况下如氧化应激、高血压、高血糖、高脂血症、高尿酸血症以及炎症反应等可导致血管损伤,一些活性因子作为促钙化因子协同促进血管钙化的发展;另一方面,一些活性因子如Ghrelin作为血管钙化抑制因子可保护血管功能,从而减轻血管钙化。其过程可能涉及多条信号通道包括TGF-β/BMPs/Smad 通路和MAPK 通路等[3-6]。本课题组的前期研究发现尿酸、醛固酮、salusin β和部分炎症因子 (IL-6、MCP-1、CRP) 等活性因子的表达促进血管钙化过程[3,7-9]。LARIVIÈRE等[10]也在慢性肾脏病大鼠模型观察到,随着血管平滑肌细胞分化为成骨样细胞,不仅骨信号分子BMP-25 和骨钙素表达增加,IL-6、TNF-α 等炎症因子的表达也同步明显增加。其他文献也证实单核/巨噬细胞分泌的TNF-α、IL-6等炎症因子可诱导血管平滑肌细胞向成骨样表型转化,导致血管钙化的发生与发展[11]。以上研究均表明炎症因子在血管钙化的发生与发展过程中起着关键的作用。除此,近来研究证实内质网应激和自噬的交互作用可影响血管钙化的发展,实验发现用内质网应激激动剂衣霉素和自噬抑制剂3-甲基腺嘌呤干预,血管钙化程度均有加重[12]。而另外一些研究表明抑制钙化因子在血管钙化中同样起着重要作用:胎球蛋白A及焦磷酸盐可通过抑制磷酸钙的形成和沉积来抑制血管钙化[13]。APE1/Ref-1可通过氧化还原来抑制成骨细胞分化和减少氧化应激,对磷酸盐诱导的血管钙化起抑制作用[14]。
CST是一种新的内源性多肽,在心血管疾病中的作用日益受到关注。临床研究表明CST不仅可作为原发性高血压、心力衰竭患者的血清标志物,而且在急性冠脉综合征患者中还可预测病情的严重程度[15-17]。最新的研究表明CST 可通过抑制炎症反应从而发挥血管保护作用。在糖尿病、结肠炎和动脉粥样硬化小鼠模型中,CST可减少免疫细胞在受累组织中的浸润,体内外实验均证实其能将巨噬细胞的分化从促炎表型转化为抗炎表型,从而有效发挥抑制炎症作用[18]。在一项对冠心病患者血清CST 浓度与动脉粥样硬化程度的相关性的研究中,与健康受试者相比,冠心病患者中血清CST浓度明显降低,且与疾病严重程度呈负相关[19]。对于CST作用的信号传导通路也有进一步的研究证实,EISSA 等[20]在溃疡性结肠炎患者发现CST 的蛋白和mRNA表达水平明显下降,应用CST治疗可以使IL-8表达下调,用STAT-3 阻断剂可以阻断CST 的治疗效应,从而推测CST 可能通过STAT-3 依赖途径而发挥调节炎症反应的作用;国内学者在间歇低氧高血压大鼠实验中发现,CST可以减轻间歇低氧导致大鼠高血压的效应,并且可使主动脉组织胞浆中核因子E2相关因子2 (Nrf2) 蛋白表达显著下调,而胞核中Nrf2 蛋白表达明显上调,推测CST 可能与通过Nrf2-ARE 信号通路作用有关[21]。
本研究结果显示,应用维生素D3联合尼古丁成功诱导血管钙化动物模型,观察到大鼠主动脉钙盐明显沉积,主动脉组织中钙含量增加,ALP 活性上调。各试验组中炎症指标 (MCP-1、TNF-α) 明显高于正常组,与国内外学者实验结果一致,再次证实炎症因子与血管钙化密切相关。经CST干预后,血管钙化的程度明显改善,且大鼠血清炎症因子MCP-1、TNF-α表达明显低于钙化组,提示CST可能通过抑制炎症因子表达改善血管钙化的程度,从而发挥血管保护作用,但是否通过其他机制作用尚不清楚 (如抑制其他促钙化因子的协同作用) 。
综上所述,儿茶酚抑素能抑制血管钙化的进程,可作为临床防治血管钙化新的作用靶点,然而可能涉及的信号通路需进一步研究证实。