低剂量GnRH激动剂长方案和GnRH拮抗剂方案在卵巢储备功能低下患者中的应用比较
2020-03-19王雪甄璟然孙正怡邓成艳周远征王含必肖亚玲郁琦
王雪,甄璟然,孙正怡,邓成艳,周远征,王含必,肖亚玲,郁琦
(中国医学科学院 北京协和医学院 北京协和医院妇科内分泌与生殖中心,北京 100730)
卵巢储备功能是指卵巢内存留的卵泡数量和质量,是衡量女性生育潜能的重要标志。卵巢储备功能低下(DOR)是指卵巢内可募集的卵泡数量减少,卵母细胞质量下降,女性生育能力减弱的状态。有研究发现,近年来DOR的发生率逐年增加[1]。基于美国辅助生殖技术协会(SART)的评估,32%的体外受精(IVF)患者可以诊断为DOR[2]。DOR是影响辅助生殖技术(ART)成功的危险因素,在促排卵过程中可能会出现卵巢反应不良,周期取消率增加和妊娠率下降等,从而给患者造成巨大的心理压力和经济压力。因此,在现有的促排卵方案中如何选择对患者最经济有效的方案就显得尤为重要。目前最常用的促排卵方案包括经典的GnRH激动剂(GnRH-a)长方案和近年来比较推崇的GnRH拮抗剂(GnRH-ant)方案,这两种方案是临床中常用的促排方案,然而传统的GnRH-a长方案容易造成垂体的过度抑制,所以临床上会降低GnRH-a剂量,这样既可以达到垂体脱敏的作用,又可以减轻对垂体的抑制程度。因此,本研究试图比较低剂量的GnRH-a长方案和GnRH-ant方案在DOR患者中的应用效果,以期为此类患者选择更合适的促排卵方案提供参考。
资料与方法
一、研究对象
回顾性分析2018年1月至2019年6月在本院辅助生殖中心进行IVF/ICSI治疗的DOR患者资料。纳入标准:基础血清FSH>10 U/L;窦卵泡数(AFC)≤7枚。需要同时满足以上两个条件。排除标准:合并存在内科疾病的患者,如高血压、糖尿病、肝脏疾病、甲状腺功能异常等;存在肿瘤病史的患者;存在夫妻双方染色体异常者;多囊卵巢综合征(PCOS)或卵巢多囊样改变的患者;合并存在子宫腺肌症、子宫肌瘤或内膜息肉等子宫异常者;高泌乳素血症患者。
共238个治疗周期纳入研究。按照促排卵方案的不同分为GnRH-ant方案组(GnRH-ant组,91个周期)和低剂量GnRH-a长方案组(GnRH-a组,147个周期)。各组再根据年龄分为两个亚组,分别是GnRH-ant年轻组(≤35岁)、年长组(>35岁),GnRH-a年轻组(≤35岁)、年长组(>35岁)。
二、研究方法
1.促排卵方案:(1)低剂量GnRH-a长方案(1/4方案):治疗月经周期第2~3天肌肉注射醋酸曲普瑞林0.94 mg(3.75 mg/支,达菲林,益普生,法国),21 d后根据患者年龄、体重指数(BMI)、AFC以及性激素水平等情况给予促排卵药物(FSH,果纳芬,默克雪兰诺,瑞士)。根据卵泡生长情况及时调整Gn用量。(2)GnRH-ant方案:在月经周期第2~3天,使用人重组FSH(果纳芬,默克雪兰诺,瑞士)进行促排卵,起始剂量根据患者年龄、BMI、AFC以及基础性激素水平等情况而定,根据卵泡生长情况及时调整促排药物剂量;当优势卵泡直径≥14 mm、E2≥1 468 pmol/L时,加用GnRH-ant(醋酸西曲瑞克,默克雪兰诺,瑞士),根据患者的具体情况,使用0.25~0.50 mg/d至HCG日。两种方案都是在有3个卵泡直径达到18~20 mm时注射HCG(艾泽,250 μg/支,默克雪兰诺,瑞士)250 μg,36~38 h后经阴道超声引导下取卵。
2.IVF-ET及黄体支持:取卵后根据患者的精液情况进行常规IVF或ICSI。受精后16~18 h观察受精情况,以出现双原核(2PN)为受精标志。受精后第3日,挑选质量最好的两枚胚胎进行移植。如果移植当日因特殊情况不能移植者,将此两枚胚胎冷冻保存后择期移植或冷冻后剩余的所有胚胎继续培养至第5~6日,若有囊胚形成,则按本中心常规进行囊胚玻璃化冷冻[3]。移植日开始进行黄体支持(肌肉注射黄体酮60~80 mg/d或肌肉注射黄体酮40 mg+阴道给药黄体酮凝胶90 mg/d)。
3.妊娠结局判断:取卵后第14日检测血清HCG水平,HCG>5 U/L判断为妊娠阳性;移植后4周行超声检查,超声下可见胎心及胎囊者判断为临床妊娠。
4.评价指标:正常受精率=正常受精数/(获卵数或MⅡ卵母细胞数)×100%;优质胚胎率=优质胚胎数/正常受精数×100%;囊胚形成率=囊胚数/(卵裂数-移植数)×100%;种植率=着床胚胎数/移植胚胎数×100%;临床妊娠率=临床妊娠例数/移植周期数×100%;流产率=流产例数/妊娠周期数×100%;活产率=随访获得活产的总例数/移植周期数×100%。
三、统计学分析
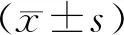
结 果
一、不同促排卵方案两组患者的一般情况比较
GnRH-ant组和GnRH-a组患者的年龄、BMI、不孕年限、不育类型及基础性激素水平比较均无显著性差异(P>0.05)(表1)。
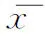
表1 不同促排卵方案两组患者的一般情况比较 (±s)
二、不同促排卵方案两组患者的促排卵情况和临床结局比较
GnRH-ant组应用Gn的总量和时间均显著低于GnRH-a组(P<0.01)。两组患者均未发生卵巢过度刺激综合征(OHSS)。GnRH-ant组和GnRH-a组分别有3例和2例患者因未取到卵而取消周期,但两组间周期取消率无显著差异(P>0.05)。GnRH-ant组获卵数与GnRH-a组相似,两组间受精率、优胚率和囊胚形成率比较均无显著性差异(P>0.05),但GnRH-ant组囊胚形成率略高(33.0% vs. 25.2%,P>0.05)。两组均未发生异位妊娠,两组间种植率、临床妊娠率、流产率及活产率比较均无显著性差异(P>0.05)(表2)。
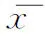
表2 不同促排卵方案两组患者促排卵情况及临床结局比较[(±s),%]
注:与GnRH-ant组比较,*P<0.05;#由于2019年移植的患者还未分娩,所以流产率和活产率只统计2018年患者的数据
三、促排卵方案和年龄对患者促排效果的综合评价比较
两种促排卵方案各年龄亚组(GnRH-ant年轻组、年长组,GnRH-a年轻组、年长组)比较,4组患者间Gn总量、Gn天数、获卵数、受精率和临床妊娠率比较存在统计学差异(P<0.05)。
GnRH-ant组内,年轻组和年长组患者的Gn总量和Gn天数比较均无显著性差异(P>0.05),年轻组获卵数显著高于年长组(P<0.05),受精率、临床妊娠率和活产率略高于年长组,但均无显著性差异(P>0.05)。在GnRH-a组内,年轻组和年长组患者的Gn总量和Gn天数比较均无显著差异(P>0.05),但年轻组获卵数、临床妊娠率显著高于年长组(P<0.05),年轻组的受精率、囊胚形成率、种植率和活产率略高于年长组,尚无显著性差异(P>0.05)(表3)。
跨方案同年龄组比较,GnRH-ant年轻组Gn用量和Gn天数显著低于GnRH-a年轻组(P<0.05),囊胚形成率略高于GnRH-a年轻组,而种植率、临床妊娠率和活产率均略低于GnRH-a年轻组,但均无显著性差异(P>0.05);GnRH-ant年长组的Gn用量和Gn天数显著低于GnRH-a年长组(P<0.05),受精率显著低于GnRH-a年长组(P<0.05),而囊胚形成率和临床妊娠率均高于GnRH-a年长组,但无显著差异(P>0.05)(表3)。
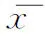
表3 促排卵方案和年龄对DOR患者促排效果的综合比较[(±s),%]
注:各组间总体比较,*P<0.05;与同方案年长组比较,#P<0.05;与GnRH-a年轻组比较,△P<0.05;与GnRH-a年长组比较,†P<0.05;由于2019年移植的患者还未分娩,所以流产率和活产率只统计2018年患者数据
讨 论
DOR与绝经或卵巢早衰不同,此类患者一般尚有规律月经,而其对卵巢刺激的反应或生育力较同龄人下降,至今国内外尚无统一的诊断标准。临床上常利用卵巢储备功能检查来诊断,如基础FSH>10 U/L、双侧AFC<5~7个或抗苗勒管激素(AMH)<1 ng/ml等作为DOR的诊断截点值[4-5]。由于本单位之前尚未开展AMH的测量,因此缺乏相关数据,所以本研究综合文献报道,将同时满足基础FSH>10 U/L和双侧AFC<7个作为本研究的入组标准。
DOR患者通常包括两种情况,一种是高龄患者,即出现年龄相关的卵巢储备功能下降;另一种为年轻患者,通常因手术或疾病导致的卵巢储备下降或不明原因的卵巢储备功能减退[6]。因此,在患者入组时我们未对患者年龄进行限制,但在后面的分析中我们根据年龄进行了亚组分析。
在临床上常采用低剂量GnRH-a长方案和GnRH-ant方案来进行促排卵,然而哪种方案对DOR患者更有利尚无定论[7-10]。本研究发现,GnRH-ant组的获卵数、受精率、优胚率和囊胚形成率与低剂量的GnRH-a组相比没有显著差异,GnRH-ant组的优胚率和囊胚形成率略高于低剂量GnRH-a组。分析原因,可能为卵巢功能差的患者应用GnRH-a方案时对垂体抑制程度更深,Gn用量更多,从而对卵泡的生成有不良作用,而应用GnRH-ant时无GnRH-a的“点火”效应,且可使垂体仍保持其对GnRH的反应性,从而能够改善卵母细胞质量和提高胚胎质量[11-12]。而且国内靳镭等[13]也认为拮抗剂方案不会影响胚胎质量。与既往研究[14]结论相似,本研究发现拮抗剂组的种植率、临床妊娠率和活产率略低,但两组间无统计学差异。当我们以年龄进行亚组分析时,发现年轻患者应用GnRH-ant时的囊胚形成率略高,而种植率、临床妊娠率和活产率略低于低剂量GnRH-a组,但均无统计学差异。这与一些研究[15-16]结论不一致,他们认为GnRH-ant组的种植率、临床妊娠率和活产率显著低于GnRH-a组,分析原因可能为:第一,GnRH-ant组的子宫内膜更薄,不利于胚胎着床;第二,认为GnRH-a可与卵巢及子宫内膜等垂体外组织的GnRH受体结合,并发挥提高妊娠率的作用[17]。此外,还有研究提出两组妊娠结局的差异与卵母细胞质量无关,年轻DOR患者的卵母细胞质量与同龄卵巢储备功能正常者相似,认为尽管年轻DOR患者的获卵数较少,但一旦获卵仍有较高几率获得优质胚胎及较好的临床妊娠率[18];且有研究证实年轻DOR患者胚胎染色体核型出现异常的比例未见增高,认为DOR并不导致患者的胚胎染色体核型异常[19]。而在高龄DOR患者中,GnRH-ant组的囊胚形成率和临床妊娠率略高于GnRH-a组,这与一些研究[16,20]结论一致,认为GnRH-ant组也能达到与GnRH-a组相似的临床妊娠率和活产率。也有相反的结论[9,21],如有研究发现在高龄DOR患者中,GnRH-a方案的临床结局优于GnRH-ant方案[21];有研究认为在40岁以上的高龄DOR患者中,GnRH-a方案的临床妊娠率明显低于GnRH-ant方案,建议高龄DOR人群优先选择GnRH-ant方案[22]。另外,GnRH-ant组的囊胚形成率略高于GnRH-a组,那么也就意味着GnRH-ant组可能有更多的移植机会,从而累积妊娠率可能会升高。但是本研究中我们收集的是2018年的患者,时间比较短暂,尚未统计累积妊娠率,在将来可以考虑计算累积妊娠率。
本研究结果提示GnRH-ant能够达到与低剂量GnRH-a相似的临床结局,且GnRH-ant组Gn量和Gn天数更少。但本研究是一项回顾性分析,样本量偏小,研究结果可能存在一定的偏倚,两者孰优孰劣还有待于后续多中心的大样本量的前瞻性研究加以探讨。
