STAT3在宫颈上皮内病变和宫颈癌中的表达及与高危型HPV感染的关系
2020-03-19李芳张飞燕郭晓丹马振禹刘佳麒贺红梅张伟
李芳 张飞燕 郭晓丹 马振禹 刘佳麒 贺红梅 张伟
宫颈鳞状细胞癌(cervical squamous cell carcinoma,SCC)是全球女性中发病率仅次于乳腺癌的第二大恶性疾病。 宫颈上皮内病变(cervical intraepithelial lesion,SIL),其能够反映宫颈癌病症的发生过程,也是宫颈癌前病变的主要特征。引发宫颈上皮内病变的因素多样,在治疗手段中以消融性治疗与手术切除为主。信号转导与转录调控因子3 (signal transducer and activator of transcription 3,STAT3)为凋亡抑制基因,大量研究表明抑制这种基因的表达或功能可以抑制肿瘤细胞生长,促进肿瘤细胞凋亡[1,2]。STAT作为能够被不同细胞因子激活的蛋白,具有在不同受体中传递信号,充当载体的作用,这其中,又以STAT3为与肿瘤细胞关系最为密切。所以在多种肿瘤细胞中,常可以检测到STAT3的异常表达,如对乳腺癌、淋巴癌、卵巢癌等的检测中[3],都可检查出STST3激活特点。但在宫颈癌癌变过程中并与HPV感染的关系目前尚不明确。本实验采用免疫组织化学方法,检测STAT3在正常宫颈上皮(normal cervical epithelium,NCE)、SIL及SCC中的表达,及与高危型HPV感染的关系,以探讨STAT3在SCC病变发展中的作用,为临床预测宫颈病变的发展提供实验室依据。
1 资料与方法
1.1 一般资料 收集保定市第二医院病理科2014年1月至2016年12月108例患者的存档蜡块,均为手术切除或宫颈活检标本。SIL患者52例,年龄22~67岁,平均年龄(36.50±2.50)岁;其中LSIL 28例(53.85%,28/52),HSIL 24例(46.15%,24/52)。SCC患者有39例(75.00%,39/52);病理分类结果显示均为鳞状细胞癌;组织学分级结果显示,角化型鳞状细胞癌有2例患者(5.13%,2/39),非角化型鳞状细胞癌有37例患者(94.87%,37/39);参考FIGO临床分期(国际妇产科联盟2009年版本)标准进行,结果显示,Ⅰa~Ⅰb期有31例患者(79.49%,31/39),Ⅱa~Ⅱb期有8例患者(20.51%,8/39)。选取子宫肌瘤全子宫切除后的NCE 17例(NCE组)作为对照,年龄21~68岁,平均年龄(36.40±2.62)岁。所有研究对象经病理检查确诊。同时108例患者在采集组织标本前,均使用专用 HPV 标本采样刷采集宫颈脱落细胞。
1.2 纳入与排除标准
1.2.1 纳入标准:本次研究工作中,所取标本均属于临床医院实验室诊断、临床医院影像学诊断、临床病理组织学作确诊;且近三个月内均无进行HPV相关治疗;患者均签署知情同意书,均配合完成本次研究工作。
1.2.2 排除标准:本次研究工作中,所得标本均排除已实施宫颈手术患者;已排除合并糖尿病患者;已排除合并其他部位恶性肿瘤疾病患者;已排除合并自身免疫功能缺陷症患者。
1.3 STAT3蛋白表达的检测 采用MAXVisionTM快捷免疫组化法,鼠抗人STAT3单克隆抗体(福州迈新生物试剂有限公司)检测。以PBS液代替一抗为阴性对照。STAT3蛋白表达检测中,以细胞浆颜色表达为检测结果的主要依据,也可根据细胞核颜色表达为辅助的参考依据,阳性结果应表示为棕褐色。染色结果的判定应用半定量方法,每张切片观察10个400倍视野,阳性细胞数<5%为0分、5%~25%为1分、26%~50%为2分、>50%为3分;细胞核或细胞浆无色判定为0分、浅黄色判定为1分、棕黄色判定为2分、棕褐色判定为3分。上述2个分值的乘积≥1为阳性,<1为阴性。
1.4 HPV检测 应用HPV检测试剂盒(安必平公司),采用反向斑点杂交法,针对15种高危型人乳头瘤病毒(HR-HPV:16、18、31、33、35、39、45、51、52、56、58、59、68、73、82)进行检测[4]。在实施操作过程中,操作者严格依照试剂盒说明书进行,若检测结果显示,任何一种高危型HPV-DNA阳性,则可判断为HPV阳性(+),若高危险型HPV与低危型HPV均为阳性(+)时,则可判断为高危HPV感染。
1.5 统计学分析 应用SPSS 17.0统计软件,计数资料采用χ2检验,采用有序分组资料的线性趋势检验作相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 STAT3在3组的表达 STAT3蛋白阳性产物为胞浆内有棕黄色颗粒。STAT3蛋白在NCE、SIL及SCC组织中的阳性表达率分别为29.41%、57.69%、89.74%,均呈逐渐增高趋势,SCC和SIL组阳性表达率明显高于NCE组(P<0.05),SCC组的阳性表达率也高于SIL组(P<0.05)。STAT3在SIL中的阳性表达率也随SIL级别的升高而增高,HSIL组中STAT3蛋白的阳性表达率均高于LSIL组(P<0.05)。提示在子宫颈鳞状上皮癌变过程中,STAT3的表达呈逐渐增高的趋势。见表1、2,图1、2。

表1 NCE组、SIL组、ICC组中STAT3阳性表达率 例

表2 LSIL、HSIL中STAT3、HPV的阳性表达情况 例(%)
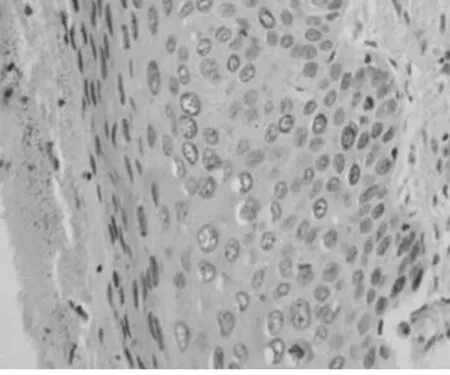
图1 STAT3在 SIL中的阳性表达(×400)
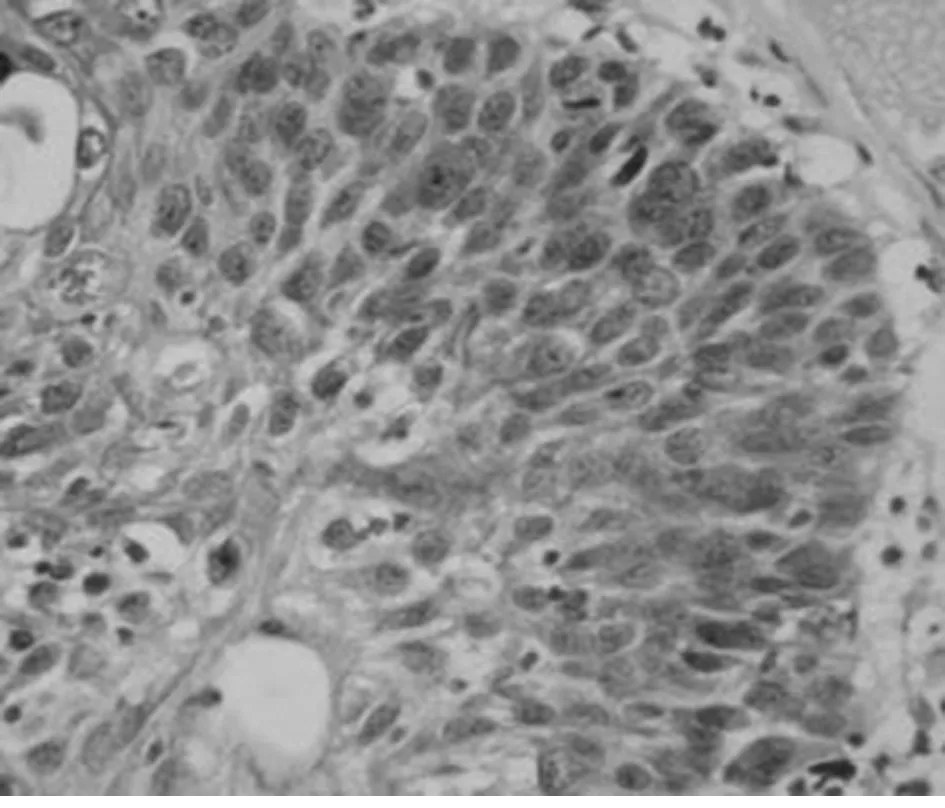
图2 STAT3在ICC中的阳性表达(×400)
2.2 HPV感染率 NCE组、CIN 组及ICC组中高危型HPV的感染率分别为29.41%、76.92%和97.44%,SCC和SIL组阳性表达率明显高于NCE组(P<0.05),SCC组的阳性表达率也高于SIL组(P<0.05)。HPV在SIL中的阳性表达率也随SIL级别的升高而增高,HSIL组中HPV的阳性表达率均高于LSIL组(P<0.05)。提示在子宫颈鳞状上皮癌变过程中,HPV的表达呈逐渐增高的趋势。见表2、3,图3。

表3 NCE、SIL、ICC中高危型HPV阳性表达率 例

A:HPV阴性;B:高危型56阳性;C:高危型16阳性
2.3 STAT3表达与高危型HPV 感染的相关性分析 相关分析证实,STAT3的过表达与高危型HPV感染存在相关性(χ2=6.123,P<0.05)。见表4。

表4 STAT3 表达与高危型HPV 感染的相关性分析 例
3 讨论
随着妇科疾病的发生率逐渐增高,妇科疾病受到的关注也越来越高,也产生了更多不同的临床治疗手段与治疗措施,给予女性患者更好的临床治疗方案。宫颈癌是妇科疾病中较为常见的一类病症,且其发病率最高,所以临床上对于宫颈癌的治疗也不断更新治疗方式,改善化疗等手段,以求提高治疗效率,减少对患者的损伤。作为恶性肿瘤性引发的疾病,在生存率上较低,但随着医疗技术手段的提升,近些年来,宫颈癌的远期生存率也在良好提升。医学研究中对宫颈癌的研究也在不断增多,以肿瘤标志物的探索与研究,给宫颈癌的早期诊断与治疗提供了更好的参考依据,并为宫颈癌的远期生存率提升提供了更好的支持。宫颈癌的发生、发展与多种致癌因子有关,高危型HPV感染与宫颈癌有着非常密切的关系,95%~100%的宫颈癌的发生与高危型HPV 感染相关[5],但仅仅感染HPV病毒并不一定发生宫颈癌。目前临床普遍认为,发生宫颈癌的高危因素为HPV病毒感染,而持续性生殖道感染HPV病毒感染则容易发生宫颈病变。相关研究数据表明,HPV病毒感染具有较显著地域差异性,亚洲人群HPV病毒感染类型主要包括HPV16型病毒感染、HPV18型病毒感染、HPV31型病毒感染[6]。随着患者宫颈病变逐步加重,患者HPV病毒感染阳性率也随之升高,即提示,HPV病毒感染与人体宫颈病变的关系密切。而且,宫颈癌的发生以及发展均属于临床病理逐渐改变过程,自CIN早期炎性浸润逐渐发展为癌症,是属于“量变到质变”过程,从HPV病毒感染逐渐进展为宫颈癌的时间约为10~20年。故此,对HPV病毒感染情况、HPV病毒感染分析进行尽早诊断,从而有效预防宫颈癌的发生。STAT3是STAT家族中与肿瘤关系最为密切的蛋白,其基因定位于第12号染色体(q13~q14-1)。STAT3蛋白可能参与多种肿瘤的形成和发展。Yang等[7]发现和正常宫颈上皮组织LSIL相比,HSIL和宫颈鳞癌组织中细胞核内STAT3的表达增高,且STAT3与Ki67在SIL中的表达呈相关关系,但与SIL的级别无关,提示STAT3在宫颈病变的发展过程中,起到了一定的作用。
HPV病毒感染并非宫颈癌疾病发生的唯一危险因素,除了HPV病毒感染,宫颈癌疾病发生与机体免疫水平、机体炎性反应、关细胞信号通路激活等具有一定相关性。信号传导及转录激活因子为细胞质转录因子类型,该物质可以与细胞核内DNA相关结合,以及参与至靶基因调控,进而起到介导一系列病理生理活动,这其中又包括肿瘤细胞的增值、转移与肿瘤细胞凋亡等。因此,信号传导及转录激活因子可以作为恶性肿瘤发生的重要调控因子以及病情进展重要调控因子。临床相关研究结果发现,信号传导及转录激活因子与胃癌复发、胃癌转移的关系密切,通过促使STAT3蛋白信号转导通路受阻,从而有效减少患者机体耐药性,提高其临床治疗效果。此外,临床相关研究结果发现,多种恶性肿瘤疾病发作、发展均与STAT3基因存有一定相关性[8]。
信号转导和转录激活因3(STAT3)是于1993年对γ-干扰素诱导细胞基因表达研究中,首次发现的重要信号分子。STAT3作为信号蛋白,其能够起到传递信号的作用,将细胞外的信号传递于细胞内,并诱导转录形成基因表达作用。在STAT3蛋白中,其本身具有基因编码作用,氨基酸组成结构与序列完整,具有多个功能区域,能够在传递信号的过程中受其他因素的影响所激活,并发挥作用。一般来说,在不同的细胞结构中,STAT3的作用不同,其具有促进细胞增值的作用,与具有促进表皮细胞小管生长的作用,或能够在巨噬细胞中发挥抗炎作用等等,于不同的细胞中诱导不同的基因组产生[9]。STAT3在肿瘤细胞中的作用具有特殊性,许多的肿瘤细胞株需要STAT3保持其转变后的表现形式,这也侧面暗示了STAT3可以作为肿瘤细胞的癌基因存在,其通过与肿瘤细胞的密切联系,受到了肿瘤细胞的激化,同时也促进了肿瘤细胞增值。
STAT3受到肿瘤细胞的作用激活后,能够进一步促进肿瘤细胞的增值,加强STAT3的表达,属于正向反馈作用,其通过增强抗凋亡细胞的表达来抑制细胞凋亡,使得细胞生长与凋亡失衡,且同时还增强细胞周期蛋白表达,使得细胞异常增殖与生长,更造成细胞生长机制的失衡。在促进肿瘤细胞生长上,STAT3还通过激活表达的方式,为肿瘤细胞侵袭提供支持,例如以分泌趋化因子的方式,使得肿瘤细胞不受免疫调节与抵抗,造成肿瘤细胞增值与扩散。实际上,STAT3为肿瘤细胞提供了很好的生存环境,其通过各种方式促进肿瘤细胞增值,减少肿瘤细胞受机体内部调节影响,造成肿瘤细胞癌变的抑制效果减弱,使得癌变更加快速。临床研究中显示,人类多种肿瘤疾病中,如肺癌疾病、乳腺癌疾病、卵巢癌疾病、头颈部鳞状细胞癌疾病、多发性骨髓瘤疾病、白血病等均可检测存在STAT表达[10,11]。STAT3作为信号蛋白,其多与肿瘤细胞形成信号通路,特别是在恶性肿瘤中能够呈现出高表达状态,临床上以检测STAT3对肿瘤病情发生情况进行验证具有实际效果。更重要的是,STAT3能够在肿瘤病变过程中形成促进效果,使得病情发展加快,恶化病情,其通过抑制细胞凋亡,促进细胞异常增殖的方式,造成肿瘤细胞的增值与转移[12,13]。以对比分析的方式对STAT3的表达情况进行分析,在100份食管鳞状上皮细胞癌组织的免疫分析中,STAT3的表达率高达73%,而在100份正常食管上皮组织的免疫分析中,皆无 STAT3表达,表达率为0,这都能够说明STAT3可以作用检测肿瘤细胞的指标。STAT3的表达与淋巴结转移、 TNM 分期呈负相关。相关临床研究运用免疫组化方法进行研究56例CIN患者病变组织中STAT3和Ki-67蛋白表达,研究结果可知,p-STAT3染色重点处于核内,且CINⅢ组织阳性表达率、CINⅠ/Ⅱ中阳性表达率分别为76.92%,13.33%,将2组数据比较,存有差异有临床统计学意义(P<0.001)[14]。提示,CIN分级、细胞增殖均与p-SA-TA3异常表达存有一定有关性,可以作为CC预后的评价新指标。本研究结果显示,SC组中STAT3的阳性表达率高于NCE组和SIL组,提示STAT3蛋白异常表达在宫颈病变发生与进展中发挥重要作用。
宫颈癌的发生与宫颈上皮细胞的失衡有直接关系,这其中表现为细胞生长与凋亡的失衡,正常的细胞凋亡被抑制,且细胞增殖出现无限制性异常增殖情况,也间接造成了癌细胞的产生,进而引发宫颈癌[15,16]。而抑制细胞凋亡的因素多样,STAT3的激活是主要因素之一[17,18]。本次研究结果表明,随着宫颈病变的进展,宫颈鳞状细胞癌组的STAT3表达最为强烈,且根据研究结果显示,STAT3在过度激活的的状态下如进入宫颈癌变期,能够呈现出高表达状态,所以通过对STAT3的检测也能够反映宫颈癌病情发展情况。另外本研究证实,STAT3 的过表达与高危型HPV 感染存在相关性,而且关系较密切,提示高危型HPV 的持续感染可能激活STAT3,增加 STAT3 在宫颈组织中的表达,研究表明 STAT3 在 HPV 介导的宫颈癌发生过程中起重要作用从而影响宫颈癌的发生发展[19,20]。
综上所述,结合STAT3的表达特点,临床结合宫颈上皮内病变、宫颈癌以及高危型HPV感染的疾病特点,在宫颈上皮内病变(SIL)和宫颈鳞状细胞癌(SCC)发生与发展中均具有重要作用,可以作为宫颈鳞状细胞癌(SCC)患者预后不良的客观判断指标,以及临床科学性、个体化及指导治疗依据。
