阿替普酶对脑梗死大鼠的疗效观察及对血清中GAP-43、NGF、MDA水平的影响
2020-03-19于海燕王东玉闵连秋
于海燕 王东玉 闵连秋
脑梗死发病的主要原因是脑部因血液供应不足,缺血缺氧导致脑组织出现坏死和软化,主要发病是老年人,数据显示,脑梗死患者年龄有年轻化趋势,严重威胁者人们的身体健康[1]。阿替普酶是一种血栓溶解药物,赖氨酸残基与纤维蛋白结合,并激活与纤维蛋白结合的纤溶酶原转变为纤溶酶,在治疗心肌梗死上具有显著效果[2]。血清中生长相关蛋白-43(GAP-43)参与神经发育以及轴突再生,与神经生长因子(NGF)在神经功能中发挥着重要的作用[3,4]。本文主要研究阿替普酶对脑梗死大鼠的疗效观察及对血清中GAP-43、NGF、丙二醛(MDA)水平的影响。
1 材料与方法
1.1 动物 选择SD健康雌性大鼠30只,由锦州医科大学实验动物中心提供。年龄6~10周龄,平均(8.0±1.8)周;体重120~280 g,平均(240.3±120.1)g,饲养温度22~25℃,室内湿度35%~37%,饲养室定时进行紫外线照射消毒。统一喂给标准饲料,允许它们自由活动,饲养时间为1周。
1.2 方法
1.2.1 脑梗死模型建立:选取20只大鼠进行脑梗死模型制备,给予10%的水合氯醛麻醉,把大鼠仰卧固定在实验台上,充分暴露其颈部皮肤,用75%的乙醇消毒后,打开大鼠颈部皮肤,利用分离针分离出颈总动脉、颈内动脉和颈外动脉,在远心端结扎颈外动脉,然后在颈内动脉远心端和颈总动脉近心端,用动脉夹阻断循环血流。将颈外动脉在结扎处剪断,从剪断处插入栓线,直至颈内动脉处,然后打开颈内动脉夹,继续推进栓线,直到遇到阻力,当阻断大脑中动脉血流后,继续将栓线深插入18~20 mm,最后固定栓线并缝合皮肤。2 h后再次10%的水合氯醛麻醉大鼠,把栓线拔出来,缝合伤口,75%乙醇消毒。模型制备完成以后,给予大鼠抗感染感染护理,让其自由摄食和饮水。大鼠苏醒后,左侧表现为Horner征,提尾时右侧前肢内收屈曲,右前爪不能伸展或存在右侧转圈障碍,则建模成功。手术过程中,死亡2只,感染1只,另外还有1只建模失败,建模成功共16只。
1.2.2 分组及用药:将建模成功的16只大鼠随机分为模型组和阿替普酶组,每组8只,正常组大鼠10只。阿替普酶组大鼠静脉注射阿替普酶,5 mg/kg;正常组和模型组大鼠注射等体积的无菌0.9%氯化钠溶液,连续治疗7 d。
1.2.3 脑梗死体积TTC染色:所有大鼠进行抽取股动脉血后,处死。采用0.9%氯化钠溶液对其血液进行冲洗,将脑组织取出后,在-20℃速冻10 min,在冠状位切取三片,每片厚度为2 mm,将组织切片在2%的TTC溶液中进行染色,注意要避光,37℃进行孵育30 min,在这一过程中要对玻片进行翻动,染色均匀,取出后在10%多聚甲醛溶液中进行24 h固定,采用Image-J图像进行数据分析。脑梗死体积=(玻片脑梗死面积/玻片总面积)×100%。
1.2.4 脑组织含水量测定:主要采用干湿法进行。将取出的脑组织在天平上进行称重,之后在110℃的干燥箱干燥完全脱水后,再次进行称重,根据公式脑组织含水量=(湿重-干重)/湿重×100%。
1.2.5 大鼠ZeaLonga评分[5]:无神经缺损,大鼠活动正常,为0分;大鼠对侧前肢不能完全伸展,为1分;大鼠行走不稳,身体出现偏瘫并转圈,为2分;大鼠身体出现偏瘫并发送倾倒,为3分;大鼠不能行走,其意识完全消失,为4分,分数越高,说明大鼠神经损伤越严重。
1.2.6 大鼠脑组织病理学:将采集到的标本在10%的甲醛缓冲液中保持48 h,之后脱水、浸蜡、包埋、切片、脱蜡处理后,采用HE进行染色,在显微镜下观察大鼠脑组织病理学特征。
1.2.7 ELISA法检测GAP-43、NGF、MDA水平:将抽取的大鼠股动脉血在抗凝管中保存,之后使用转速为1 000 r/min的离心机,离心处理20 min,提取血浆,放入洁净的EP试管中,在-20℃环境中保存,待用。采用50 mmol/L碳酸盐包被缓冲液将标本进行溶解,浓度为10~20 μg/ml,在96孔酶标板中加入100 μl/孔,4℃过夜保存。第2天舍弃包被液,采用PBST洗涤3次,没孔中加入1%的150 μl BSA,在37℃环境中封闭1 h。之后采用PBST洗涤3次,在每孔中加入100 μl不同倍比稀释度的血清,加入对照样品,37℃孵育2 h。采用PBST洗涤5次,加入100 μl,稀释后的HRP标记的二抗,37℃孵育1 h。PBST洗涤5次,之后,使用显色剂显色20 min后,在酶标仪上读取A405吸收值。
1.2.8 Western blot检测PTEN、mTOR、PKA蛋白表达:将采集到的标本,使用PBS缓冲液清洗3遍以上,分离缓冲液,加入IP细胞裂解液,进行裂解35 min,提取总蛋白,BCA测定蛋白浓度。取20 μg/孔蛋白质,通过10%的SDS-PAGE凝胶进行电泳,加入适量浓缩的SDS-PAGE蛋白缓冲液15 min;100 V,电泳10 min,结束之后,将电转膜浸泡在10%的牛奶中,在37℃环境下的摇床上封闭1.5 h;与一抗结合,加入TBST稀释按(1∶1 000)稀释一抗Tubulin(内参照),在4℃的环境下孵育过夜保存;第2天用TBST缓冲液清洗,与二抗结合在室温下孵育1 h,再次用TBST缓冲液清洗反复清洗。最后加入显影剂将其仅在底物溶液中进行显色,严格按照显影定影试剂盒操作说明书进行。

2 结果
2.1 3组大鼠脑组织病理学观察 正常组在海马区和皮质未发现梗死,与正常的脑组织结构未发现明显的界线;模型组在皮质发现了较大面积的梗死,并且危及海马区,与正常的脑组织结构存在明显的界线,周围与神经相关的细胞数量急剧减少,出现水肿;细胞核发生固缩并且深染,核仁在逐渐消失,出现炎性细胞浸润,细胞浆液疏松。阿替普酶组脑梗死的面积明显减小,胶质细胞增殖,水肿现象显著改善。见图1。
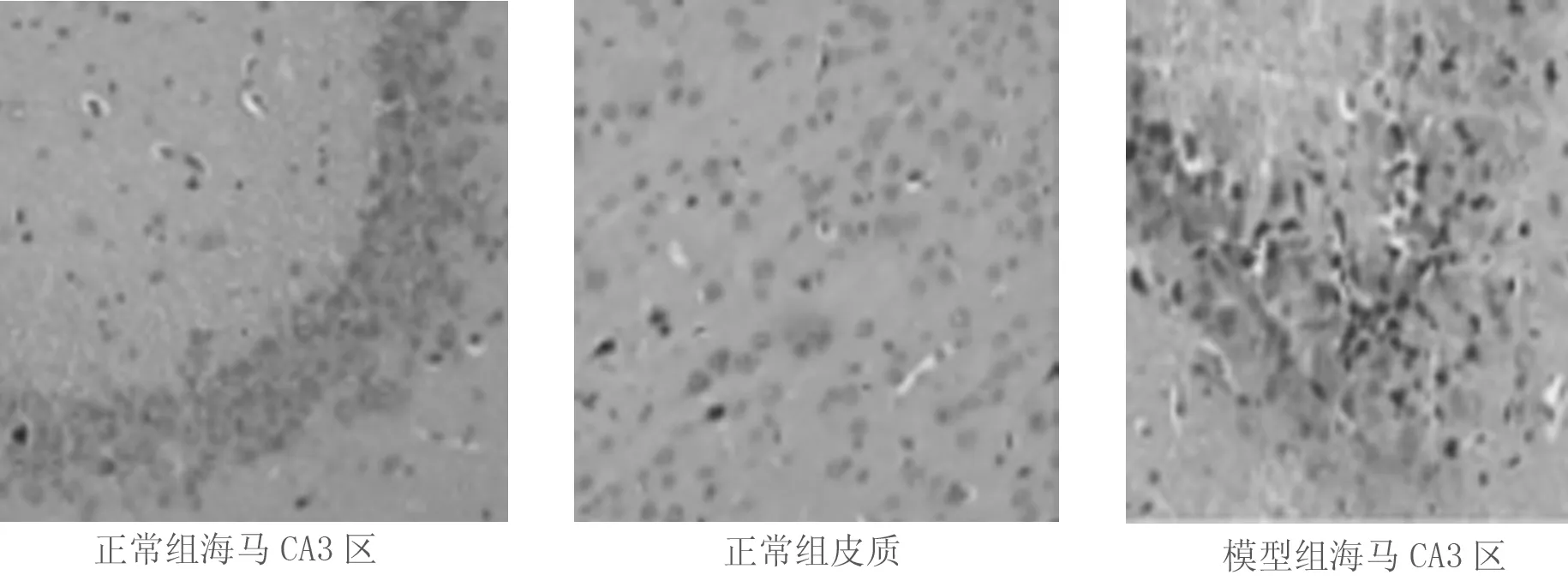

图1 3组大鼠脑组织病理学观察(HE染色×200)
2.2 3组大鼠脑梗死体积、脑组织含水量、ZeaLonga评分比较 3组大鼠脑梗死体积、脑组织含水量、ZeaLonga评分比较,差异有统计学意义(P<0.05)。模型组大鼠脑梗死体积高于正常组(t=27.23,P=0.00),脑组织含水量高于正常组(t=8.19,P=0.00),ZeaLonga评分显著高于正常组(t=9.92,P=0.00),差异有统计学意义(P<0.05);阿替普酶组大鼠脑梗死体积低于模型组脑组织(t=18.50,P=0.00),脑组织含水量低于模型组脑组织(t=5.15,P=0.00),ZeaLonga评分低于模型组(t=2.48,P=0.03),差异有统计学意义(P<0.05)。见表1。

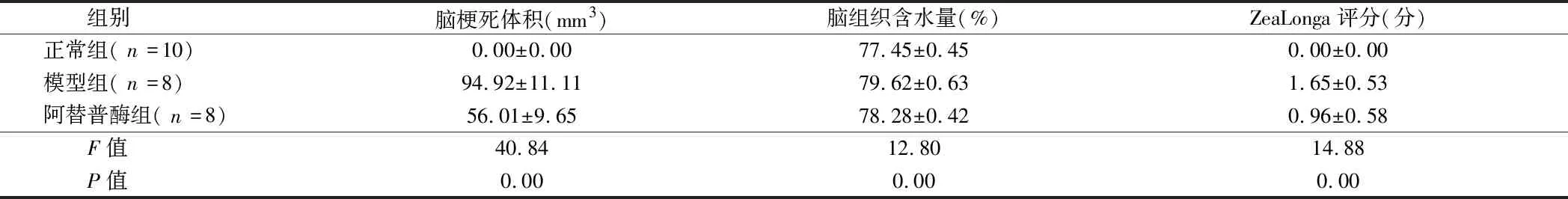
组别脑梗死体积(mm3)脑组织含水量(%)ZeaLonga评分(分)正常组(n=10)0.00±0.0077.45±0.450.00±0.00模型组(n=8)94.92±11.1179.62±0.631.65±0.53阿替普酶组(n=8)56.01±9.6578.28±0.420.96±0.58 F值40.8412.8014.88 P值0.000.000.00
2.3 3组大鼠血清中GAP-43、NGF、MDA水平比较 3组大鼠治疗后血清中GAP-43、NGF、MDA水平比较,差异有统计学意义(P<0.05)。模型组GAP-43水平显著高于正常组(t=3.70,P=0.00),NGF水平显著高于正常组(t=8.34,P=0.00),MDA水平显著高于正常组(t=7.35,P=0.00),差异有统计学意义(P<0.05);阿替普酶组GAP-43水平低于模型组(t=2.24,P=0.04),NGF水平低于模型组(t=4.57,P=0.00),MDA水平低于模型组(t=5.78,P=0.00),差异有统计学意义(P<0.05)。见表2。

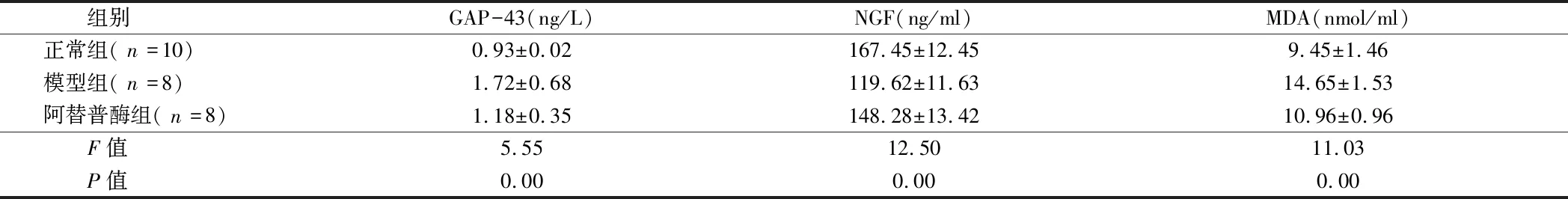
组别GAP-43(ng/L)NGF(ng/ml)MDA(nmol/ml)正常组(n=10)0.93±0.02167.45±12.459.45±1.46模型组(n=8)1.72±0.68119.62±11.6314.65±1.53阿替普酶组(n=8)1.18±0.35148.28±13.4210.96±0.96 F值5.5512.5011.03 P值0.000.000.00
2.4 阿替普酶对脑梗死大鼠作用机制研究 3组大鼠治疗后PTEN、mTOR、PKA表达水平比较,差异有统计学意义(P<0.05)。模型组PTEN表达水平高于正常组(t=7.09,P=0.00),模型组mTOR表达水平高于正常组(t=3.19,P=0.01),模型组PKA表达水平高于正常组(t=5.33,P=0.00),差异有统计学意义(P<0.05);阿替普酶组PTEN表达水平低于模型组(t=3.28,P=0.01),mTOR表达水平低于模型组(t=2.21,P=0.04),PKA表达水平低于模型组(t=3.55,P=0.00),差异有统计学意义(P<0.05)。见表3。


组别PTENmTORPKA正常组(n=10)0.23±0.087.45±2.456.55±2.46模型组(n=8)0.97±0.3212.78±4.5413.66±3.21阿替普酶组(n=8)0.56±0.159.05±2.458.79±2.18 F值10.644.869.60 P值0.000.010.00
3 讨论
脑梗死是一种临床上的常见脑血管疾病,其特点是治疗后高复发率、高死亡率和高致残率,极大降低患者的生活质量。相关数据显示,我国近些年,脑梗死的发病率有明显上升的趋势[6]。正常情况下,脑毛细血管与脑细胞之间存在血脑屏障,血脑屏障可以阻止有害物质进入脑组织,进而保护脑组织不受损伤,减少有害物质的侵害[7]。依靠这种方式,保持着脑组织内环境的稳态,这对于生物的生长生存具有重要的价值。脑梗死病发后,血清中炎性因子表达明显升高,氧自由基增多,蛋白水解酶等大量表达,微血管内皮细胞遭到破坏,血脑屏障的通透性增加,一些有害物质会通过血液循环进入脑组织,而脑组织中的一些物质也可进入血液循环,进而加重疾病,特别是在脑神经元再生过程中,这种现象更加严重,严重影响患者的生命安全[8,9]。
阿替普酶属于第三代新型的一种溶栓药物,其特异性以及在半衰期,阿替普酶的溶栓效果表现良好。研究显示,急性脑梗死发病时会释放大量的炎性应激因子,在患者体内相互拮抗,其水平变化导致了局部的血流障碍[10]。阿替普酶可以有效的减少血液的粘稠度,以及凝固性,对血小板的凝聚具有显著的抑制作用,对血管侧支循环阻力有减轻效果,改善血液的微循环,同时对缺血半暗带细胞功能具有显著的恢复作用[11]。阿替普酶作为一种组织纤溶酶原激活剂,主要经过纤维蛋白溶解酶结合纤维蛋白溶解酶,对纤溶酶原进行激活,形成纤溶酶后起到溶解血块的作用。阿替普酶凝血系统的影响较小,不易出血,因此其溶解血栓能力较强[12,13]。
本文研究结果显示,阿替普酶组大鼠的脑梗死体积、脑组织含水量较少,其ZeaLonga评分较低,趋于正常大鼠,说明阿替普酶治疗脑梗死效果明显,同时可以促进大鼠神经功能恢复。分析原因:阿替普酶对毛细血管中的内皮细胞具有保护作用,保护其细胞的紧密连接的结构功能,可以有效的减轻大鼠脑梗死内皮细胞的肿胀程度,对基膜厚薄有改善作用[14]。GAP-43是一种胞膜磷酸蛋白,与神经发育、轴突再生、突触重建有关,可以调解轴突延伸作用,改变细胞形态,还可以作为细胞内信号,大大增强与G蛋白偶联受体之间的联系[15]。当脑梗死发生时,脑组织损伤部位周围神经元的传入侧支发芽,反应性轴突再生,发生功能代偿性发育,使得GAP-43的表达水平升高[16]。由于血脑屏障遭到破坏,血清中的GAP-43水平也会发生相应的变化。NGF对神经生长和分化具有促进和维持作用。研究显示,脊髓损伤的大鼠,其受伤局部NGF及其受体的水平上升,说明NGF水平升高与神经损伤有一定的相关性[17]。MDA是一种氧化应激反应的标志物,可以根据MDA水平变化了解到机体代偿性变化。MDA是脂质氧化终产物,会加剧细胞膜的受损程度,还可以影响线粒体呼吸链复合物及线粒体内关键酶活性。肌体大量运动时会对组织器官产生震荡效应,使细胞内代谢产物不断积累导致其渗透压升高,由于细胞膜通透性的可逆性变化,胞内代谢酶逸出,导致血清酶活性升高[18]。本研究显示,阿替普酶组大鼠GAP-43、NGF、MDA水平显著降低。说明阿替普酶可以有效的抑制GAP-43、NGF、MDA水平。其可能的作用机制是PTEN是mTOR通路的负相关的调节因子,抑制PTEN下调,有助于激活mTOR通路,对轴突再生有显著的阻碍作用[19,20],GAP-43通过下调PTEN、PKA表达,激活mTOR通路,从而抑制GAP-43、NGF、MDA水平。
综上所述,阿替普酶对脑梗死大鼠的治疗效果显著,有助于促进大鼠神经功能恢复,通过调控PTEN、mTOR、PKA信号通路,对GAP-43、NGF、MDA水平起到抑制作用。
