黄芪多糖通过AMPK/SIRT1/PGC-1α途径对糖尿病肾病肾小管上皮细胞线粒体的影响
2020-03-19徐雪垠
徐雪垠
南通市第一人民医院,江苏南通226000
糖尿病可以诱发多种并发症,其中糖尿病肾病(DN)发病率较高,约有1/3糖尿病患者会合并DN。此外,DN也已成为引起终末期肾病的主要病因之一。目前,对于DN的发病机制尚无定论。研究表明,腺苷酸活化蛋白激酶(AMPK)可以通过沉默调节因子1(SIRT1)/过氧化酶体增殖物激活受体γ共激活因子-1α(PGC-1α)途径调节线粒体代谢,改善肾脏细胞状态及活性,减缓DN发生及发展。黄芪多糖(APS)是中药黄芪的主要成分,研究表明,其可以通过抑制肾小管上皮细胞凋亡及转分化,修复足细胞进而延缓DN发展[1, 2]。但是APS对于DN肾小管上皮细胞中线粒体的作用和机制尚不明确。2018年1月~2019年10月,本研究检测了APS对DN肾小管上皮细胞线粒体功能、细胞凋亡及对SIRT1途径的影响,为治疗DN提供新的治疗靶点以及理论基础。
1 材料与方法
1.1 细胞、试剂与仪器 人近端肾小管上皮细胞(HK-2)购于国家实验细胞资源共享服务平台。黄芪多糖(>68%)(大连美仑生物);抗GAPDH一抗、抗SIRT1一抗、抗PGC-1α一抗、抗AMPK一抗以及抗p-AMPK一抗(Cell Signaling Technology);小鼠及兔二抗(ProteinTech)、选择性SIRT1抑制剂Ex 527、ATP含量测定试剂盒、CCK-8试剂盒以及LDH测定试剂盒(碧云天生物技术公司);ECL发光液(Bio-Rad);Caspase-9活性测定试剂盒(BioVision)。
1.2 细胞培养 HK-2细胞采用低糖RPMI1640培养基培养(含10%胎牛血清),培养条件为37 ℃、5%CO2,每2天换液一次。细胞生长融合到80%左右时,用适量0.25%胰酶进行消化,当显微镜下观察到细胞缩至圆形,加入适量含10%胎牛血清RPMI1640培养基终止消化,并反复轻轻吹打,使贴壁细胞重悬,细胞悬液按照相应比例稀释之后继续培养或进行下一步实验。
1.3 细胞分组及干预方法 将细胞分为对照组、高糖组、APS组、Ex 527组。处理12 h,所有组别更换为无血清RPMI1640培养基,高糖组在1640培养基中加入30 mmol/L葡萄糖(终浓度);APS组在RPMI1640培养基中加入30 mmol/L葡萄糖和200 mg/L APS(终浓度);Ex 527组在RPMI1640培养基中加入30 mmol/L葡萄糖、200 mg/L APS以及10 μmol/L Ex 527(终浓度)。
1.4 检测指标
1.4.1 细胞活性 采用CCK8法测定。将HK-2细胞接种于96孔板中,密度为2×104/孔。5%CO2、37 ℃培养24 h后,更换培养基为不含胎牛血清的低糖RPMI1640培养基;继续培养12 h后,按照不同实验要求用药物进行刺激。刺激结束后,每孔加入10 μL CCK8溶液;孵育1 h后,测定450 nm处吸光度。细胞活性(%)=(处理样品吸光度-样品对照孔吸光度)×100%。
1.4.2 乳酸脱氢酶(LDH)漏出率 将HK-2细胞接种于96孔板中,密度为2×104/孔。5%CO2、37 ℃培养24 h后,更换培养基为不含胎牛血清低糖RPMI1640培养基;继续培养12 h后,按照不同实验要求用药物进行刺激。刺激结束后,收集细胞上清120 μL到新的96孔板中,加入60 μL LDH检测工作液,混匀,室温避光孵育30 min;检测490 nm处吸光度。LDH漏出率(%)=(处理样品吸光度-样品对照孔吸光度)×100%。以LDH漏出率反映细胞毒性。
1.4.3 ATP含量 HK-2细胞接种于六孔板中,待细胞生长融合至80%左右时,更换无血清培养基,并按照实验设计,给予不同药物刺激。裂解细胞,12 000 r/min离心10 min,取上清待用。参照说明书,配制ATP检测工作液,将100 μL ATP检测工作液加入检测孔中,室温放置3~5 min以消除本底。在检测孔内加入100 μL样品或标准品,迅速用移液器混匀,检测化学发光值;根据标准品浓度绘制标准曲线,并计算样品中ATP浓度。
1.4.4 SIRT1 mRNA表达 采用real-time PCR法进行测定。HK-2细胞接种于六孔板中,待细胞生长融合至80%左右时,更换无血清培养基,并按照实验设计,给予不同药物刺激。按照说明书,提取总RNA,并按照逆转录试剂盒的相关说明,合成cDNA。分别以1 μL cDNA为模板进行扩增,反应条件为:95 ℃预变型3 min;95 ℃ 10 s、60 ℃ 30 s扩增40个循环;溶解曲线为:95 ℃ 1 min,60 ℃ 1 min;由60 ℃到95 ℃,每10 s升高0.5 ℃,共需81个循环;记录各样品基因的循环域值(Ct值)。β-actin上游引物5′-TCGTGCGTGACATTAAGGAG-3′,下游引物5′-GATGTCCACGTCACACTTCA-3′;SIRT1上游引物5′-GATTGGCACAGATCCTCGAA-3′,下游引物5′-GTCTACAGCAAGGCGAGCATA-3′。根据内参计算相应蛋白的相对表达量。
1.4.5 SIRT1、AMPK、PGC-1α蛋白表达检测 采用Western blotting法。根据BCA法蛋白定量结果,调整蛋白浓度为30 μg/mL。加入适量5×上样缓冲液,混匀,95 ℃加热10 min,立即放在冰上冷却。根据所分离蛋白大小配制浓度分离胶,将之前变性的样品,根据所选用体系的承载量和实验需要进行上样。电泳分离后,将蛋白质条带从胶上转移到膜上,采用5%脱脂奶粉对膜上潜在结合位点进行封闭处理。SIRT1、AMPK、p-AMPK、PGC-1α以及GAPDH一抗孵育过夜,根据不同一抗选择相应二抗孵育1 h后,使用ECL发光液曝光。实验结果采用Image J软件分析相应条带灰度,并根据内参计算相应蛋白的相对表达量。
1.4.6 Caspase-9活性检测 采用荧光法。HK-2细胞接种于六孔板中,待细胞生长融合至80%左右时,更换无血清培养基,并按照实验设计,给予不同药物刺激;刺激结束后,加入适量裂解液,冰上裂解10 min;参照说明书,细胞裂解液加入等体积2×Reaction Buffer,以及1/10体积LEHD-AFC,37 ℃孵育1~2 h;测定荧光强度,激发波长400 nm,吸收波长505 nm。Caspase-9活性变化量=实验组荧光强度/对照组荧光强度。

2 结果
2.1 各组细胞活性比较 高糖组细胞活性低于对照组,APS组细胞活性高于高糖组(P均<0.05)。见图1。

注:与对照组比较,*P<0.05;与高糖组比较,#P<0.05。
图1 各组细胞活性比较
2.2 各组LDH漏出率比较 高糖组LDH漏出率高于对照组,APS组LDH漏出率低于高糖组(P均<0.05)。见图2。

注:与对照组比较,*P<0.05;与高糖组比较,#P<0.05。
图2 各组LDH漏出率比较
2.3 各组ATP生成量比较 高糖组ATP生成量低于对照组,APS组ATP生成量高于高糖组(P均<0.05)。见图3。
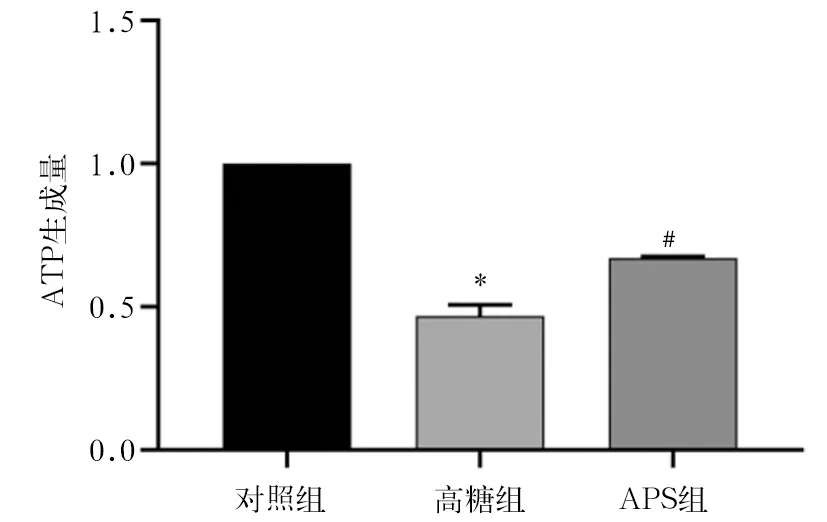
注:与对照组比较,*P<0.05;与高糖组比较,#P<0.05。
图3 各组ATP生成量比较
2.4 各组Caspase-9活性比较 高糖组Caspase-9活性高于对照组,APS组Caspase-9活性低于高糖组(P均<0.05)。见图4。

注:与对照组比较,*P<0.05;与高糖组比较,#P<0.05。
图4 各组Caspase-9活性比较
2.5 各组SIRT1 mRNA表达量比较 高糖组SIRT1 mRNA表达量低于对照组,APS组SIRT1 mRNA表达量高于高糖组(P均<0.05)。见图5。

注:与对照组比较,*P<0.05;与高糖组比较,#P<0.05。
图5 各组SIRT1 mRNA表达量比较
2.6 各组SIRT1、AMPK、PGC-1α蛋白表达量比较 各组间AMPK表达差异没有统计学意义,但高糖组p-AMPK表达量低于对照组,APS组p-AMPK表达量高于高糖组(P均<0.05),见图6。高糖组SIRT1和PGC-1α表达量均低于对照组,APS组SIRT1和PGC-1α表达量均高于高糖组(P均<0.05),见图7。
2.7 SIRT1抑制剂Ex527对APS作用的影响 高
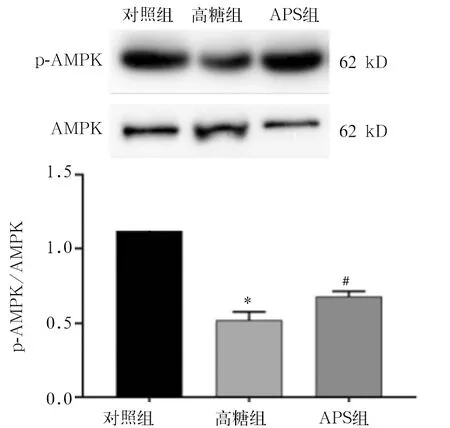
注:与对照组比较,*P<0.05;与高糖组比较,#P<0.05。
图6 各组AMPK蛋白表达量比较

注:与对照组比较,*P<0.05;与高糖组比较,#P<0.05。
图7 各组SIRT1、PGC-1α蛋白表达量比较
糖组细胞活性低于对照组,APS组细胞活性高于高糖组,Ex527组细胞活性低于APS组(P均<0.05),见图8。高糖组LDH漏出率高于对照组,APS组LDH漏出率高于高糖组,Ex527组LDH漏出率高于APS组(P均<0.05),见图9。
3 讨论
作为糖尿病最主要的并发症之一,DN严重影响糖尿病患者的生活质量,缓解DN的发生发展,对于糖尿病患者意义重大。目前,关于DN发生发展的机制有多种不同学说,其中“统一机制”学说得到了广泛的认可。该学说认为高血糖所引发的活性氧增多,是糖尿病患者发生微小血管病变的主要诱因之一[3, 4]。由于活性氧主要在线粒体产生,因此越来越多的研究开始关注线粒体在DN中发挥的重要作用[5, 6]。

注:与对照组比较,*P<0.05;与高糖组比较,#P<0.05;与APS组比较,△P<0.05。
图8 SIRT1抑制剂Ex527对细胞活性的影响

注:与对照组比较,*P<0.05;与高糖组比较,#P<0.05;与APS组比较,△P<0.05。
图9 SIRT1抑制剂Ex527对LDH漏出率的影响
APS是中药黄芪的主要有效活性成分之一,研究发现,其对于改善老年糖尿病小鼠糖脂代谢、维持DN大鼠足细胞Nephrin和Podocin表达[7]、抑制DN中肾小管上皮细胞转分化[8]等有着重要的作用。本研究发现,与对照组相比,高糖诱导后HK-2细胞活性明显降低,同时细胞上清中LDH漏出率明显提高;APS组细胞活性高于高糖组,而LDH漏出率低于高塘组,表明APS对高糖诱导后的HK-2细胞损伤有保护作用。但其中的作用尚不明确,需要进一步地研究。
肾脏兼具分泌和重吸收等多项功能,是一个高耗能器官,耗氧量仅次于心脏。因此,作为细胞内主要的供能细胞器,线粒体在维持肾脏功能稳定方面发挥着重要的作用;通常使用ATP生成量表示线粒体的功能完整性[9]。此外,当线粒体功能受损时,可通过激活Caspase-9启动线粒体途径凋亡。Caspase家族蛋白在凋亡过程中发挥重要的作用,细胞凋亡过程也是Caspase的级联放大过程;其中Caspase9参与线粒体通路,是线粒体凋亡发生的主要标志之一[10]。本研究发现,高糖诱导后,HK-2细胞中ATP生成量显著降低、Caspase9活性增加,而APS可以上调ATP含量、抑制Caspase-9过度激活,推测APS对高糖诱导后HK-2细胞损伤的保护作用可能通过维持线粒体功能、抑制线粒体途径凋亡来实现。
AMPK/SIRT1/PGC-1α是调控线粒体的主要途径之一[11]。AMPK被称为是能量代谢感受器,当细胞内AMP/ATP比值升高时,AMPK被激活,p-AMPK水平显著升高,并进一步上调SIRT1表达[12, 13]。SIRT1隶属于Sirtuin家族,是一种重要的烟酰胺腺嘌呤二核苷酸(NAD+)依赖性去乙酰化酶,在能量代谢、衰老等领域发挥着重要的调控作用。SIRT1通过去乙酰化作用提高PGC-1α表达,后者作为线粒体生物合成的重要调控因子,可直接调控线粒体数量及功能[14, 15]。本研究结果显示,高糖诱导后,HK-2细胞中AMPK表达没有明显变化,但p-AMPK表达显著下调;APS可以逆转此变化。此外,高糖诱导后HK-2细胞中SIRT1 mRNA表达下调,同时SIRT1和PGC-1α的蛋白表达水平明显下调。而APS可以提高SIRT1 mRNA以及SIRT1和PGC-1α的蛋白的表达水平。Ex 527是SIRT1的抑制剂,可以特异性抑制SIRT1 表达。本研究发现,合用Ex 527后,APS对HK-2细胞的保护作用被明显抑制,细胞生存率降低,LDH漏出率增加,进一步表明APS通过SIRT1途径发挥细胞保护作用。
综上所述,APS可提高高糖诱导的肾小管上皮细胞的生存率、维持线粒体功能并抑制线粒体途径介导的细胞凋亡,其机制可能为通过AMPK/SIRT1/PGC-1α途径发挥对线粒体的保护作用。该研究为治疗DN提供了新的治疗思路,同时也为推动中药发展提供了理论基础。
