子宫内膜癌孕激素耐药机制及新型疗法的研究进展
2020-03-19滕银成
沈 偲,滕银成
上海交通大学附属第六人民医院妇产科,上海 200233
子宫内膜癌(endometrial cancer,EC)发病率逐年上升,在发达国家居女性生殖道恶性肿瘤榜首,在我国部分发达地区也有类似的趋势[1]。我国2017 年的发病率为634/10 万,死亡率为21.8/10 万[2]。EC 的平均发病年龄不断降低,统计[3]显示5%的EC 患者小于40 岁,其中超过70%的患者在诊断时是未生育妇女且具有强烈的生育愿望。孕激素治疗是保留生育功能的重要的治疗方式,应用于临床有近20 年的历史,并不断取得新的进展。孕激素治疗的完全缓解(complete remission,CR)率可达到70%左右,但仍有约30%的患者对孕激素治疗不敏感[4]。了解这部分患者对孕激素治疗耐药的原因并采取相应的措施逆转孕激素耐药情况,可以进一步提高孕激素保育治疗的成功率,对患者具有重要的意义。
1 孕激素的治疗效果
孕激素受体(progesterone receptor,PR)的表达水平与孕激素治疗效果密切相关。研究[3]发现90%的年轻EC 患者的癌组织中有较高的PR 表达,因此对符合指征的患者采用孕激素治疗,临床CR 率较高。据文献[5-6]报道,单纯使用口服孕激素治疗早期子宫内膜癌(early endometrial cancer,eEC)的缓解率为53.8%~78.9%。
2 孕激素的耐药机制
虽然孕激素治疗早期子宫内膜癌的效果已得到肯定,但仍有约30%的患者对孕激素治疗不敏感或无反应,其原因可能与PR 表达水平下降、功能异常以及相关基因突变、信号通路异常等有关,值得进一步深入研究,为临床治疗提供理论依据。
孕激素通过PR 及调节基因抑制肿瘤生长,促进细胞凋亡并诱导细胞自噬。PR 是预测孕激素治疗效果的标志物,其正常表达是孕激素应答的先决条件。PR 发挥功能与PRA和PRB 两种受体亚型相关性较大,目前认为来源于同一基因,由不同启动子转录的 PRA 和PRB 在活性和功能上具有显著差异。孕激素主要通过PRB 的Src 蛋白/丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)途径发挥抑制EC 细胞增殖及侵袭的作用。EC 患者PRB 表达的减少和缺失与EC 的低分化相关,目前大多数临床研究支持PRB/PRA 比值下降与孕激素耐药相关。因此,EC 组织中PR 表达的下调或缺失与临床分级较高及孕激素耐药相关。
研究表明PR 翻译后的受体修饰会影响PR 功能,导致孕激素作用减弱或孕激素不敏感。PR 蛋白特异性氨基端磷酸化或去磷酸化会直接影响PR 的转录活性。当其第294 位的丝氨酸被磷酸化后,PRB 转录活性增加,EC 细胞对孕激素敏感性显著提高[7]。腺苷酸活化蛋白激酶能通过抑制孕激素磷酸化PR,抑制PR 与靶基因的孕激素反应元件结合,从而抑制靶基因转录,导致孕激素作用减弱并产生耐药性。PR 的第388 位赖氨酸被类泛素化后能抑制PR 活性,并降低其稳定性,导致孕激素耐药。此外,已有研究[8]表明PRB 甲基化率的提高也可能与PRB 基因表达减少相关,并最终影响子宫内膜细胞对孕激素的敏感性。
2.1 孕激素耐药的相关信号通路
孕激素耐药还与EC 患者的肿瘤微环境相关。EC细胞分泌转化生长因子α(transforming growth factor α,TGF-α)、 表 皮 细 胞 生 长 因 子(epidermal growth factor,EGF)和胰岛素样生长因子(insulin like growth factor,IGF)等细胞因子,以及表皮细胞生长因子受体(epidermal growth factor receptor,EGFR)表达增加,激活TGF/EGFR 途径,降低PRB 的表达,同时激活下游Ras/MAPK 及磷脂酰肌醇3-激酶/丝氨酸-苏氨酸蛋白激 酶(phosphatidylinositol 3-kinase/serine-threonine protein kinase,PI3K/AKT)途径,促进耐药细胞增殖,抑制耐药细胞的凋亡,最终导致EC 细胞孕激素的耐药性提高。EGFR 酪氨酸激酶特异性抑制剂AG1478 能有效抑制EGFR 表达过度的EC 细胞的增殖,并提高孕激素敏感性。而麦考酚酸(mycophenolic acid,MPA)是一种高效孕激素,在eEC 患者和内膜不典型增生(atypical endometrial hyperplasia,AEH)患者的保育治疗中作为主要药物,但长期使用会促使EC 细胞的TGF-α 及EGFR表达增加,EGFR 磷酸化程度增加,PRB 启动子高密度甲基化,从而导致PRB 表达下降。此外,在EC 肿瘤微环境的研究[9]中,发现多数EC 上皮细胞的10 号染色体上的磷酸酶和张力蛋白同源基因(phosphatase and tension homology deleted on chromosome ten,PTEN)缺 失 会 使EC 对孕激素敏感。而当肿瘤微环境中Kirsten 大鼠肉瘤病毒癌基因(Kirsten rat sarcoma viral oncogene,Kras)被激活后,可使PR 基因启动子的DNA 甲基化,从而降低肿瘤间质中的PRB 表达。说明在长期使用孕激素治疗后,EC 肿瘤细胞激活Kras 通路产生了孕激素耐药。最新研究[10]表明,哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)的磷酸化能促进PR 减少或缺失的孕激素耐药细胞生长并抑制其自噬,是孕激素抵抗的重要机制。mTOR 抑制剂RAD001(依维莫司)可通过降低mTOR 的磷酸化促进耐药细胞自噬,抑制孕激素耐药细胞的增殖,从而提高EC 的孕激素敏感性。微RNA-205(microRNA-205,miR-205)通 过PI3K/AKT/mTOR 通 路激活PTEN 转录,抑制耐药细胞的自噬和PR 表达,从而导致孕激素耐药。miR-205 抑制剂处理后的耐药细胞自噬增强,G0/G1/S 期细胞比例显著降低,耐药细胞数量明显减少,从而逆转孕激素耐药,提高孕激素敏感性[11]。
核因子NF-E2 相关因子(nuclear factor erythroid 2-related factor 2,Nrf2)在多种癌症的化学治疗耐药中起关键作用,在EC 的孕激素耐药中也发挥重要的作用。Nrf2 和存活蛋白(survivin)在长期使用MPA 所致孕激素抵抗的EC 样本中过表达,survivin 在EC 细胞中表达减少能抑制Nrf2 过表达诱导的孕激素抵抗;而停用MPA 后,Nrf2和survivin 表达均被抑制,孕激素敏感性升高,这表明长期使用MPA 可能通过Nrf2/survivin 通路诱导EC 细胞产生孕激素耐药[12]。此外,Nrf2 和20α-羟基类固醇脱氢酶(aldo-keto reductase family 1 member C1,AKR1C1)也在长期使用MPA 所致孕激素抵抗的EC 细胞中表达显著升高。停用MPA 后,Nrf2 和AKR1C1 表达被抑制,且细胞增殖活性降低,这同样表明长期使用MPA 可能通过Nrf2/AKR1C1 通路诱导EC 细胞产生孕激素耐药[13]。
孕激素耐药细胞中NAD-依赖性去乙酰化酶sirtuin-1(NAD-dependent deacetylase sirtuin-1,SIRT1) 和 胆 固醇调节元件结合蛋白1(sterol regulatory element binding protein 1,SREBP-1)上调,而PR 和叉头状转录因子O1(forkhead transcription factor O1,FoxO1) 下 调;SIRT1表达沉默后,PR 和FoxO1 表达上调,SREBP-1 表达下调,孕激素敏感性增高。这说明SIRT1/FoxO1/SREBP-1是靶向PR 表达的通路,参与孕激素耐药[14]。SREBP-1是一种调节胆固醇和脂肪酸合成的限速酶,这提示脂质代谢也可能与孕激素耐药机制相关。脂质代谢紊乱伴随胰岛素抵抗,高水平的胰岛素通过PI3K/AKT 和Ras/MAPK 信号通路,抑制性激素结合球蛋白合成,提高雌激素水平,最终减少PRB 表达,从而降低孕激素敏感性。最新的研究[15]表明,3β-羟基类固醇-∆24 还原酶(3β-hydroxysteroid-Δ24 reductase,DHCR24)是胆固醇代谢途径的最终酶,在EC 患者中显著升高,与临床分期、组织学分级、血管侵犯、淋巴结转移以及总生存率降低有关,并与细胞中PR 表达呈负相关。胰岛素可以通过信号转导和转录激活因子3(signal transduction and activator of transcription,STAT3)诱导DHCR24 的表达,促进EC 细胞转移和孕激素耐药。DHCR24 表达沉默后,PR 表达显著上调,孕激素敏感性升高,胰岛素/STAT3/DHCR24/PR通路促进EC 转移和孕激素抵抗。
2.2 孕激素耐药的相关基因
Jaird1A 基因最终蛋白产物为一种脱甲基酶,其过表达会抑制组蛋白H3 亚基第4 位赖氨酸(lysine 4 on histone H3 protein subunit,H3K4)甲基化进而抑制PR 基因表达,降低孕激素敏感性。Arid1A 是一种抑癌基因,在体外试验中被敲除后PRB 基因低表达,AKT 磷酸化水平升高;其与孕激素耐药相关,基因敲除后的细胞即使通过AKT 磷酸化抑制剂LY204402 处理后,PRB 转录活性及EC 细胞对孕激素的敏感性也未逆转[9]。Hotair 和Lsd1 通过加强H3K4 的二甲基反应(secmethylation of lysine 4 on histone H3 protein subunit,H3K4me2)影响PRB 转录启动子,协同抑制PRB 表达。Hotair 基因敲除后PRB 表达上调并且MPA 敏感性提高[16]。Mig6 基因也可通过抑制AKT 的磷酸化抑制EC 细胞生长和孕激素耐药[17]。
此外,孕激素耐药机制还可能与其他基因表达相关。孕激素耐药的EC 细胞PR 共表达分析显示ANO1、SOX17、CGNL1、DACH1、RUNDC3B、SH3YL1 和CRISPLD1 共7 个基因表达与孕激素抵抗相关,而在临床上也已验证ANO1、SOX17、CGNL1 和SH3YL1 共4 个基因的下调与孕激素抵抗相关,其机制可能与这些基因及其表达产物能抑制PRB 启动子的甲基化相关,但具体机制尚待相关研究明确[18]。
3 改善孕激素耐药的方法
3.1 宫内节育器与其他新型孕激素
近年来研究发现,左炔诺孕酮宫内释放装置(levonorgestrel releasing intrauterine device,LNG-IUD)具有促使AEH 和EC 内膜转化为正常子宫内膜的功能;且由于其直接放置于宫腔,使子宫内膜局部的孕激素浓度是外周血的1 000 倍,这不仅提高了疗效、降低了复发率,还可以减少口服大剂量孕激素产生的全身不良反应。Hashim等[19]的研究表明,LNG-IUD 在控制eEC 和复杂性不典型增生方面优于口服孕激素。但LNG-IUD 作用于局部,循环系统中的孕激素浓度低,对下丘脑-垂体-卵巢轴的抑制作用较弱,不能抑制排卵及有效降低雌激素水平,影响其疗效的发挥,因此有学者将两者联合以提高疗效。Kim等[20]的前瞻性研究表明,两者联合应用不仅可以提高疗效,而且可以降低复发率。由于LNG-IUD 在EC 患者保育治疗中的效果得到肯定,因此被写入2019 年美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)EC 保育治疗指南。
近年来也有学者[21]对4 代口服孕激素醋酸诺美孕酮(nomegestrone acetate,NOMAC)治疗EC 进行研究,发现NOMAC 对PR 的相对亲和力为125%,高于MPA(115%),且受体专一性更高,疗效更好,不良反应更少。动物试验证明其对EC 肿瘤生长的抑制作用强于MPA:50、100 和200 mg/kg 的NOMAC 的肿瘤抑制率分别为24.74%、47.04%和58.06%,相应高于100 和200 mg/kg 的MPA 的抑制率(41.06%和27.01%)。其抑制裸鼠移植肿瘤生长可能与Sufu 和Wnt7a 基因表达上调有关。另有研究[22]表明NOMAC 能显著下调mTOR/4E 结合蛋白1(eIF4E-binding protein 1,4EBP1) / 真 核 翻 译 起 始 因 子4γ(eukaryotic translation initiation factor 4γ,EIF4G)的磷酸化水平,在G0/G1期阻滞细胞周期,诱导EC 细胞凋亡。NOMAC 等新型高效孕激素可降低孕激素的耐药性,成为提高孕激素保育治疗效果的新选择。
3.2 联合其他药物治疗
此外,很多学者采用孕激素联合促性腺激素释放激素 激 动 剂(gonadotropin releasing hormone α,GnRH α)、芳香酶抑制剂和选择性雌激素受体调节剂等治疗EC,均取得了较好的疗效。Zhou 等[23]给予AEH 和eEC 患者GnRHα 联合LNG-IUD 或芳香酶抑制剂来曲唑,整体CR率达到93.1%。其中AEH 患者达到全部CR,eEC 患者CR 率达88.2%,整体复发率仅6.9%,妊娠率为14.8%。这可能与来曲唑拮抗雌激素从而间接提高PR 表达相关。已有研究[24]表明,GnRHα 除了通过下调雌激素水平使内膜萎缩,还可上调PR 表达,抑制PI3K/AKT 通路逆转孕激素耐药。此外,靶向药物也是一种新选择。一项临床前试验[25]表明,吉非替尼能有效抑制EGFR 高表达的EC 移植瘤的增殖,逆转抗孕激素EC 移植瘤的孕激素抵抗。但妇科肿瘤组半年度会议(Semi-annual Meeting of Gynecological Oncology Group,GOG)公布的Ⅱ期临床试验[26]表明,吉非替尼单药治疗复发型晚期EC 耐受性较高,但疗效一般,其与孕激素联合使用是否能提高疗效尚待进一步临床试验验证。mTOR 抑制剂依维莫司已通过临床Ⅱ期试验,证明其对晚期复发EC 有效。
二甲双胍增加EC 细胞对孕激素敏感性的机制为近年来的研究热点。高胰岛素血症和胰岛素抵抗在EC 的孕激素耐药机制中发挥重要作用,两者主要通过促进PI3K/AKT 和Ras/MAPK 通路活化导致IGF-1 以及胰岛素样生长因子结合蛋白表达增加,并通过TGF/EGFR 途径降低PRB表达,增加EC 孕激素耐药性。而二甲双胍能活化腺苷酸活化蛋白激酶,抑制IGF-1 受体和胰岛素表达,从而抑制PI3K/AKT 和Ras/MAPK 通路激活,逆转孕激素耐药。此外,乙二醛酶1(glyoxalase 1,Glo1)是调节糖代谢的关
键酶,与肿瘤的耐药性密切相关,在孕激素耐药的EC 细胞中高表达。敲除该基因后,孕激素耐药细胞株对孕激素敏感性提高;二甲双胍通过靶向Glo1 和Tet1 基因,使Glo1 表达下调,逆转PR 表达降低,从而增加对孕激素敏感性[27]。此外,前文提及的信号通路中,二甲双胍可以抑制PI3K/AKT/mTOR 通路中的mTOR 磷酸化,促进耐药细胞的自噬,提高PR 表达,从而逆转孕激素抵抗,提高孕激素敏感性[10];也可以通过抑制Nrf2、survivin 和AKR1C1 等的表达提高孕激素敏感性等[12-13]。MPA 与二甲双胍具有协同作用,这可能与两者协同降低细胞周期蛋白D1 和细胞周期蛋白E 的表达相关,从而阻滞G2/M 期,抑制耐药细胞的增殖,提高孕激素敏感性[28]。在临床研究方面,最近一项研究[29]发现,二甲双胍可通过减少增殖标志物Ki-67 抑制EC 细胞生长,提高合并胰岛素抵抗或多囊卵巢综合征的EC 患者的CR 率[30],并可以控制这些患者的体质量。
3.3 宫腔镜病灶切除联合孕激素治疗
对于eEC 患者使用宫腔镜技术,不仅可以全面观察肿瘤发生的部位、大小及范围,还可以行病灶切除术,在获得满意病理标本的同时减少了肿瘤负荷,改善肿瘤微环境从而减少孕激素抵抗[31]。有研究[32]发现宫腔镜病灶切除术联合激素治疗,可以使国际妇产科联盟(Federation International of Gynecology and Obstetrics,FIGO)Ⅰa期组织学分级为G1年轻患者的妊娠率从35%~60%提高至70%以上。Laurelli等[33]对21 名患者行宫腔镜病灶电切术联合6 个月LNG-IUD治疗,CR 率95%,复发率10.5%,妊娠率92%,活产率81%。Falcone 等[32]报道了28 名患者宫腔镜电切术1 周后予以6 个月LNG-IUD 治疗,CR 率96.3%,复发率7.7%,妊娠率93.3%,活产率86.6%。一项meta 分析[34]表明,宫腔镜联合或不联合激素治疗相较于仅口服孕激素的治疗效果更好。
表1 统计了近5 年来使用宫腔镜联合激素保育治疗的共414 名AEH 和eEC 患者,累计CR 率分别为92.7%和78.3%,累计复发率分别为3.9%和28.5%,累计妊娠率为60.5%,累计活产率为53.7%。与仅使用激素的保育治疗相比,宫腔镜联合激素治疗CR 率更高,对于生育结局有一定改善,但统计文献多为小样本或者回顾性研究,尚待其他研究验证。
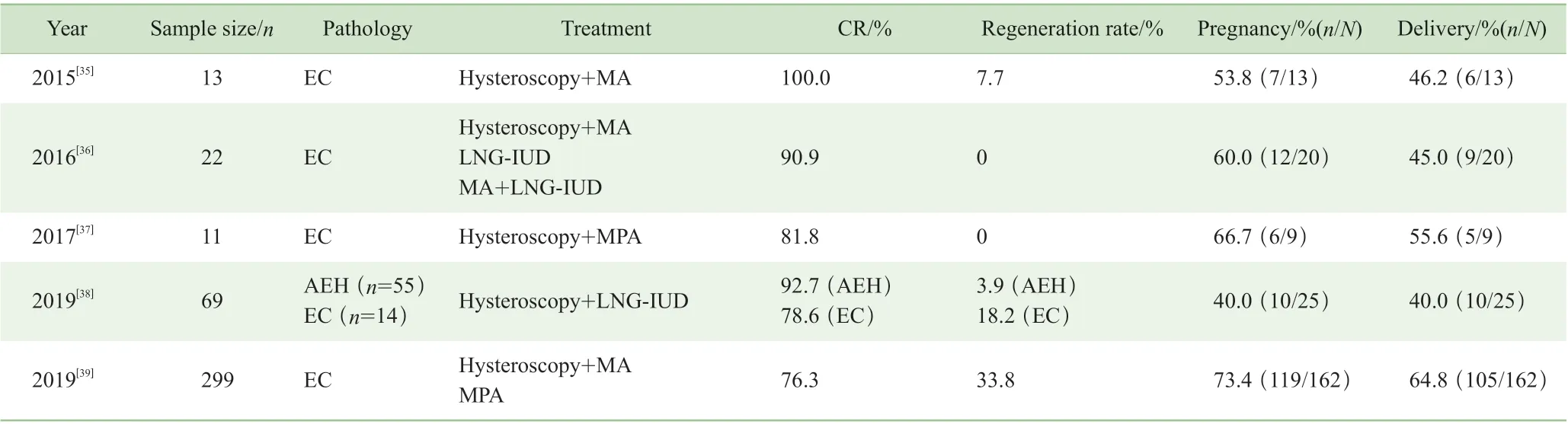
表1 2015—2019 年宫腔镜联合激素对AEH 和eEC 患者的保育治疗情况Tab 1 Hysteroscopy combined with hormones in the fertility-sparing treatment for AEH and eEC patients during 2015-2019
4 分子分型在EC 保育治疗中的应用
EC 只有在手术后才能精确分期分级,且可能与诊断性刮宫术所得病理结果不完全一致,因此保育治疗的决策必须考虑到诊断不精确造成的风险。分子分型为医师与患者更早、更准确地作出保育治疗的决策提供了可能。最近研究[40]发现P53 野生型和POLE 突变型患者保育治疗效果较好,可能与PR 表达较高有关。而P53 突变患者多数对孕激素治疗不敏感,即使达到CR 后仍会发生其他癌症,如卵巢癌等。林奇综合征(遗传性非息肉病性结直肠癌)患者癌组织通常恶性程度较高,孕激素耐药性较高[40]。一项队列研究[41]发现林奇综合征患者EC 的孕激素耐药与错配修复(mismatch repair,MMR)蛋白表达异常有关,并且孕激素治疗EC 后不影响子宫内膜组织MMR 蛋白的表达;研究还发现MMR 蛋白表达正常患者的肿瘤消退率显著高于异常表达者。Falcone 等[42]对Ia 期G1~G2的EC 患者采取宫腔镜联合孕激素保育治疗,并进行分子分型,跟踪其预后:PMS2 或MSH6 突变的患者虽能达到CR,但容易产生孕激素耐药,且长期随访发现这些患者会并发结直肠息肉或癌症。
5 结语
孕激素是年轻eEC 患者保育治疗的基础,疗效肯定。但部分患者对孕激素不敏感,长期治疗后产生的孕激素耐药是值得深入研究的问题。在治疗时,应根据患者整体情况、病理特点、孕激素耐药相关信号通路的关键基因突变及蛋白表达水平和分子分型,选择孕激素与其他药物或宫腔镜联合治疗,以提高保育治疗的效果,做到个体化和精准化。
参·考·文·献
[1] 廖秦平, 杨曦. 子宫内膜癌筛查及早期诊断的现状及展望[J]. 实用妇产科杂志, 2015, 31(7): 481-484.
[2] Chen WQ, Zheng RS, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132.
[3] Zivanovic O, Carter J, Kauff ND, et al. A review of the challenges faced in the conservative treatment of young women with endometrial carcinoma and risk of ovarian cancer[J]. Gynecol Oncol, 2009, 115(3): 504-509.
[4] 邢洁, 谢幸, 于爱军, 等. 早期年轻子宫内膜癌患者孕激素治疗的疗效及安全性分析[J]. 中国癌症杂志, 2014, 24(12): 931-935.
[5] Zhou R, Yang Y, Lu Q, et al. Prognostic factors of oncological and reproductive outcomes in fertility-sparing treatment of complex atypical hyperplasia and low-grade endometrial cancer using oral progestin in Chinese patients[J]. Gynecol Oncol, 2015, 139(3): 424-428.
[6] Baek JS, Lee WH, Kang WD, et al. Fertility-preserving treatment in complex atypical hyperplasia and early endometrial cancer in young women with oral progestin: Is it effective?[J]. Obstet Gynecol Sci, 2016, 59(1): 24-31.
[7] 刘倩. 醋酸甲地孕酮单药或联合NVP-BEZ235 对孕激素敏感及耐药子宫内膜癌细胞PI3K/Akt 信号通路的影响[D]. 北京: 北京协和医学院, 2014.
[8] Rocha-Junior CV, Da Broi MG, Miranda-Furtado CL, et al. Progesterone receptor B (PGR-b) is partially methylated in eutopic endometrium from infertile women with endometriosis[J]. Reprod Sci, 2019, 26(12): 1568-1574.
[9] Wang HZ, Tang ZH, Li T, et al. CRISPR/Cas9-mediated gene knockout of ARID1A promotes primary progesterone resistance by downregulating progesterone receptor B in endometrial cancer cells[J]. Oncol Res, 2019, 27(9): 1051-1060.
[10] Liu H, Zhang LQ, Zhang XY, et al. PI3K/AKT/mTOR pathway promotes progestin resistance in endometrial cancer cells by inhibition of autophagy[J]. Oncotargets Ther, 2017, 10: 2865-2871.
[11] Zhuo ZH, Yu HM. MiR-205 inhibits cell growth by targeting AKT-mTOR signaling in progesterone-resistant endometrial cancer Ishikawa cells[J]. Oncotarget, 2017, 8(17): 28042-28051.
[12] Fan RJ, Wang YY, Wang Y, et al. Mechanism of progestin resistance in endometrial precancer/cancer through Nrf2-survivin pathway[J]. Am J Transl Res, 2017, 9(3): 1483-1491.
[13] Wang YY, Wang Y, Zhang ZB, et al. Mechanism of progestin resistance in endometrial precancer/cancer through Nrf2-AKR1C1 pathway[J]. Oncotarget, 2016, 7(9): 10363-10372.
[14] Wang YL, Zhang LL, Che XX, et al. Roles of SIRT1/FoxO1/SREBP-1 in the development of progestin resistance in endometrial cancer[J]. Arch Gynecol Obstet, 2018, 298(5): 961-969.
[15] Dai M, Zhu XL, Liu F, et al. Cholesterol synthetase DHCR24 induced by insulin aggravates cancer invasion and progesterone resistance in endometrial carcinoma[J]. Sci Rep, 2017, 7: 41404.
[16] Chi SQ, Liu Y, Zhou X, et al. Knockdown of long non-coding HOTAIR enhances the sensitivity to progesterone in endometrial cancer by epigenetic regulation of progesterone receptor isoform B[J]. Cancer Chemother Pharmacol, 2019, 83(2): 277-287.
[17] Yoo JY, Kang HB, Broaddus RR, et al. MIG-6 suppresses endometrial epithelial cell proliferation by inhibiting phospho-AKT[J]. BMC Cancer, 2018, 18(1): 605.
[18] Li WZ, Wang SF, Qiu CP, et al. Comprehensive bioinformatics analysis of acquired progesterone resistance in endometrial cancer cell line[J]. J Transl Med, 2019, 17(1): 58.
[19] Hashim HA, Ghayaty E, El Rakhawy M. Levonorgestrel-releasing intrauterine system vs oral progestins for non-atypical endometrial hyperplasia: a systematic review and metaanalysis of randomized trials[J]. Am J Obstet Gynecol, 2015, 213(4): 469-478.
[20] Kim MK, Seong SJ, Kim YS, et al. Combined medroxyprogesterone acetate/levonorgestrel-intrauterine system treatment in young women with early-stage endometrial cancer[J]. Am J Obstet Gynecol, 2013, 209(4): 358.e1-e4.
[21] Ma A, Xie SW, Zhou JY, et al. Nomegestrol acetate suppresses human endometrial cancer RL95-2 cells proliferation in vitro and in vivo possibly related to upregulating expression of SUFU and Wnt7a[J]. Int J Mol Sci, 2017, 18(7): e1337.
[22] Cao C, Zhou JY, Xie SW, et al. Metformin enhances nomegestrol acetate suppressing growth of endometrial cancer cells and may correlate to downregulating mTOR activity in vitro and in vivo[J]. Int J Mol Sci, 2019, 20(13): e3308.
[23] Zhou HM, Cao DY, Yang JX, et al. Gonadotropin-releasing hormone agonist combined with a levonorgestrel-releasing intrauterine system or letrozole for fertility-preserving treatment of endometrial carcinoma and complex atypical hyperplasia in young women[J]. Int J Gynecol Cancer, 2017, 27(6): 1178-1182.
[24] Pronin SM, Novikova OV, Andreeva JY, et al. Fertility-sparing treatment of early endometrial cancer and complex atypical hyperplasia in young women of childbearing potential[J]. Int J Gynecol Cancer, 2015, 25(6): 1010-1014.
[25] Xu YL, Tong JQ, Ai ZH, et al. Epidermal growth factor receptor signaling pathway involved in progestin-resistance of human endometrial carcinoma: in a mouse model[J]. J Obstet Gynaecol Res, 2012, 38(12): 1358-1366.
[26] Lin ZJ, Qiu HY, Tong XX, et al. Evaluation of efficacy and safety of Reteplase and Alteplase in the treatment of hyper-acute cerebral infarction[J]. Biosci Rep, 2018, 38(1): BSR20170730.
[27] Jiang YY, Chen X, Wei YH, et al. Metformin sensitizes endometrial cancer cells to progestin by targeting TET1 to downregulate glyoxalase I expression[J]. Biomed Pharmacother, 2019, 113: 108712.
[28] Mu N, Dong M, Li L, et al. Synergistic effect of metformin and medroxyprogesterone 17-acetate on the development of endometrial cancer[J]. Oncol Rep, 2018, 39(4): 2015-2021.
[29] Kim SR, van der Zanden C, Ikiz H, et al. Fertility-sparing management using progestin for young women with endometrial cancer from a population-based study[J]. J Obstet Gynaecol Can, 2018, 40(3): 328-333.
[30] Russa ML, Zapardiel I, Halaska MJ, et al. Conservative management of endometrial cancer: a survey amongst European clinicians[J]. Arch Gynecol Obstet, 2018, 298(2): 373-380.
[31] Travaglino A, Raffone A, Saccone G, et al. Immunohistochemical predictive markers of response to conservative treatment of endometrial hyperplasia and early endometrial cancer: a systematic review[J]. Acta Obstet Gynecol Scand, 2019, 98(9): 1086-1099.
[32] Falcone F, Laurelli G, Losito S, et al. Fertility preserving treatment with hysteroscopic resection followed by progestin therapy in young women with early endometrial cancer[J]. J Gynecol Oncol, 2017, 28(1): e2.
[33] Laurelli G, Falcone F, Gallo MS, et al. Long-term oncologic and reproductive outcomes in young women with early endometrial cancer conservatively treated: a prospective study and literature update[J]. Int J Gynecol Cancer, 2016, 26(9): 1650-1657.
[34] Zhang Q, Qi GH, Kanis MJ, et al. Comparison among fertility-sparing therapies for well differentiated early-stage endometrial carcinoma and complex atypical hyperplasia[J]. Oncotarget, 2017, 8(34): 57642-57653.
[35] 陈睿. 早期子宫内膜癌保留生育功能13 例临床分析[J]. 中国医学创新, 2015, 12(24): 117-119.
[36] 胡春艳, 田燕妮, 刘晨, 等. 宫腔镜电切术联合孕激素治疗早期子宫内膜癌对患者生育功能的影响[J]. 中国综合临床, 2016, 32(4): 332-334.
[37] Wang FF, Yu AJ, Xu HC, et al. Fertility preserved hysteroscopic approach for the treatment of stage ia endometrioid carcinoma[J]. Int J Gynecol Cancer, 2017, 27(9): 1919-1925.
[38] Giampaolino P, Sardo ADS, Mollo A, et al. Hysteroscopic endometrial focal resection followed by levonorgestrel intrauterine device insertion as a fertilitysparing treatment of atypical endometrial hyperplasia and early endometrial cancer: a retrospective study[J]. J Minim Invasive Gynecol, 2019, 26(4): 648-656.
[39] Peiretti M, Congiu F, Ricciardi E, et al. Conservative treatment for welldifferentiated endometrial cancer: when and why it should be considered in young women[J]. Ecancermedicalscience, 2019, 13: 892.
[40] Trojano G, Olivieri C, Tinelli R, et al. Conservative treatment in early stage endometrial cancer: a review[J]. Acta Biomed, 2019, 90(4): 405-410.
[41] Zakhour M, Cohen JG, Gibson A, et al. Abnormal mismatch repair and other clinicopathologic predictors of poor response to progestin treatment in young women with endometrial complex atypical hyperplasia and well-differentiated endometrial adenocarcinoma: a consecutive case series[J]. BJOG, 2017, 124(10): 1576-1583.
[42] Falcone F, Normanno N, Losito NS, et al. Application of the proactive molecular risk classifier for endometrial cancer (ProMisE) to patients conservatively treated: outcomes from an institutional series[J]. Eur J Obstet Gynecol Reprod Biol, 2019, 240: 220-225.
