碳包覆锂离子电池正极材料的研究进展
2020-03-17刘智嘉周扬许芷源周国江
刘智嘉,周扬,许芷源,周国江*
(1.黑龙江科技大学 环境与化工学院,哈尔滨 150022;2.黑龙江省能源环境研究院,哈尔滨 150090)
1 引言
随着经济的迅速发展,人们对清洁可再生能源给予了越来越多的关注。目前,以锂离子电池和超级电容器为代表的两种电化学储能设备在市场上占据着至关重要的地位。其中锂离子电池因高能量密度、低制造成本和环境友好等因素备受青睐[1]。然而,锂离子电池正极材料比容量的衰减是制约其应用的关键问题之一[2]。为了提高正极材料的稳定性,研究学者们尝试了不同的优化方法。其中,包覆的方法对正极材料进行表面改性是改善比容量衰减的一种很好的策略[3]。然而,在包覆材料的选择中,部分金属氧化物和金属氟化物仅能起到保护的作用,导电性不佳。因此,开发兼具良好导电性和保护作用的包覆材料是研究的热点。碳材料因成本低、导电性好、化学性质稳定等因素被认为是最有前途的包覆材料。
用于正极材料包覆的碳源多种多样,主要可以分为有机碳源和无机碳源两类[4]。无论是有机碳源还是无机碳源均展现出良好的导电性。其中有机碳源含有丰富的官能团,当有机碳受热碳化时,丰富的官能团会发生聚合、芳构化等反应,从而产生大量气孔,提高包覆层的比表面积。无机碳因存在形式多种多样(碳纳米管、石墨烯等材料)为正极材料的改性提供了更多的选择。因此,选择不同的碳源,通过不同的包覆方法对锂电正极材料进行包覆,会对提升锂电性能起到关键性的作用[5]。
本文总结了不同碳源包覆的锂离子电池正极材料的电化学性能,并对碳包覆锂电正极的工艺进行了简要的概述。通过分析发现,正极材料的碳包覆是提高锂离子电池循环稳定性的有效方法,简单易操作的化学气相沉积和共沉淀包覆是当今的主流。
2 锂离子电池正极材料包覆碳源的分类
2.1 有机碳源
目前,较为常用的有机碳源可以分为以下几类:糖类、芳香族类、有机酸类和高分子等。在氮气保护下,将有机碳进行高温煅烧。有机物的化学键断裂,氢、氧等元素会被消耗掉,碳在正极材料表面富集,从而形成碳包覆层[6]。
2.1.1 糖类碳源
糖类碳源是有机碳源中结构最简单、价格最低廉的碳源。常用的糖类碳源有葡萄糖、蔗糖、纤维素等。因为糖类碳化温度较低,所以在400 ℃左右时即可完成碳化,在电极表面形成无定形碳[7]。糖类碳源是最利于规模化生产的碳源。王琦等[8]以葡萄糖为碳源,在氩气气氛下,650 ℃加热3 小时,成功合成具有了纳米片状结构的LiFePO4/C 复合材料如图1 所示。通过电化学测试发现(图2),LiFePO4正极材料在10 C 倍率下只有11.8 mAh·g-1的放电比容量;而用葡萄糖包覆的LiFePO4正极材料LF0.2(20 wt%)在同样倍率下仍能保持132.6 mAh·g-1的放电比容量,展现出极佳的电化学稳定性。

图1 扫描电镜图像(a)葡萄糖添加量0 wt%(b)葡萄糖添加量5 wt%(a)葡萄糖添加量10 wt%(a)葡萄糖添加量20 wt%[8]Fig.1 SEM images of (a) LF0 (b) LF0.05 (c) LF0.1 (d) LF0.2[8]
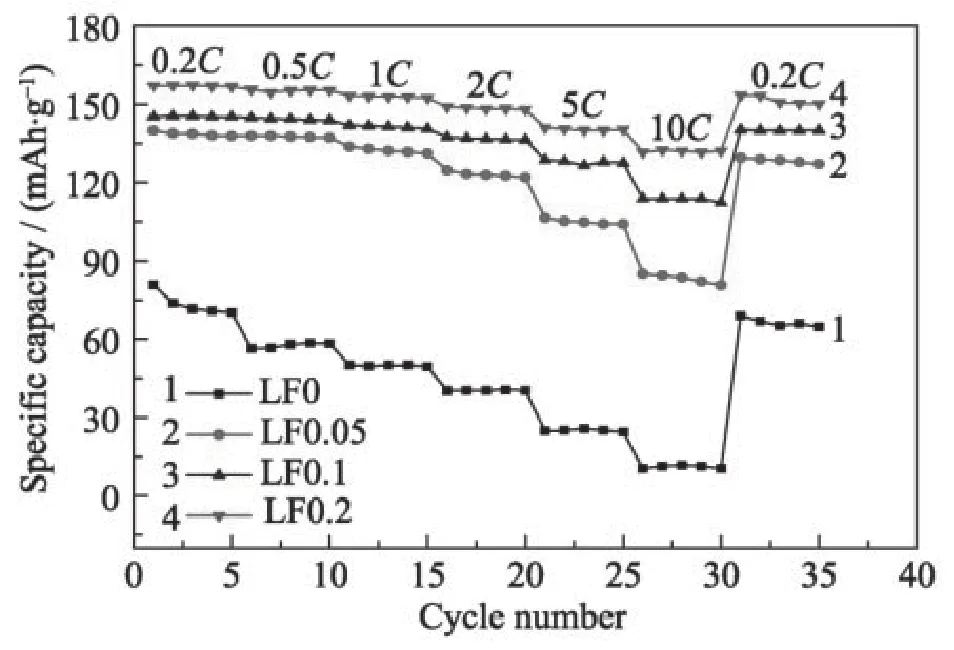
图2 LiFePO4/C 复合材料在不同倍率下的放电比容量[8]Fig.2 Specific capacities of all samples at various rates [8]
2.1.2 芳香族碳源
芳香族碳源是指分子中含有芳环结构的碳氢化合物,常用的有酚醛树脂、间二苯酚和稠环芳烃等。由于芳香族碳中至少含有一个苯环结构,所以这种碳源的热稳定性相对较好[2]。Ye 等[9]利用一种多环芳烃C24H12,碳含量高达96%,熔点438 ℃。在600℃高温热解合成了纳米级核壳结构的LiFePO4/C 复合材料,如图3 所示。当碳包覆量为2%(C2LPF)时,LiFePO4表面形成了3 nm 厚的碳包覆层。通过电化学测试对比发现(图4),在0.05 C 的低倍率下,未经处理的磷酸铁锂材料容量会迅速下降到26 mAh·g-1,仅有理论值的15%,同时库伦效率仅有83%;而包覆量为1~ 3%的磷酸铁锂复合材料分别表现出145、152、154 mAh·g-1的放电容量,是理论值的85%~ 91%,库伦效率也高达97%。可见,芳香碳包覆磷酸铁锂正极材料的电化学性能得到了很大程度的提升。

图3 C2LFP 微粒的透射电镜图像[5]Fig.3 TEM images of C2LFP particles [5]

图4 未包覆和不同包覆量的LiFePO4在0.05 C 倍率下的充放电曲线[9]Fig.4 Charge and discharge curve for LFP and different coating amount CLFP at 0.05 C [9]
2.1.3 有机酸碳源
相对于其他有机碳源,有机酸碳源最大的特点是含有羧基。羧基与金属离子的亲和力较高,更容易在正极材料表面形成稳定的碳包覆层。常用的有机酸碳源有柠檬酸、酒石酸、抗坏血酸等。Talebi-Esfandarani M 等[10]利用柠檬酸在LiFePO4颗粒表面包覆了均匀的碳层,柠檬酸制备的无定形碳通过LiFePO4和羧基之间的强相互作用被均匀地包覆在LiFePO4颗粒上。研究表明(图5),当柠檬酸加入量为30 wt% 时,复合材料在0.1 C 的倍率下有167 mAh·g-1的放电比容量,而无包覆层时仅有50 mAh·g-1的放电比容量。碳包覆层增加了LiFePO4的电导率,减少了LiFePO4和电解液间副反应的发生,从而有利于提高LiFePO4的电化学性能。Xu 等[11]使用左旋抗坏血酸(L-Ascorbic Acid)作为碳源,通过控制反应时间,在层状复合氧化物0.5Li2MnO3·0.5LiMn0.5Ni0.5O2(LMN)表面形成了包覆层。电化学测试表明(图6),在0.5 C 倍率下经过100 次循环测试后,原始电极材料LMN 的比能量和能量保持率分别490.9 Wh·kg-1和62.9%;而经过30 分钟抗坏血酸合成的复合电极材料(LMN30)的比能量和能量保持率分别640.8 Wh·kg-1和68.9%。材料的电化学性能得到了提升,这可以归因于碳包覆层的存在和富锂层状氧化物整体微结构的改变。

图5 无添加和添加不同量柠檬酸的复合材料在0.1 C 倍率下的放电曲线[10]Fig.5 Discharge curves of LF,LF/20C,LF/30C,LF/40C,and LF/50C samples at 0.1 C [10]

图6 无添加和添加抗坏血酸在不同反应时间下复合材料在0.5 C 倍率下的循环稳定性[11]Fig.6 Cycle stability of LMN,LMN00,LMN10,and LMN30 at 0.5 C [11]
2.1.4 高分子碳源
高分子碳源种类十分广泛,常见的有聚乙二醇(PEG)、聚苯乙烯、聚苯胺等。一般地,分子量不同的高分子碳源可以表现出不同的性质。以聚乙二醇为例,分子量在600 以下时,常温表现为液体,分子量在600 以上时,逐渐向固体转化。不同分子量的高分子碳源作包覆材料时对正极材料的电化学影响很大。Hong 等[12]采用聚乙二醇(平均分子量为200、400、4000 或10000)为碳源,包覆微米级磷酸铁锂粉末,制备了LiFePO4/C 复合材料如图7 所示。研究发现,LiFePO4/C 复合材料的结构和电化学性能在很大程度上取决于聚乙二醇的平均分子量。使用PEG-200为碳源包覆的正极材料颗粒间团聚度小、电荷转移电阻小、放电比容量高(图8)。较小分子量的PEG 会覆盖一个或几个微米级的磷酸铁颗粒,从而抑制磷酸铁颗粒的团聚,获得相对均匀的正极材料。较大分子量的PEG 会发生较为严重的团聚现象。因此,在使用高分子碳源进行正极材料包覆时,尽可能选择分子量相对适宜的分子量小的高分子碳源。

图7 LiFePO4/C 的扫描电镜图像(a)PEG200(b)PEG400(c)PEG4000(d)PEG10000[12]Fig.7 SEM images of LiFePO4/C:(a) PEG200 (b) PEG400 (c)PEG4000 (d) PEG10000[12]
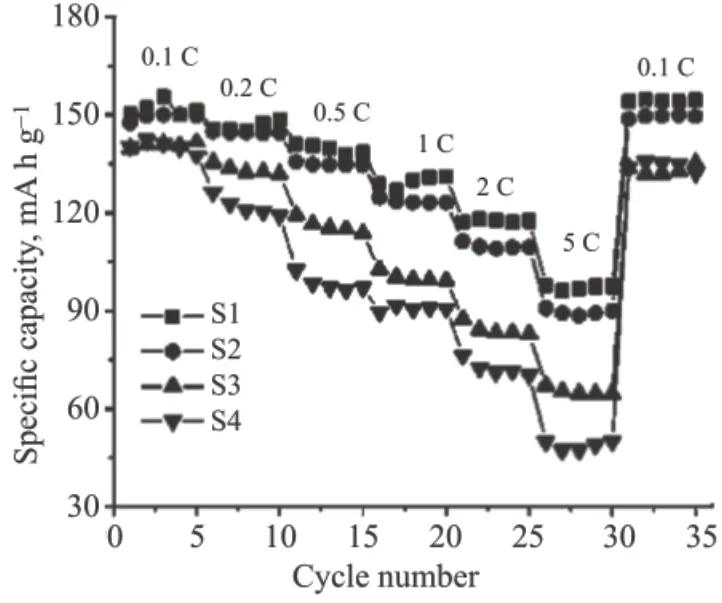
图8 LiFePO4/C 的倍率性能(S1)PEG200(S2)PEG400(S3)PEG4000(S4)PEG10000[12]Fig.8 Rate performances of LiFePO4/C (S1) PEG200 (S2)PEG400 (S3) PEG4000 (S4) PEG10000[12]
2.2 无机碳源
传统的无机碳源如炭黑、碳凝胶、乙炔黑等结构简单、价格低廉。随着碳材料研究的不断深入,无机碳材料展现出了独特的性能。其中包括零维材料碳量子点(Carbon Dots)、一维材料碳纳米管(Carbon Nano Tube)和二维材料石墨烯(Graphene)等。
2.2.1 碳量子点
碳量子点是尺寸小于10 nm 的碳点。与传统的炭黑、乙炔黑相比,碳量子点在锂离子电池正极材料表面修饰的过程中,表现出更高的库仑效率、循环寿命、界面润湿性。这些优点都源于碳量子点的小尺寸效应,以及碳量子点与传统电极材料优异的相容性[13]。另外,碳量子点也可用作吸附阴离子的添加剂,促进电解质中锂盐溶解,从而提高离子电导率、增加锂离子迁移数。二氧化钒(VO2)具有独特的层状结构、高容量和快速的锂离子扩散速率,是一种很有前途的锂离子电池正极材料,但这种材料在循环过程中比容量衰减快、高倍率下性能差。为了解决这些问题,Chao 等[14]使用电泳沉积的方式将石墨烯量子点(GQDs)包覆在了VO2纳米带上。通过这种方法,可以使带负电荷的量子点紧密地包覆在纳米级VO2的表面(图9 a)。这不但有效阻止了VO2的团聚,还减少了VO2在循环过程中的溶解现象。经过电化学测量比较(图9 b),GQDs 包覆层的VO2 电极在60 C 倍率下1500 次循环后仍有94%的高容量保持率,未经过表面包覆的VO2电极同样条件下只有85%的容量保持率。可见,碳量子点包覆的VO2有效的改善了循环过程中容量衰减快、高倍率性能差的不足。

图9 (a)VO2/GQDs 的透射电镜图像(b)60 C 倍率下1500 次的循环性能(前5 圈在1/3 C 倍率下活化)[14]Fig.9 (a) HRTEM image of VO2/GQDs (b) Cycling performance at 60 C for 1500 cycles (1/3 C at first five cycles for activation) [14]
2.2.2 碳纳米管
碳纳米管是具有完美的六边形结构的一维碳材料,已经被用于正极材料的表面修饰[15]。根据层数的不同,碳纳米管可分为单壁碳纳米管(SWCNT)和多壁碳纳米管(MWCNT)[16]。碳纳米管不仅可以提供导电的基体,促进了电子的快速传输,也能有效减少纳米颗粒的团聚。Wang 等[17]使用单壁碳纳米管对尖晶石结构的镍锰酸锂正极材料(LiNi0.5Mn1.5O4)进行了表面包覆。通过电化学测试发现(图10),未经处理的LiNi0.5Mn1.5O4在5 C 倍率下500 次长循环后,容量衰减了35.9%,平均每个循环周期容量衰减0.072%;而经碳纳米管表面改性后的LiNi0.5Mn1.5O4同样条件下容量衰减仅有18%,平均每个循环周期容量仅衰减0.036%。在高倍率下,碳纳米管包覆的LiNi0.5Mn1.5O4的循环稳定性得到了提高。Guler 等[18]使用多壁碳纳米管对尖晶石结构的锰酸锂(LiMn2O4)进行了表面包覆,成功合成了LiMn2O4/MWCNT 纳米复合材料。电化学测试结果表明(图11),LiMn2O4/MWCNT 纳米复合材料在1 C 倍率下实现了145.4 mAh·g-1的高比容量,接近了LiMn2O4的理论比容量,同时具有优异的倍率性能和循环稳定性。未经包覆的LiMn2O4经1 C 倍率下50 次循环后仅有86 mAh·g-1,容量保持率为60%;同样测试条件下,经10 wt%和15 wt%不同含量的多壁碳纳米管包覆后,分别具有92.6%和93.9%的容量保持率。碳纳米管良好的电导率、稳定的结构以及开放的晶格通道是锂离子实现快速扩散的主要原因[19]。

图10 未包覆和包覆单壁碳纳米管的LiNi0.5Mn1.5O4 在5 C 的倍率下500 次的循环性能[17]Fig.10 cycling performances for LiNi0.5Mn1.5O4and LiNi0.5Mn1.5O4/CNT at 5 C for 500 cycles [17]

图11 不同MWCNT 包覆量的LiMn2O4循环性能曲线[18]Fig.11 cycling performances of LiMn2O4with various amount of MWCNT[18]
2.2.3 石墨烯
石墨烯因其优异的导电性和高比表面积,在锂离子电池的改性中具有广阔的应用前景。石墨烯包覆层不仅有助于抑制机械反应引起的结构变形,而且有助于保护电极免受电解液分解产物的腐蚀。特别是在高温环境下,石墨烯包覆的正极材料展现出较好的电化学性能。Gao 等[20]使用石墨烯对LiNi0.5Mn1.5O4进行了表面包覆(图12)。通过电化学测试表明,未经包覆处理的LiNi0.5Mn1.5O4在20 C 倍率下经1000 次循环后,仅剩63.3% 的容量保持率;而表面包覆了石墨烯的LiNi0.5Mn1.5O4在同样条件下1000 次循环后,放电容量仍可达91 mAh·g-1,容量保持率高达82.5%。高温下的电化学性能的提升则更加明显(图13),在55℃高温环境以2 C 的倍率完成100 次循环后,未经石墨烯包覆的LiNi0.5Mn1.5O4放电容量急剧下降,仅有36 mAh·g-1,材料的活性几乎消失;包覆后的LiNi0.5Mn1.5O4放电容量可达83.8 mAh·g-1,容量保持率为94.5%。高温环境下性能的提升是石墨烯包覆材料独特的优势。


图12 扫描电镜图像(a)LiNi0.5Mn1.5O4(b)表面包覆石墨烯的LiNi0.5Mn1.5O4[20]Fig.12 SEM images of (a) LiNi0.5Mn1.5O4(b) Graphene coated LiNi0.5Mn1.5O4[20]

图13 在35℃、45℃和55℃环境下,LiNi0.5Mn1.5O4和石墨烯包覆的LiNi0.5Mn1.5O4在2 C 倍率下的循环性能[20]Fig.13 Cycle property of LiNi0.5Mn1.5O4and graphene coated LiNi0.5Mn1.5O4at 2 C with (i) 35 °C,(ii) 45 °C and (iii) 55 °C[20]
3 包覆工艺的种类
不同的包覆工艺影响正极材料的性能。薄包覆层很难达到所需的保护效果,较厚的包覆层可以为正极材料提供更好的保护,但表面包覆层中的离子和电子传输也会因此受到限制[21]。因此采用合适的包覆工艺控制包覆层的厚度是生产高性能正极材料的基础。目前,常用的表面包覆工艺有以下几种。
化学气相沉积法(CVD):将蒸汽态碳源和惰性保护气引入反应室,通过与混合蒸汽的特定化学反应加热固体基底,将所需包覆材料沉积在正极材料表面[22]。气相沉积有两种方式,以磷酸铁锂材料为例,一种方法是在LiFePO4的合成过程中的化学气相沉积,称为原位化学气相沉积。将碳源与前驱体混合,烧结后得到复合材料。这种方法必须要在惰性气氛下进行,通常可以获得较小的晶型,但缺点是由于碳源的提前加入,杂质(如碳化铁)含量会相对较多;另一种方法是非原位化学气相沉积,即先合成LiFePO4材料,再将碳源通过热处理包覆在LiFePO4表面,这种方法可以制备高纯度、高振实密度的复合材料[23],缺点是实际操作中碳源的复合程度很难控制。这种两种化学气相沉积法也是在正极材料表面包覆碳材料最常用的方法。
共沉淀包覆法:共沉淀包覆法也是一种常用的包覆方法,该方法是在正极材料的制备过程中完成包覆[24]。将沉淀剂缓慢加入到溶液中,通过沉淀和热处理在正极材料表面形成包覆层。共沉淀包覆的关键是需要调节反应温度和溶液的pH 来控制沉淀在正极材料表面的生成速度。既要使溶液有一定的过饱和度,又不能超过临界浓度。此种方法的优势是操作简单,成本低廉,关键在于溶液的体系温度、pH 和浓度的控制。
原子层沉积法(ALD):原子层沉积是将包覆材料以单原子膜的形式一层一层的包覆在基底表面的一种方法。原子层沉积需要少量的前驱体,这种方法可以精确控制包覆层的厚度,将包覆层彻底覆盖在正极材料表面。然而,这种方法可能导致导电路径被破坏,会使相关的电荷转移动力学变慢,同时每次反应只能沉积一层原子,制备工艺的时间成本相对较高。
射频磁控溅射法:通过射频电场的加速使氩离子撞击溅射材料制成的靶材,使目标材料向各个方向溅射,进而在基片上形成包覆膜。通过这种方法进行包覆,不会引入杂质,纯度较高。射频磁控溅射法包覆速度要比原子层沉积法快。但这种方法靶材的利用率不足40%。
4 结语
经过近半个世纪的发展,锂离子电池已经成为二次电池市场中最具活力的产品。而正极材料是决定锂离子电池性能和价格的关键因素之一。目前正极材料受到导电性不佳、电解质的腐蚀和高体积膨胀等因素限制。为了提高电池性能,研究学者们利用表面包覆技术来对正极材料进行改性。而在众多表面包覆材料中,碳材料的低成本、稳定性和环境友好对于电池的大规模商业生产具有非常明显的优势。在碳源的选择上,有机碳源和无机碳源有着各自的优势,随着研究的不断深入,碳材料在锂电应用方面将一直会是研究的热点。除此之外,超薄、均匀碳包覆技术的探索研究也将是未来正极材料的一个重要方向。
