维生素C联合替莫唑胺对胶质瘤细胞的毒性作用及其机制*
2020-03-16陈明生赵海康程莹莹袁致海张越林
陈明生, 赵海康, 程莹莹, 袁致海, 张越林
(1. 西安医学院第二附属医院神经外科 陕西省脑疾病防治重点实验室, 陕西 西安 710038; 2. 西安医学院第二附属医院神经外科, 陕西 西安 710038; 3. 西安医学院陕西省脑疾病防治重点实验室, 陕西 西安 710021)
胶质瘤是最常见的原发性脑肿瘤,40%的恶性胶质瘤患者生存期低于1年[1-3]。胶质瘤的高侵袭性导致其高复发率[4-5]。替莫唑胺作为新型的胶质瘤主要化疗药物,能通过血脑屏障进入脑脊液,在中枢神经系统中保持有效的需要浓度[6],从而有效的抑制胶质瘤的生长,提高了患者的生存期。但是替莫唑胺的作用仍不是完全有效的[7,8]。因此,找到更敏感的化疗药物成为胶质瘤治疗中重要的研究方向。维生素C(VC)是一种水溶性的维生素及辅酶。近年来,VC被发现具有抗肿瘤作用[9-11]。有研究报道,VC可协同化疗药物,如灰树花多糖(maitake polysaccharide, MP)、三氧化二砷及吉西他滨(Gemcitabine)抑制肿瘤包括神经胶质瘤、卵巢癌及胰腺癌细胞生长的作用。并且VC及甲萘醌(Menadione,VitaminK3)联合使用被认为可以协同介导胶质瘤细胞及肿瘤细胞的死亡[12],但VC与替莫唑胺的协同作用及其机制尚不明确。因此,本实验中以人胶质瘤细胞BMG-1及SHG44为研究对象,旨在探讨VC联合替莫唑胺对胶质瘤的毒性作用及其机制,为临床应用提供实验资料。
1 材料与方法
1.1 主要试剂与仪器
胶质瘤细胞BMG-1购自于印度班加罗尔;SHG44细胞(武汉普诺赛生命科技有限公司,中国);DMEM培养基和胎牛血清、青链霉素、胰酶(Sigma公司,美国);ERK抑制剂U1026、替莫唑胺(MCE公司,美国);维生素C(上海生工公司,中国);替莫唑胺(MCE中国,中国)细胞增殖与细胞毒性试剂盒(碧云天,中国);细胞周期与细胞凋亡试剂盒(碧云天,中国);U0126(MEK1/2抑制剂)(碧云天,中国)。普通光学显微镜(Olympus,日本);自动酶标仪(Elx800)(Bio-rad,美国);流式细胞仪(Microm,德国)。
1.2 细胞培养及分组
胶质瘤细胞BMG-1、SHG44细胞采用含10%胎牛血清及1%青链霉素的DMEM高糖培养基培养于5% CO2,37℃培养箱中。
将BMG-1及SHG44细胞分别分为:(1)对照组:不进行处理;(2)TMZ组:采用0.20 mmol/L TMZ处理细胞;(3)VC+TMZ组,分别采用0,0.25,0.50,0.75,1.00 mmol/L VC与0.20 mmol/L TMZ共同处理细胞;(4)TMZ+U0126组,采用0.2 mmol/L TMZ与10 μmol/L U0126共同处理细胞。
1.3 用MTT法检测胶质瘤细胞增殖率
取对数生长期的胶质瘤细胞接种96孔板中,每孔2×103cells,每组3个复孔。24 h后,加入50 μl MTT,继续培养4 h,弃上清,加入200 μl DMSO,检测吸光度值(OD值),进行3次独立重复实验。
1.4 用细胞流式技术检测细胞凋亡率
取对数生长期的胶质瘤细胞接种96孔板中,每孔2×103cells,采用流式细胞仪,按照细胞凋亡AnnexinV-FITC/PI双染试剂盒说明,对各组胶质瘤细胞中凋亡细胞比例进行检测,采用BD FACSDiva软件采集结果,分析细胞凋亡率。
1.5 用Western blot法检测蛋白表达
收集各组细胞,用预冷的磷酸盐缓冲溶液(PBS)洗2遍后,采用RIPA裂解提取总蛋白,BCA法检测蛋白浓度。配制10% SDS凝胶电泳,转膜,封闭1 h,一抗(1∶1 000)振荡孵育4℃过夜,之后加入山羊抗兔或大鼠二抗(1∶2 000),室温振荡孵育1 h,GAPDH作为内参对照,进行蛋白表达分析。
1.6 用ROS试剂盒检测活性氧水平
取对数生长期的胶质瘤细胞接种96孔板中,每孔2×103cells,培养24 h。按照分组处理细胞后,每孔加入终浓度10 μmol/L的DCFH-DA荧光探针,37℃避光反应20 min后吸去探针,用预冷的PBS洗涤细胞2次,随后用胰酶消化细胞,离心除去上清液,采用流式细胞仪测定活细胞的ROS相对强度。每个样品重复3次。
1.7统计学处理
2 结果
2.1 VC联合TMZ对胶质瘤细胞存活率的影响
将不同浓度的VC (0, 0.25, 0.50, 0.75及 1.00 mmol/L)及0.20 mmol/L TMZ共处理BMG-1及SHG44细胞,检测不同浓度VC联合TMZ对胶质瘤存活率的影响。结果显示,与对照组相比较,TMZ组胶质瘤细胞(BMG-1及SHG44细胞)的存活率显著下降(P<0.05);与TMZ组相比较,VC+TMZ组胶质瘤细胞(BMG-1及SHG44细胞)的存活率显著下降(P<0.05,表1)。从表1可见,当VC 0.5 mM联合TMZ 0.2 mmol/L时胶质瘤细胞存活率已显著下降(P<0.01),因此在后续的实验中,均观察VC 0.5 mmol/L联合TMZ 0.2 mmol/L对不同指标的影响。
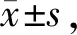
Tab. 1 Effects of VC on the survival rate in the BMG-1 and SHG44 cells(%, n=3)
用0.50 mmol/L VC及0.20 mmol/L TMZ共处理细胞0、24、48及72 h的结果显示,24~72 h内,与对照组相比较, TMZ组及VC+TMZ组细胞生存率降低,且VC+TMZ组生存率显著低于TMZ组(P<0.01,表2)。上述结果均说明VC能增强TMZ对胶质瘤的毒性。

Tab. 2 Effects of VC on the survival rate combined with TMZ in the BMG-1 and SHG44 cells(OD, n=3)
2.2 VC联合TMZ对胶质瘤细胞凋亡率的影响
与对照组相比较,TMZ组的细胞凋亡率增加(P<0.05);与TMZ组比较, VC+ TMZ共同处理可增加胶质细胞的凋亡(P<0.01,表3)。同时,Bax, Cleaved caspase-3及Cleaved PARP蛋白表达明显增加而Bcl-2表达降低(P<0.05,P<0.01,图1,表3)。
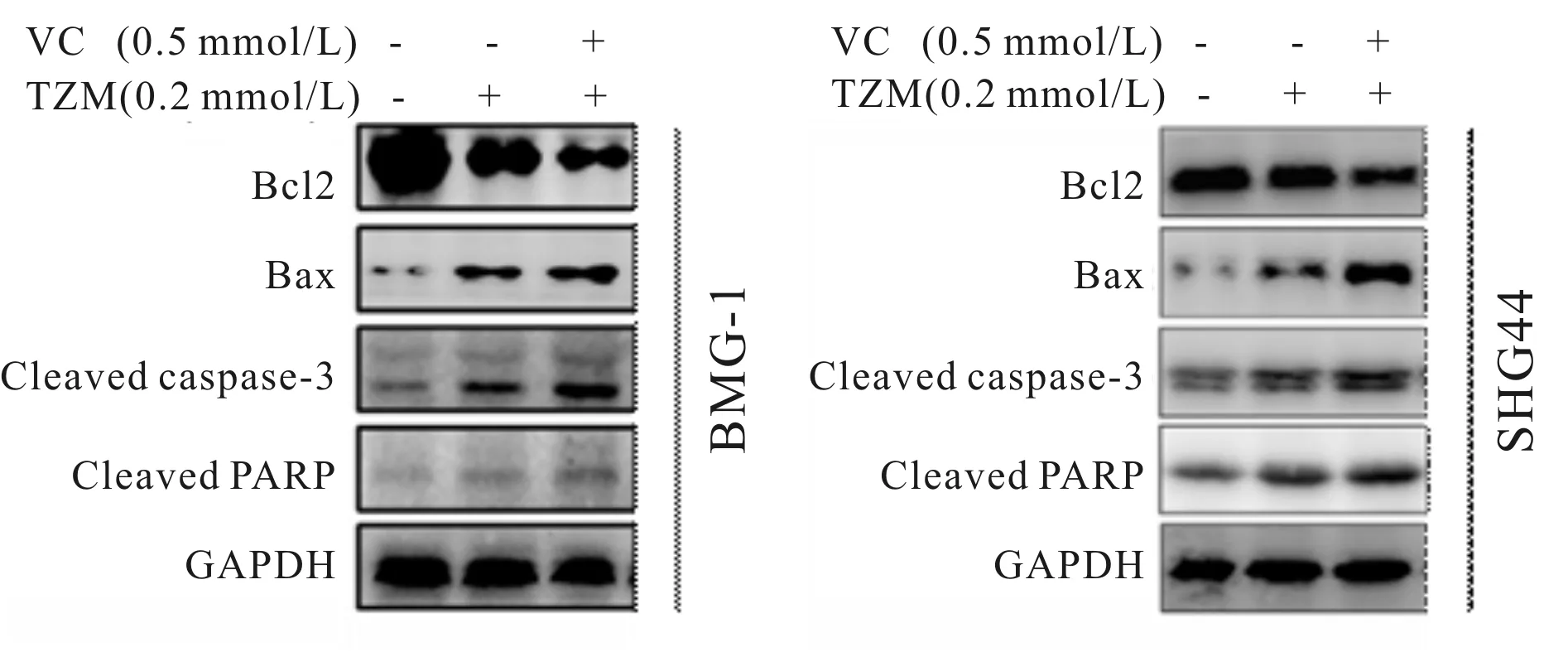
Fig. 1 Effects of VC on the relative expressions of the proteins combined with TMZ in the BMG-1 and SHG44 cells by western blot (n=3)
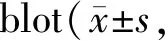
Tab. 3 Rates of apoptosis and relative expressions of protein in cells by flow cytometry and Western n=3)
2.3 VC联合TMZ对胶质瘤细胞ROS水平的影响
与对照组相比较,TMZ组胶质瘤细胞ROS水平显著增加(P<0.01)。而与TMZ组比较,VC+TMZ组ROS水平显著降低(P<0.01,表4)。
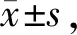
Tab. 4 Effects of VC on the relative expression of ROS combined with TMZ in the BMG-1 and SHG44 cells by flow cytometry (A.U., n=3)
2.4 VC联合TMZ对胶质瘤细胞自噬的影响
与对照组相比较,TMZ组自噬蛋白LC3-II/LC3-I表达水平显著增加(P<0.01)而p62表达降低(P<0.01)。与TMZ组对比,VC+TMZ组中自噬蛋白LC3-II/LC3-1表达降低,在SHG44细胞中表达差异具有统计学意义(P<0.05),但是在BMG-1细胞中差异无统计学意义,而p62表达显著增加(P<0.01,图2,表5)。
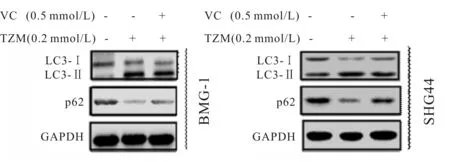
Fig. 2 Effects of VC on cell autophagy combined with TMZ in the BMG-1 and SHG44 cells by Western blot (n=3)
Tab. 5 Effects of VC on the relative expression of LC3-II/LC3-I and p62 combined with TMZ in the BMG-1 and SHG44 cells by Western blot n=3)
2.5 VC联合TMZ通过ERK信号通路对胶质瘤细胞自噬与凋亡相关蛋白的影响
与对照组相比较,TMZ组中p-ERK1/2表达增加(P<0.01),t-ERK1/2表达变化不大,LC3-II/LC3-I表达增加(P<0.01),Cleaved caspase-3、Cleaved PARP表达增加(P<0.05)。与TMZ组相比较,VC+TMZ组和TMZ+U0126组p-ERK1/2表达显著降低(P<0.05),t-ERK1/2表达变化不大,LC3-II/LC3-I表达显著降低,Cleaved caspase-3、Cleaved PARP表达显著增加(P<0.05,图3,表6)。
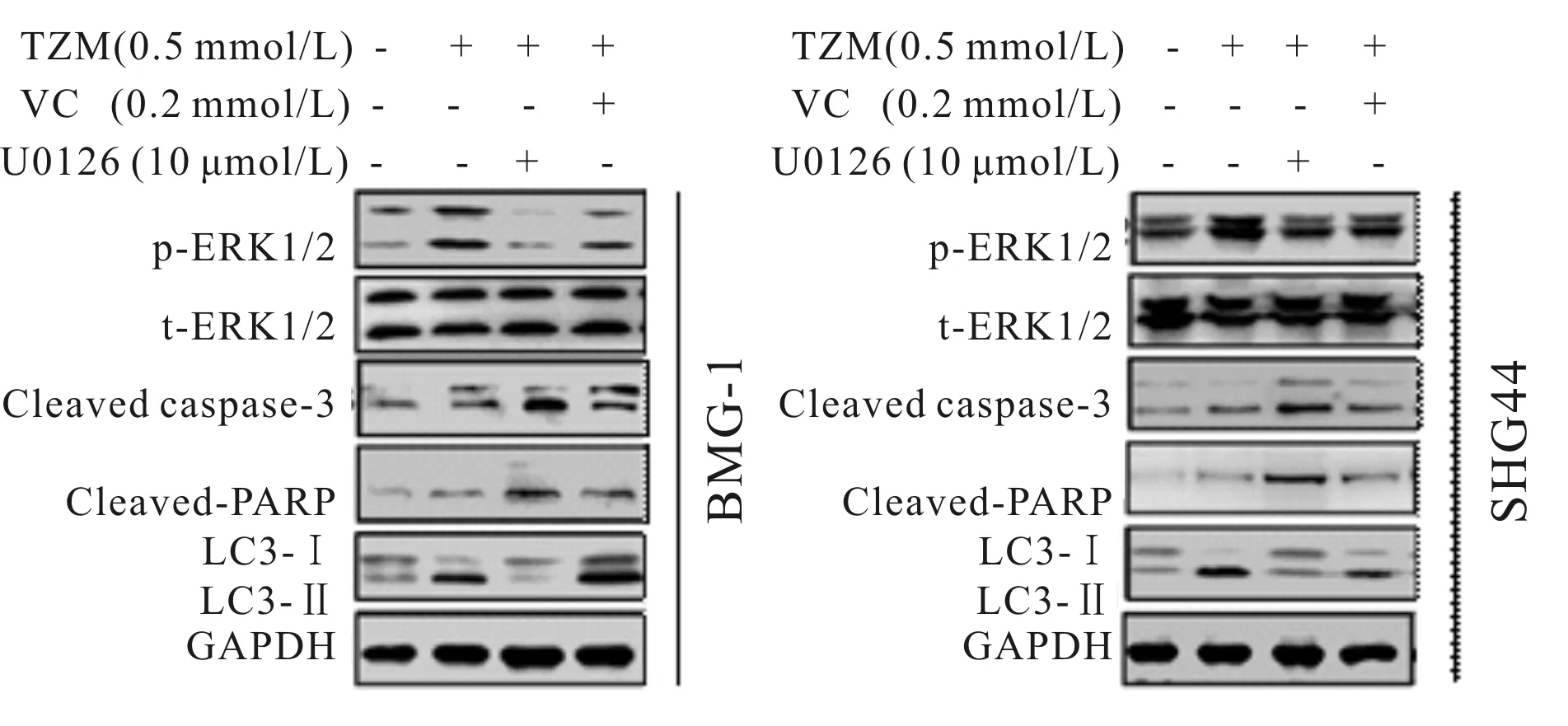
Fig. 3 Effects of VC on the relative protein expressions combined with TMZ in the BMG-1 and SHG44 cells by Western blot (n=3)

Tab. 6 Effects of VC on the relative protein expressions combined with TMZ in the BMG-1 and SHG44 cells n=3)
2.6 VC联合TMZ通过ERK信号通路对胶质瘤细胞凋亡的影响
通过流式细胞术和AnnexinV-FITC/PI实验检测细胞凋亡,结果显示,与对照组相比较,TMZ组细胞凋亡率增加(P<0.01)。与TMZ组相比较,VC+TMZ组和TMZ+U0126组中细胞凋亡率增加(P< 0.01,表7)。
Tab. 7 Effects of VC on the apoptosis combined with TMZ through ERK signaling pathway in the BMG-1 and SHG44 cells (%, n=3)
3 讨论
胶质瘤目前的主要治疗方法是手术切除合并放化疗,但这种疗法效果并不令人满意,胶质瘤仍是复发率高致死率高的脑肿瘤[13,14]。有学者发现TMZ可以有效缓解患者的症状,并降低肿瘤负荷[8,15]。联合应用传统化疗药物或分子治疗药物及TMZ具有协同作用,且药物耐受度高[16,17]。另外,有研究报道VC联合化疗药物使用,具有抗肿瘤作用[9-11]。但是VC在胶质瘤化疗中作用的机制尚不明确。因此,本研究联合VC及TMZ作用于人胶质瘤细胞BMG-1及SHG44,来检测VC在TMZ细胞毒性中的作用。
有文献报道VC在很多肿瘤细胞,包括神经母细胞瘤细胞系中具有选择性的毒性作用[18]。VC可抑制细胞增殖并促进胶质母细胞瘤的凋亡,从而促进肿瘤细胞的程序性死亡[19]。已知VC抗肿瘤作用的机制包括:(1)VC选择性促进肿瘤细胞DNA氧化应激损伤同时产生细胞外H2O2,从而产生细胞毒作用。(2)VC影响Bcl-2及Bax表达,通过降低Bcl-2/Bax比率,从而减低肿瘤细胞端粒酶活性并促进凋亡。有研究报道,VC介导的凋亡与Caspase-3相关[20]。Rodriguez等人发现VC抑制胶质细胞增殖[21]。本实验首次探讨TMZ与VC对胶质瘤细胞增殖和凋亡的作用。本实验检测细胞增殖率及凋亡率,并检测凋亡相关蛋白表达的变化,结果显示VC能增强TMZ对胶质瘤的毒性,包括抑制胶质瘤细胞增殖及促进其凋亡,并抑制TMZ诱导的自噬作用。
近期研究发现VC可通过升高细胞内ROS抑制剂水平介导骨肉瘤细胞凋亡[22]。ROS可促进DNA氧化应激损伤,DNA完整性破坏,基因突变率增高,从而导致肿瘤的发生[23, 24]。研究表明,VC可介导前列腺癌细胞自噬及ATP消耗,干扰细胞周期,从而形成对肿瘤细胞的细胞毒作用[25]。本实验采用DCFH-DA染色及Western Blot法检测ROS水平及自噬的结果显示,在BMG-1及SHG44细胞中,VC可以抑制TMZ介导的ROS水平以及自噬。
有文献报道,VC可通过抑制ERK1/2磷酸化来抑制自噬,ERK同时可通过促进PKM2磷酸化抑制凋亡[26]。而TMZ介导的ROS可导致ERK磷酸化并促进自噬,提示ROS/ERK通路在胶质瘤TMZ治疗中起重要作用[27]。本研究通过检测ERK通路相关蛋白p-ERK1/2和 t-ERK1/2表达,发现TMZ升高BMG-1及SHG44细胞中p-ERK1/2蛋白表达,而增大VC浓度可降低p-ERK1/2表达。加入ERK抑制剂U1026后,Cleavedcaspase-3及Cleaved-PARP表达增加,而LC3-II/LC3-1表达减低。该结果提示VC通过ERK通路促进细胞凋亡并抑制自噬。
综上所述,VC联合TMZ可增强对胶质瘤细胞的细胞毒性及凋亡作用,同时降低ROS水平,通过ERK信号通路抑制TMZ介导的自噬。该结果为VC在胶质瘤治疗药物的研究提供新的思路。然而,由于本研究的局限性,需要进一步研究胶质瘤细胞中VC与其他化疗药物联合应用,为其在胶质瘤治疗提供更多的证据。
