柔木丹改善小鼠肝纤维化的TGF-β1/Smad4信号通路机制*
2020-03-16闫曙光李京涛魏海梁
李 倩, 闫曙光, 惠 毅, 李京涛, 魏海梁, 张 红, △
(1. 陕西中医药大学医学科研实验中心, 咸阳 712046; 2. 陕西中医药大学基础医学院, 咸阳 712046; 3. 陕西中医药大学附属医院, 咸阳 712000)
肝纤维化是由各种损伤因素持续作用、诱发肝星状细胞(hepatic stellate cell,HSC)过度活化引起肝内结缔组织异常增生的病理过程[1,2]。随着肝纤维化程度的逐渐加重会引起肝脏结构改变、功能丧失并最终导致肝硬化,进一步引发肝癌。病情一旦发展到肝硬化、肝癌阶段,治疗困难,预后差。因此,阻止或减缓肝纤维化的发生,是治愈大多数慢性肝病的核心要素[3]。传统中医药治疗肝脏疾病历史悠久,为减缓、阻断纤维化进展提供了丰富候选药物[4,5]。柔木丹(roumudan,RMD)是由陕西中医药大学附属医院肝病科常占杰教授创制、防治慢性肝病的院内制剂。RMD是由黄芪、皂刺、鳖甲、枳壳、柴胡、赤芍、丹参、川芎、汉防己等组成:方中黄芪甘温益气;皂刺、鳖甲软坚散结;枳壳、柴胡疏肝理气;赤芍、丹参、川芎活血散瘀;汉防己利湿消肿,诸药配伍寓“气行则血行”“血行则瘀散”之意,以达到柔肝软坚、活血消积之目的,对慢性乙型肝炎所致肝纤维化具有显著的阻断和防治作用[6,7]。本课题组前期实验研究指出:在肝纤维化诱导期,使用RMD对模型动物进行治疗可有效改善其肝纤维化水平[8]。本实验采用CCl4诱导小鼠肝纤维化模型,于肝组织切片显示出明显的肝脏纤维化病理特征时,使用RMD对肝纤维化小鼠进行治疗,旨在探索RMD改善小鼠肝纤维化的作用机制,为RMD的临床应用提供一定的理论支撑。
1 材料与方法
1.1 实验动物
8周龄、SPF级、雄性BALB/c小鼠,由成都达硕实验动物有限公司提供,许可证号:SCXK(川)2015-030。动物饲养和实验操作均符合陕西中医药大学实验动物福利伦理委员会相关规定。实验过程中动物自由摄食和饮水,光/暗周期为12 h/12 h。
1.2 药物及主要试剂
柔木丹[9](由陕西中医药大学附属医院制剂室提供,陕药制字Z20160012)成人使用剂量为30 g/d,根据公式D鼠(小鼠用药剂量,g/kg)=D人(人用药剂量,g/kg)/0.081[10]估算出小鼠灌胃所用的人用药量的等效剂量为6.2 g/(kg·d)。
α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体(CST,美国);转化生长因子-β1(transforming growth factor-β1,TGF-β1)抗体(Affinit,美国);Ⅰ型胶原(collagen Ⅰ alpha 1,COL1A1)、Ⅲ型胶原(collagen Ⅲ alpha 1,COL3A1)抗体(NOVUS,美国);甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(三箭,天津);山羊抗鼠IgG、山羊抗兔IgG(博士德,武汉);即用型免疫组化EliVisionTMplus试剂盒(鼠/兔)、DAB显色试剂盒(迈新,福州);羟脯氨酸(hydroxyproline,HYP)测试盒(建成,南京);地高辛抗体、NBT/BCIP STOCK SOLUTION(Roche,美国);探针、引物合成(生工,上海);RNA提取、反转及实时定量PCR试剂盒(TaKaRa,日本)。
1.3 主要仪器
NanoDrop 2000C超微量分光光度计(Thermo,美国);RM2235石蜡切片机(Leika,德国);蛋白电泳系统(Bio-rad,美国);7500实时PCR系统(Applied Biosystems,美国);正置数码显微镜(Zeiss,德国);FluoChem Q凝胶成像分析系统(Alpha,美国);超低温冰箱(海尔,青岛)。
1.4 动物分组、造模及给药
将小鼠随机分为空白对照组、肝纤维化模型组和RMD治疗组3组,每组11只。模型及RMD治疗组小鼠腹腔注射20% CCl4(CCl4∶橄榄油=1∶4),注射量为2.5 ml/kg,空白对照组以同样方法注射等量橄榄油,每周2次;第2周起调整模型及RMD治疗组小鼠CCl4腹腔注射量为5 ml/kg(空白对照组注射等量橄榄油),每周2次,诱导建立小鼠肝纤维化模型。成模后,模型及RMD治疗组小鼠继续腹腔注射20%CCl4,注射量为1.5 ml/kg(空白对照组注射等量橄榄油),每周1次,与此同时,RMD治疗组使用6.2 g/(kg·d)的剂量进行RMD溶液灌胃(空白对照组、模型组小鼠给予等体积的水灌胃)。治疗3周后处死小鼠,采集血液、肝组织样本,待用。
1.5 肝脏指数
小鼠腹腔注射CCl45周建立肝纤维化模型,RMD治疗3周后处死小鼠(空白对照组和治疗组n=10,模型组n=11),采集肝脏,测量小鼠肝脏指数(Liver index)。肝脏指数(%)=肝脏重量/小鼠体重×100%。
1.6 血清肝功能指标的检测
取小鼠血清按照肝功能生化检测试剂盒的说明检测血清中谷丙转氨酶(glutamic-pyruvic transaminase,ALT)和谷草转氨酶(glutamic oxalacetic transaminase,AST)的活性。
1.7 肝脏HYP含量测定
依照南京建成HYP测试盒(样本碱水解法)说明书进行操作,测定肝组织中HYP含量。
1.8 肝脏HE、Masson染色观察肝脏组织病理学变化及胶原分布
小鼠腹腔注射CCl45周建立肝纤维化模型,RMD治疗3周后处死小鼠(n=3),常规方法[11]对小鼠肝组织进行固定、包埋、切片,HE、Masson染色显示肝脏组织病理学变化及胶原分布情况。
1.9 免疫组织化学染色观察肝组织COL1A1和COL3A1的表达
小鼠肝组织常规石蜡切片,免疫组织化学染色观察COL1A1(一抗: 1∶300)和COL3A1(一抗: 1∶200)在肝组织的表达。
1.10 肝脏原位杂交检测Smad4的表达
原位杂交显示Smad4在肝组织的表达,杂交探针序列如下:5’-AATCCAGCACGGGGTTTCCTTGATGCTCTGCCTGGGGTAGTCT-3’,地高辛标记,锁核酸修饰。
1.11 Q-PCR检测肝组织COL1A1和COL3A1 mRNA表达
依照说明书使用TaKaRa RNAiso提取小鼠肝组织总RNA,NanoDrop 2000C超微量分光光度计测定其浓度、A260/280和A260/230比值。采用TaKaRa DRR036A逆转录试剂盒将总RNA逆转录成cDNA;根据美国国立生物技术信息中心(NCBI)公布的小鼠基因序列,应用Primer 5软件设计引物(表1)。目的基因mRNA表达量计算方法采用△△Ct法(以空白组动物的目的基因表达量为1,计算模型组、处理组动物相应基因的相对表达量)。

Tab. 1 Primer sequences used in Q-PCR in this study
1.12 Western blot检测小鼠肝组织α-SMA和TGF-β1的表达
依照Solarbio高效RIPA组织/细胞裂解液使用说明提取小鼠肝组织总蛋白,使用碧云天BCA蛋白浓度测定试剂盒测定提取蛋白浓度,Western blot检测小鼠肝组织α-SMA(一抗浓度:1∶1 000,二抗浓度:1∶3 000)及TGF-β1(一抗浓度:1∶1 000,二抗浓度:1∶5 000)的表达并对阳性条带进行灰度分析。
1.13 统计学处理
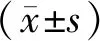
2 结果
2.1 实验小鼠肝脏组织形态学观察
CCl4诱导小鼠肝纤维化模型5周摘取肝脏,切片。HE染色显示空白对照组小鼠肝细胞呈多边形,核仁明显,胞质丰富;肝细胞以中央静脉为轴心呈放射状排列形成肝索;肝小叶结构完整(图1A,1C)。肝纤维化模型组小鼠肝细胞变性坏死,并有广泛的炎细胞浸润,肝索结构紊乱,肝小叶结构破坏(图1A’,1C’)。Masson染色显示空白对照组小鼠肝小叶结构完整,汇管区血管有少量胶原沉积(图1B,1D)。肝纤维化模型组小鼠肝内胶原纤维组织增生(图1B’,1D’),形成索条状,纤维间隔增厚,小鼠肝纤维化模型建立。

Fig. 1 Histological changes of hepatic fibrosis induced by CCl4 in mice for five weeks. ( HE, Masson)
2.2 RMD对纤维化模型小鼠肝功能的影响
如表2所示,CCl4造模8周,对比空白对照组,模型组小鼠肝脏指数(P<0.01)及血清中ALT(P<0.01)、AST(P<0.01)活性显著升高,表明CCl4可导致严重的肝损伤;RMD治疗3周能显著降低模型小鼠肝脏指数(P<0.01)、降低血清中ALT(P< 0.01)和AST(P<0.01)活性,有效改善肝纤维化模型小鼠的肝脏功能。

Tab. 2 RMD affected liver function in mice with liver fibrosis
2.3 RMD对纤维化模型小鼠肝纤维化发展进程的影响
相对于空白对照组,如图2所示:CCl4造模8周后可见小鼠肝细胞大量变性坏死,肝小叶间及汇管区胶原纤维增宽,分隔包绕肝实质,肝小叶结构破坏,形成假小叶(图2A);同时可见肝组织中HYP含量显著增高(表3,P<0.01),汇管区COL1A1、COL3A1大量表达(图2B),说明长时间腹腔注射CCl4可以推进肝纤维化发展至肝硬化状态。与模型组比较,RMD治疗组小鼠肝组织细胞坏死减少,排列相对有序,胶原沉积减少(图2A),同时可见肝组织中HYP含量降低(表3,P<0.05),肝组织切片COL1A1、COL3A1阳性表达减少(图2B)。Q-PCR检测小鼠肝组织COL1A1、COL3A1 mRNA表达水平(表3),结果显示:与空白组比较,模型组COL1A1、COL3A1表达水平表达升高(P<0.01);治疗组与模型组相比COL1A1、COL3A1表达水平降低,差异极显著(P<0.01)。

Tab. 3 RMD affected collagen deposition of liver fibrosis induced by CCl4 in Mice

Fig. 2 RMD affected collagen deposition of liver fibrosis induced by CCl4 in Mice
2.4 RMD对TGF-β1/Smads通路各关键因子表达水平的影响
如图3、表4所示:CCl4造模8周后,与空白组相比,α-SMA(P<0.01)、TGF-β1(P<0.01)蛋白表达水平显著升高;治疗组与模型组比较,α-SMA(P< 0.05)、TGF-β1(P<0.05)蛋白表达水平下降;原位杂交检测Smad4表达结果显示(图3C):相对于空白组,模型组小鼠肝组织Smad4阳性表达集中在在汇管区,表达升高;治疗组对比模型组,肝组织中Smad4阳性表达区域减少、表达强度减弱。
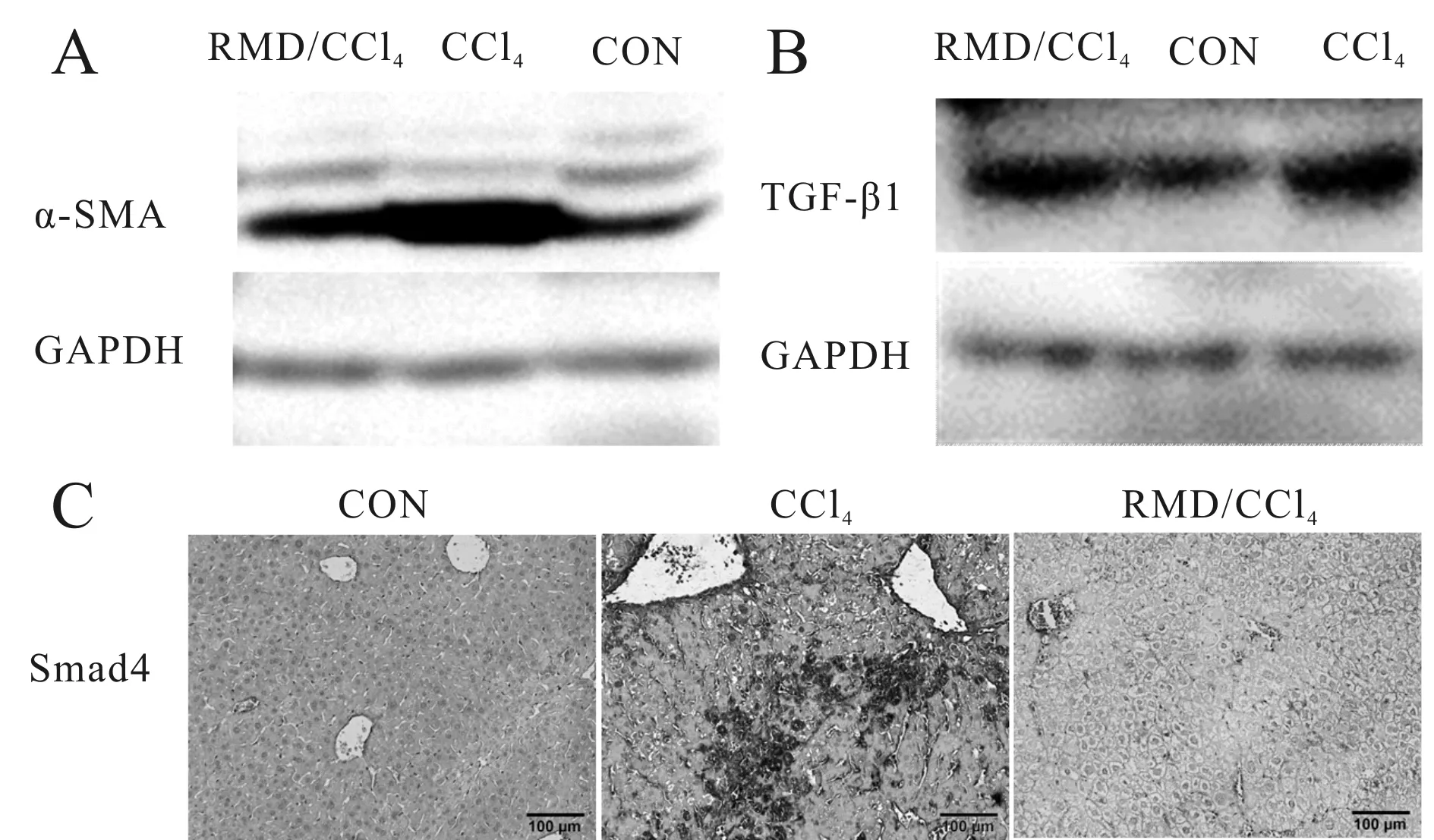
Fig. 3 Effects of RMD on expression of α-SMA, TGF-β1 and Smad4 in mice livers

Tab. 4 Corresponding densitometric analysis of representative immunoblots shown the ratios of expression levels of α-SMA and TGF-β1 to GAPDH in mice livers
3 讨论
CCl4因其诱导肝纤维化模型的高复制性、与人类纤维化病理变化的高相似性成为肝纤维化动物模型制作中应用最为广泛的化学药物[12,13]。近年来研究表明,相对进展期的肝纤维化在去除了损伤因素后是可逆的[14]。CCl4诱导肝纤维化成模后停止注射CCl4,模型动物肝脏纤维化可自然恢复[15];但若在治疗期间维持CCl4原剂量注射,易导致模型组小鼠基本生理状态差,甚至死亡。本实验在小鼠肝纤维化模型建立后,降低模型组与治疗组CCl4注射量(1.5 ml/kg,每周一次),发现肝纤维化持续进展,但是未发生动物的死亡,提示本造模方法可以防止小鼠肝纤维化自然恢复,又避免对模型小鼠过度损伤引发死亡,适用于检测目的药物对肝纤维化模型小鼠的治疗作用。
多年临床实践表明,RMD对慢性乙型肝炎所致肝纤维化有显著的阻断和防治作用[6,7],但具体作用机制有待进一步研究。课题组前期使用CCl4诱导昆明小鼠肝纤维化,并于纤维化初期(造模3周时)使用RMD灌胃治疗6周,结果显示RMD可以有效防治肝纤维化[8]。本实验使用CCl4诱导BALB/c雄鼠肝纤维化,在造模第5周,模型组小鼠肝组织出现典型的肝纤维化病理特征。再使用RMD灌胃治疗3周,相对于模型组,RMD可降低纤维化小鼠肝脏指数,减少肝脏细胞变性坏死,显著降低治疗组小鼠血清中ALT、AST活性,有效改善肝脏功能,发挥保肝护肝的作用;同时,我们还发现RMD可以抑制肝组织COL1A1、COL3A1的产生、降低肝脏组织HYP含量、抑制肝纤维化模型动物肝脏细胞外基质(extracellular matrix,ECM)沉积,改善肝脏纤维化程度及其组织结构形态。上述结果均证明了RMD不仅在肝损伤-纤维化诱导期,且在肝纤维化发生后亦可起到治疗作用。
已有的研究指出,肝纤维化形成与HSC的异常活化、增殖和ECM过度沉积相关。抑制HSC的过度活化,减少ECM的沉积成为业界防治肝纤维化的共识[1,2,14]。HSC异常活化是一个级联反应过程,有许多细胞信号传导通路涉及其中。目前认为,TGF-β1是诱发肝纤维化的核心细胞因子,TGF-β/Smad信号通路是肝纤维化进展中最具有代表性的通路之一[16]。研究发现:在各种损伤因子作用下,肝脏内TGF-β1表达大量增加,而后TGF-β1与靶细胞表面的TGF-β受体(TGF-β receptors,TβR)结合,激活下游信号传导分子果蝇抗生物皮肤生长因子蛋白(drosophila mothers against decapentaplegic protein,Smad)[17],活化的TβRⅠ与Smad2/3结合,使Smad2/3 MH2区SSXS结构域的特定ser磷酸化而活化,而后Smad2/3与胞膜上的TβRⅠ解离,进入HSC细胞浆内与Smad4结合成多聚体并转移入胞核,与靶基因结合形成转录复合体,激活目的基因的复制、转录,最终导致大量胶原产生,形成肝纤维化。与此同时,活化的HSC也能合成、分泌TGF-β1,使TGF-β1水平持续增高,进一步加速HSC激活、转化、合成胶原,ECM大量沉积,促使肝纤维化进行性加重。α-SMA是HSCs激活的标志物,其表达量反映活化HSCs的数量。故而,本实验选取HSC活化通路上3个关键节点:诱发信号TGF-β1[18]、效应信号Smad4[19]和活化信号α-SMA[20]作为衡量指标,检测RMD对肝纤维化小鼠TGF-β/Smads信号通路的影响。实验结果发现:使用RMD干预后,小鼠肝组织HSCs活化过程被抑制;小鼠肝组织TGF-β1表达水平显著降低;小鼠肝脏Smad4 mRNA表达阳性区域减少,说明TGF-β1/Smads信号通路受到抑制;表明RMD可以抑制肝纤维化组织内TGF-β1/Smads通路的传导。
综上所述,RMD通过遏制TGF-β1/Smads通路信号转导,抑制HSC过度活化和增殖,减少胶原的生成,降低肝脏ECM沉积,进而有效减缓CCl4诱发的肝损伤和肝纤维进程,改善肝功能。
