长链非编码RNA淋巴样增强因子1反义RNA 1调控miR-339-5p对骨肉瘤细胞增殖和凋亡作用的研究
2020-03-15孙杰万里王俊
孙杰 万里 王俊
(黄石市第二医院骨科,湖北黄石 435000)
骨肉瘤是儿童和青少年最常见的骨肿瘤,死亡率高[1]。虽然在过去的几十年里研究人员花费了大量的努力,但是患者的总体存活率仍然不令人满意[2]。因此,了解骨肉瘤的发病机制对改善患者预后有重要意义。新的证据表明,非编码RNAs,如长链非编码RNA(long non-coding RNAs,lncRNAs)、微小RNA(microRNAs,miRNAs/miR)等,在骨肉瘤的发病机制、诊断和预后调控中发挥重要作用[3]。lncRNAs是一类非蛋白编码转录产物,有多种生理和病理功能。miRNAs 是一类短链非编码RNA,通过诱导mRNA裂解或翻译抑制来调控基因表达,有高度保守性。同时,lncRNAs 通常通过海绵miRNAs 在各种疾病中发挥作用[4]。根据报道,lncRNA淋巴样增强因子1反义RNA 1(lymphoid enhancer-binding factor 1 anti⁃sense RNA 1,LEF1-AS1)在非小细胞肺癌组织中表达上调,并可促进癌细胞在体内和体外的增殖和迁移[5],LEF1-AS1 在口腔鳞状细胞癌组织和细胞系中高表达,发挥致癌作用[6]。前列腺癌中的LEF1-AS1表达上调,沉默的LEF1-AS1 抑制癌细胞的增殖、侵袭和迁移能力[7]。miR-339-5p 在骨肉瘤细胞中显著降低,并且其过表达可抑制骨肉瘤增殖,lncRNA核富含丰富的转录本1(nuclear paraspeckle assembly tran⁃script 1,NEAT1)通过抑制miR-339-5p而在骨肉瘤中充当癌基因[8]。然而LEF1-AS1在骨肉瘤中的生物学意义及机制尚不清楚。本研究旨在考察LEF1-AS1和miR-339-5p 在骨肉瘤组织中的表达,探讨LEF1-AS1 和miR-339-5p 在骨肉瘤U2OS 细胞增殖与凋亡中的生物学功能,以及LEF1-AS1 的分子调控机制,这可能有助于骨肉瘤的早期诊断和靶向治疗。
1 材料与方法
1.1 细胞与试剂
人骨肉瘤细胞U2OS 购自中国科学院上海细胞生物学研究所,DMEM 培养基购自美国Gibco 公司,实时荧光定量PCR(quantitative real-time polymerase chain reaction,qRT-PCR)相关试剂盒购自日本TaKa⁃Ra公司,细胞计数试剂盒8(cell counting kit-8,CCK-8)购自日本Dojindo 公司,细胞凋亡检测试剂盒购自美国Molecular Probes 公司,兔抗P21、含半胱氨酸的天冬氨酸蛋白水解酶3(cysteinyl aspartate specific proteinase 3,Caspase-3)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAP⁃DH)、羊抗兔IgG抗体购自英国Abcam公司。
1.2 临床组织标本
纳入研究的35 例骨肉瘤组织和瘤旁组织(距骨肉瘤部位至少3 cm 处)均来源于本院。骨肉瘤患者术前均未接受放、化疗。患者手术切除后立即将组织保存于液氮中。所有实验和方案获得患者的知情同意,并经医院伦理委员会批准。组织标本采用Trizol试剂进行总RNA的提取,之后用于qRT-PCR检测。
1.3 细胞培养与转染
细胞U2OS在37℃、5%CO2的培养箱中培养,所用培养基为DMEM 培养基,其中包含10%胎牛血清和1%青霉素/链霉素。miR-339-5p 模拟物、miR-339-5p 模拟物阴性对照(miR-NC)、miR-339-5p 抑制剂(anti-miR-339-5p)、抑制剂阴性对照(anti-miRNC)、LEF1-AS1过表达质粒(pcDNA3.1-LEF1-AS1)、过表达质粒(pcDNA3.1)、LEF1-AS1 小干扰RNA(si-LEF1-AS1)、小干扰RNA 阴性对照(si-NC)由上海Genepharma 公司合成。将细胞U2OS 接种到6 孔板中,并在融合70%时使用Lipofectamine 2000转染试剂进行转染。转染48 h后,收获细胞用于随后的分析。
1.4 qRT-PCR检测LEF1-AS1、miR-339-5p表达
以Trizol 试剂为基础的RNA 提取方案用于从组织或细胞中提取总RNA。按照制造商的说明,通过Prime Script 逆转录试剂盒合成cDNA。使用qRTPCR 试剂盒进行qRT-PCR 反应,2−ΔΔCt法用于量化LEF1-AS1、miR-339-5p表达,LEF1-AS1表达归一化为GAPDH,miR-339-5p 表达归一化为U6。引物序列:LEF1-AS1 5,-AAGGACGAGAGAAAAGCAC-3,(F)和5,-CACACAAAGGGGAAGACC-3,(R),GAP⁃DH 5,-AGCAAGAGCACAAGAGGAAG-3,(F)和5,-GGTTGAGCACAGGGTACTTT-3,(R),miR-339-5p 5,-ACACTCCAGCTGCGGTCCCTGTCCTCCAGGAG-3,(F)和5,-TGGTGTCGTGGAGTCG-3,(R),U6 5,-GCTTCGGCAGCACATATACTAAAAT-3,(F)和5,-CGCTTCACGAATTTGCGTGTCAT-3,(R)。
1.5 生物信息学预测和双荧光素酶报告实验
使用starBase(http://starbase.sysu.edu.cn/)工具通过生物信息学分析预测LEF1-AS1和miR-339-5p的假定结合位点。利用pGL3 载体构建靶向LEF1-AS1的野生型(WT)或突变型(MUT)荧光素酶报告基因。对于萤光素酶报告基因测定,使用Lipofectamine 2000转染试剂,在U2OS 细胞中共转染WT-LEF1-AS1 或MUT-LEF1-AS1 和miR-339-5p 模拟物或miR-NC。转染48 h 后,使用荧光素酶报告试剂盒分析各组荧光素酶活性。
1.6 CCK-8检测细胞增殖
根据制造商的方案,使用CCK-8 试剂盒测定细胞增殖。将转染后的细胞U2OS(2×104个/孔)接种到96孔板中,在48 h时加入10µl CCK-8。在37℃下孵育4 h 后,使用Bio-Rad 3550 微孔板读数器计算出450 nm 处的吸光度(OD)值。细胞存活率(%)=实验组OD值/对照组OD值×100%。
1.7 克隆形成实验检测细胞克隆能力
将转染后的U2OS 细胞接种到6 孔板(500 个细胞/孔),并在37℃、含5%CO2的潮湿环境中培养。每2 d 更换一次培养基。2 周后,出现肉眼可见的细胞克隆时终止培养,将U2OS细胞用PBS洗涤2次,在甲醇中固定40 min,在室温下用1%结晶紫染料染色5 min,并用水漂洗2次,统计细胞克隆形成数。
1.8 流式细胞术检测细胞凋亡
根据制造商的规程,用Annexin-V-FITC 对细胞进行染色。将3×105个U2OS细胞在6孔板中培养,收获并用PBS洗涤。然后,将其重悬于100 μl Annexin-V结合缓冲液中,在室温下与5 μl Annexin-V-FITC孵育15 min,并用碘化丙锭复染(终浓度1 μg/ml)。黑暗中于室温下孵育15 min后,通过流式细胞仪进行分析。
1.9 免疫印迹实验检测P21和Caspase-3蛋白表达
通过RIPA 裂解缓冲液从转染后的U2OS 细胞中提取总蛋白。通过SDS-PAGE 分离等量的蛋白质(20 μg),并转移到聚偏二氟乙烯膜上。膜在37℃用5%脱脂奶封闭2 h 后,与P21、Caspase-3、GAPDH 一抗(1∶1000稀释)于4℃孵育过夜,之后与辣根过氧化物酶标记的羊抗兔IgG 二抗(1∶5000 稀释)在37℃放置2 h。使用ECL检测试剂使条带可视化。通过使用Image J 软件将P21 和Caspase-3 蛋白条带的灰度与GAPDH的灰度进行比较,来确定相对表达。
1.10 统计学方法
采用SPSS 22.0 进行统计分析。计量资料以均值±标准差表示,组间比较采用t检验,多组间比较采用单因素方差分析,组间多重比较采用SNK-q检验,以P<0.05为差异有统计学意义。
2 结果
2.1 LEF1-AS1、miR-339-5p 在人骨肉瘤组织和瘤旁组织中的表达
qRT-PCR 检测结果显示,35 例骨肉瘤组织中的LEF1-AS1 表达量高于瘤旁组织,而miR-339-5p 表达量低于瘤旁组织(P<0.001,表1)。
2.2 抑制LEF1-AS1对细胞U2OS增殖、凋亡的影响
在细胞U2OS 中转染si-LEF1-AS1 发现LEF1-AS1 表达量明显低于转染si-NC 细胞(P<0.001,表2),表明成功建立抑制LEF1-AS1的细胞。对细胞增殖的检测结果显示,与si-NC组比较,抑制LEF1-AS1显著减少细胞U2OS 的存活率和克隆形成数(P<0.001,表2,图1C)。流式细胞术检测结果显示,抑制LEF1-AS1 的细胞U2OS 凋亡率明显高于si-NC 组(P<0.001,表2,图1A)。免疫印迹实验检测结果发现,与si-NC组比较,抑制LEF1-AS1显著提高P21和Caspase-3蛋白水平(P<0.001,表2,图1B)。
2.3 LEF1-AS1靶向、调控miR-339-5p
starBase 网站预测显示,LEF1-AS1 与miR-339-5p 有靶向结合位点(图2)。双荧光素酶报告实验表明,与miR-NC 组比较,miR-339-5p 明显降低WTLEF1-AS1 的荧光素酶活性(P<0.001),但不影响MUT-LEF1-AS1 的荧光素酶活性(表3)。qRT-PCR检测数据发现,转染pcDNA3.1-LEF1-AS1 比转染pcDNA3.1 明显减少miR-339-5p 表达量,转染si-LEF1-AS1 较转染si-NC 显著增加miR-339-5p 表达量(P<0.05,表4)。
2.4 抑制miR-339-5p 能减弱抑制LEF1-AS1 对细胞U2OS增殖、凋亡的作用
与si-LEF1-AS1和anti-miR-NC共转染比较,si-LEF1-AS1和anti-miR-339-5p共转染明显减少细胞U2OS 中miR-339-5p 表达量、P21、Caspase-3 蛋白表达量、细胞凋亡率,显著增加U2OS 细胞存活率和克隆形成数(P<0.05,表5,图3)。
2.5 过表达miR-339-5p 能增强抑制LEF1-AS1 对细胞U2OS增殖、凋亡的作用
与si-LEF1-AS1 和miR-NC 共转染比较,si-LEF1-AS1和miR-339-5p共转染明显增加miR-339-5p 表达量、P21、Caspase-3 蛋白表达量和凋亡率,显著减少细胞U2OS 存活率和克隆形成数(P<0.001,表6,图4)。
.
表1 LEF1-AS1、miR-339-5p在人骨肉瘤组织和瘤旁组织中的表达()
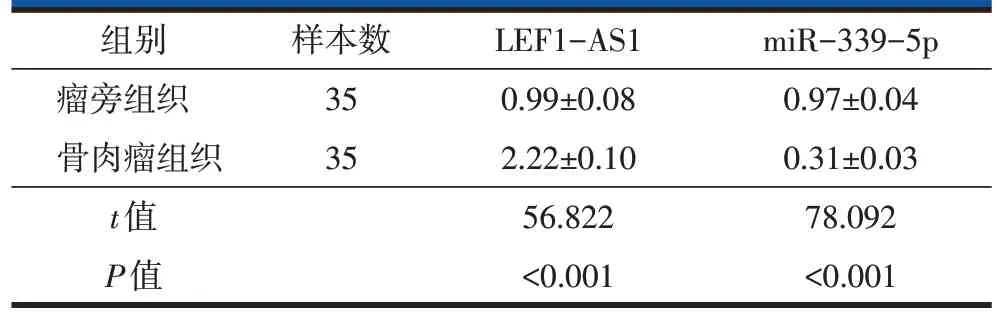
表1 LEF1-AS1、miR-339-5p在人骨肉瘤组织和瘤旁组织中的表达()
表2 抑制LEF1-AS1对细胞U2OS增殖、凋亡的影响(,n=9)
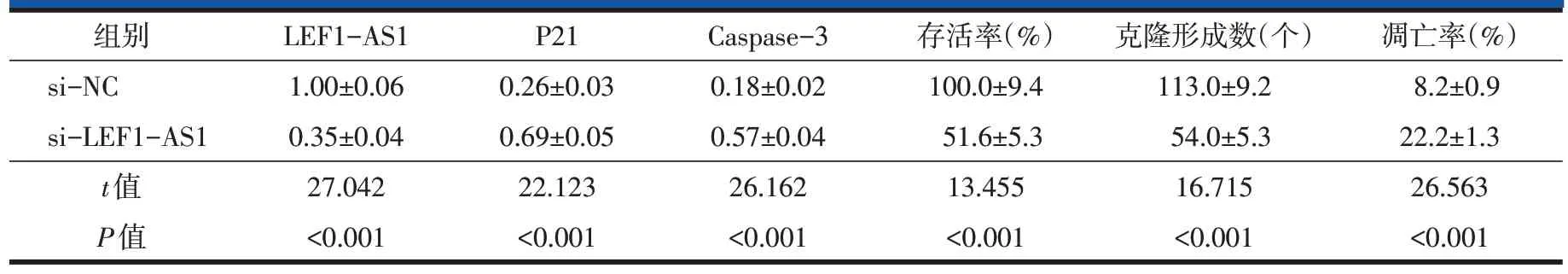
表2 抑制LEF1-AS1对细胞U2OS增殖、凋亡的影响(,n=9)
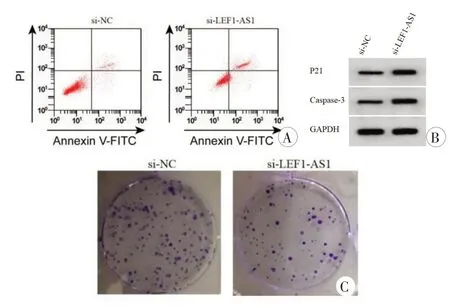
图1 抑制LEF1-AS1对U2OS凋亡集落形成P21、Caspase-3的影响

图2 LEF1-AS1靶向miR-339-5p
表3 双荧光素酶报告实验(,n=9)
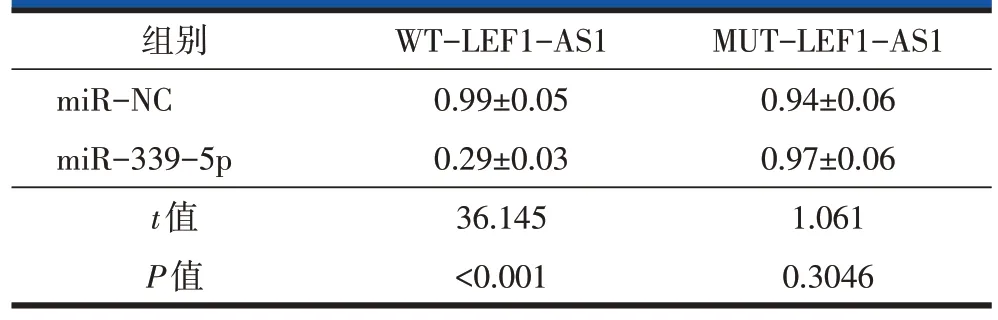
表3 双荧光素酶报告实验(,n=9)
表4 LEF1-AS1调控miR-339-5p的表达(,n=9)
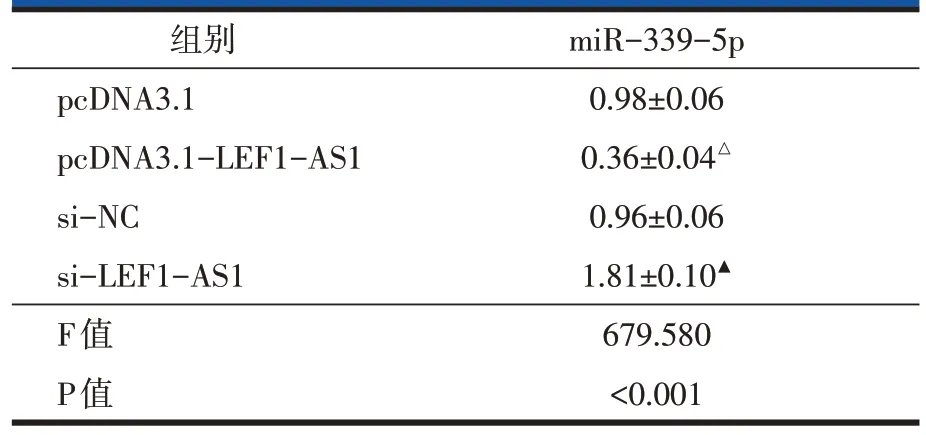
表4 LEF1-AS1调控miR-339-5p的表达(,n=9)
注:与pcDNA3.1组比较,△P<0.05;与si-NC组比较,▲P<0.05
3 讨论
lncRNAs 是一组不编码蛋白质的功能RNA。尽管缺乏蛋白编码能力,但lncRNAs几乎在关键生物学和病理过程的各个方面都发挥了作用[9]。最近的研究证实,lncRNAs在骨肉瘤中的表达失调与疾病的进展、转移和预后有关[10],可以作为肿瘤抑制基因和致癌基因发挥作用,如lncRNA 重编程调节器(regulator of reprogramming,ROR)[11]、生长停滞特异性转录因子5(growth arrest specific 5,GAS5)[12]、FOXD2-AS1(fork⁃head box D2 adjacent opposite strand RNA1)[13]。已有证据表明,LEF1-AS1的异常表达在肿瘤发生中起重要作用。例如,与匹配的正常组织相比,食管鳞状细胞癌组织中的LEF1-AS1 明显上调,LEF1-AS1 水平升高预示着食管鳞状细胞癌患者的预后不良[14]。LEF1-AS1在肺癌中被上调,其过表达导致细胞增殖和侵袭的增强[15]。胶质母细胞瘤LEF1-AS1表达明显上调,敲除LEF1-AS1可显著抑制胶质母细胞瘤细胞的恶性生物学行为,包括增殖和侵袭,并促进细胞凋亡[16]。这些结果显示,LEF1-AS1 可能是肿瘤发生发展过程中的致癌因子。本研究qRT-PCR 检测发现,与瘤旁组织比较,骨肉瘤组织中的LEF1-AS1表达量明显升高。功能实验结果表明,抑制LEF1-AS1明显降低骨肉瘤细胞U2OS的存活率和克隆形成数,并显著提高凋亡率、P21 和Caspase-3 蛋白水平。说明与前述研究[14-16]一致,LEF1-AS1 同样在骨肉瘤中扮演着癌基因的角色,下调其表达有抑制骨肉瘤细胞增殖,以及促进细胞凋亡的作用,LEF1-AS1 可能是骨肉瘤的关键靶标。
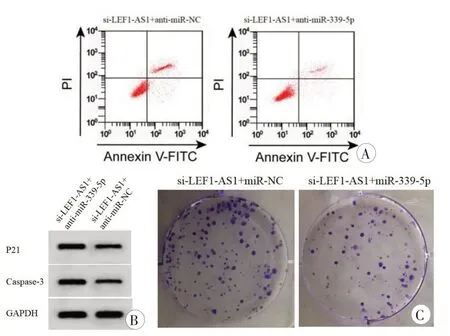
图3 抑制miR-339-5p能逆转干扰LEF1-AS1对细胞U2OS凋亡集落形成及P21、Caspase-3的影响
表5 抑制miR-339-5p能逆转干扰LEF1-AS1对细胞U2OS增殖、凋亡的作用(,n=9)

表5 抑制miR-339-5p能逆转干扰LEF1-AS1对细胞U2OS增殖、凋亡的作用(,n=9)
表6 过表达miR-339-5p能增强抑制LEF1-AS1对细胞U2OS增殖、凋亡的作用(,n=9)
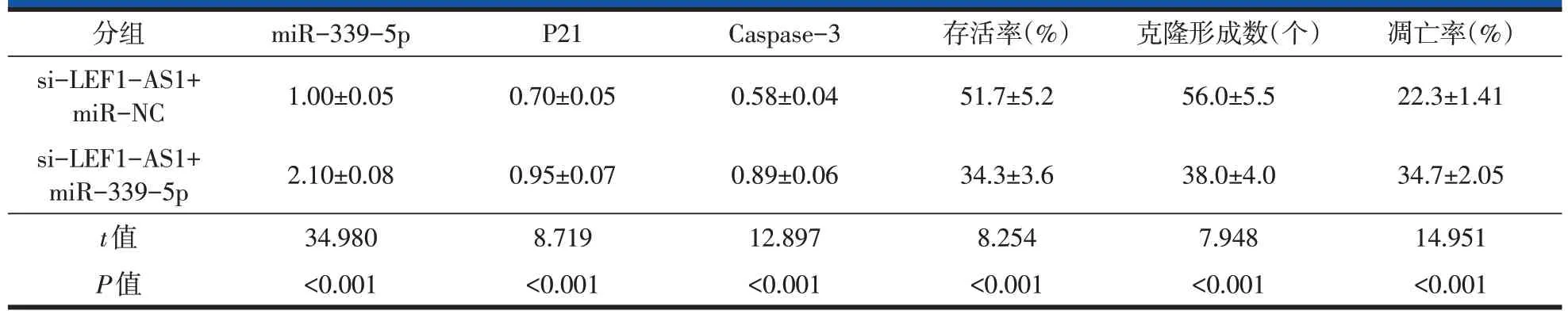
表6 过表达miR-339-5p能增强抑制LEF1-AS1对细胞U2OS增殖、凋亡的作用(,n=9)
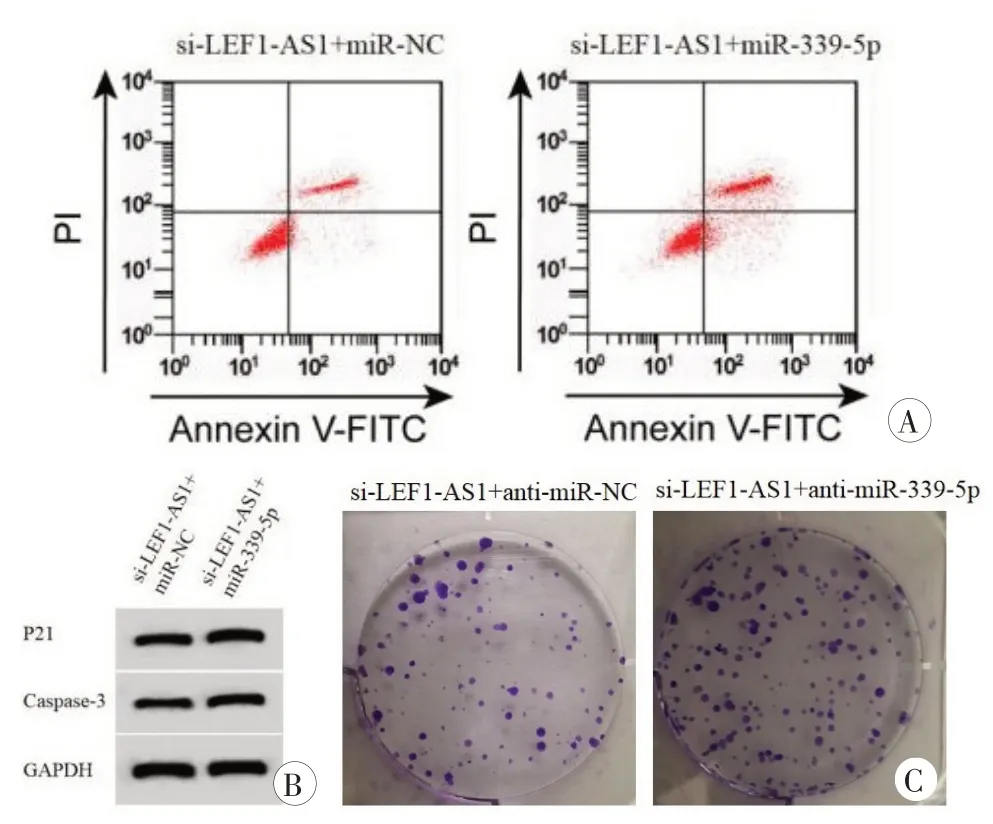
图4 过表达miR-339-5p能增强抑制LEF1-AS1对细胞U2OS凋亡集落形成及P21、Caspase-3的影响
lncRNAs 可以作为骨肉瘤的必要的生物标志物和治疗靶点,发挥竞争性内源性RNAs(competing en⁃dogenous RNAs,ceRNAs)的功能,使miRNAs 能够抑制mRNA 的表达[17],如MAFG 反义RNA1(MAF BZIP Transcription Factor G antisense RNA 1,MAFG-AS1)对miR-339-5p 的靶向调控[18]。miRNAs 的失调在各种癌症中普遍存在,包括骨肉瘤[19]。miR-339-5p 已被证实在各种癌症中起着抑癌作用。根据报道,肺腺癌[20]、卵巢癌[21]、胰腺癌[22]中的miR-339-5p 表达水平降低,上调miR-339-5p可抑制肺腺癌[20]、卵巢癌[21]细胞的侵袭和迁移,miR-339-5p 低表达是胰腺癌[22]细胞侵袭和迁移能力增强的主要因素。本研究骨肉瘤组织中miR-339-5p表达显著下调,与Zhang等[8]的报道相同,miR-339-5p 可能抑制骨肉瘤进展。生物信息学预测显示,LEF1-AS1 可能靶向miR-339-5p,随后的双荧光素酶报告实验证实了这一观点。另外还发现,干扰LEF1-AS1 对细胞U2OS 增殖的抑制作用,和其对细胞凋亡的促进作用,可被抑制miR-339-5p 表达所减弱,或被过表达miR-339-5p 所增强,说明miR-339-5p是LEF1-AS1的功能性靶基因,LEF1-AS1 影响骨肉瘤细胞增殖和凋亡的功能是通过靶向调控miR-339-5p的表达而实现的。
综上所述,lncRNA LEF1-AS1 在骨肉瘤组织中表达上调,抑制其表达可有效抑制骨肉瘤细胞的增殖,以及促进骨肉瘤细胞凋亡,作用机制与靶向调控miR-339-5p 的表达有关,为骨肉瘤提供了潜在的生物标志物。
