复合菌剂防治草莓根腐病的效果研究
2020-03-15王梦园杜延全蔡威威王子浩朱建强
王梦园, 杜延全, 蔡威威, 王子浩*, 朱建强*
(1.长江大学农学院, 湖北 荆州 434025; 2.中化农业(临沂)研发中心有限公司, 山东 临沂 276000)
草莓在世界水果产业中具有重要地位。近年来,我国草莓种植面积扩增,种植方式主要以日光温室和塑料大棚为主,高湿和连作的特点使土传病害成为草莓减产的重要因素,严重时几乎绝产[1]。草莓根腐病是一种常见的土传病害,其致病真菌多达20个属,包括拟盘多毛孢菌属(Pestalotiopsissp.)、镰刀菌属(Fusariumsp.)、炭疽菌属(Colletotrichumsp.)、丝核菌属(Rhizoctoniasp.)和疫霉菌属(Phytophthorasp.)等[2-3]。由于致病菌的多样性,且其发病症状具有滞后性,根部腐烂时再进行防治效果不佳,增加了实际生产中的防治难度。随着生态农业、绿色农业的发展,各国对农药残留问题进行严格把关和控制,采用常规化学药剂进行防治的方法已经逐渐显示出弊端[4],生物防治因具有防治效果好、无污染、成本低、可持续发展等优点受到了越来越多的关注。生防菌主要通过竞争生态位、代谢抗菌物质、拮抗作用和诱导植物产生抗性等方式来抑制植物病原体,从而达到防治植物病害的效果[5]。相对于单一生防菌株,生防菌组合可功能互补,更好地避免环境适应性差、局限性强、需活菌量大和防治效果不稳定等问题[6-9],并且生防菌之间的相互作用能够在提高防控植物病害效果的同时,促进植物生长[10-13]。
针对山东省临沂市莒南县草莓大棚常见的草莓根腐病,本研究从大量发病草莓植株根部分离出同一种病原菌——新棒状拟盘多毛孢(Neopestalotiopsisclavispora),通过实验室培养对峙方法初选拮抗菌,并采用盆栽和大田试验验证复合菌株的抗病效果。目前关于N.clavispora引起草莓根腐病的防治研究尚未见报道,草莓根腐病的生物防治研究方面也只是单一菌株的研究与开发[14-17],而对于利用培养混合菌提高草莓根腐病生防效果的研究尚未见报道。本研究通过室内与大棚试验结合的方式筛选出贝莱斯芽胞杆菌(Bacillusvelezensis-17)、解淀粉芽胞杆菌(Bacillusamyloliquefacen-27)和枯草芽胞杆菌(Bacillussubtilis-Y1-7)进行复配,考察复合菌对草莓根腐病的防治效果,以期为草莓根腐病生防菌资源的深入研究和开发提供科学依据。
1 材料与方法
1.1 试验材料
1.1.1供试草莓品种与菌株 供试草莓品种为甜查理(Sweet Charlie)和久香(Jiu Xiang)。选择的目标病原菌为新棒状拟盘多毛孢(N.clavispora,分离于发病草莓植株根部),其他病原菌有:茄腐镰刀菌(Fusariumsolanum,分离于发病草莓植株根部)、草莓灰霉病菌(BotrytiscinereaPers.)、苹果轮纹病菌(Botryosphaeriadothidea)、黄瓜霜霉病菌(Pseudoperonosporacubensis)、西瓜枯萎病菌(F.oxysporum)、小麦赤霉病菌(F.graminearum)均由中化农业(临沂)研发中心微生物实验室鉴定保存。3种拮抗微生物中,贝莱斯芽胞杆菌(Bacillusvelezensis-17,简记为“17#”)和解淀粉芽胞杆菌(Bacillusamyloliquefacen-27,简记为“27#”)分别分离于临近发病区的健康草莓根系土壤,保存于中化农业(临沂)研发中心微生物实验室;枯草芽胞杆菌(Bacillussubtilis-Y1-7,简记为“Y1-7”),由沈阳化工研究院生物技术重点实验室提供。
1.1.2培养基制作 制作培养基的试剂购于北京索莱宝科技有限公司,用LDZX-75KBS型高压蒸汽灭菌锅(上海申安医疗器械厂)于121 ℃高压灭菌20 min。
PDA培养基:马铃薯200.0 g、葡萄糖20.0 g、琼脂15.0~20.0 g、去离子水1 000 mL,pH 7.0。
LB(Luria-Bertani)液体培养基(1 000 mL):酵母粉5.0 g、胰蛋白胨10.0 g、氯化钠10.0 g,pH 7.0。
LB固体培养基(1 000 mL):酵母粉5.0 g、胰蛋白胨10.0 g、氯化钠10.0 g、琼脂粉15.0 g,pH 7.0。
改良NA培养基:葡萄糖10.0 g、牛肉膏3.0 g、酵母粉0.5 g、蛋白胨5.0 g、琼脂20.0 g,pH 7.0。
1.1.3溶液配制 配制试验溶液所用的化学试剂由国药集团化学试剂有限公司提供。
Salkowski显色液的配置:将1 mL 0.5 mol·L-1的FeCl3溶液加入到50 mL 35%的高氯酸中;CAS(chrome azurol sulphonate,铬天青)检测液的配置:①将0.07 g的CAS溶解于50 mL的去离子水中,再将1 mmol·L-1的FeCl3溶液加入10 mL,记为溶液A;②把0.06 g的HDTMA(hexadecyltri-methylammonium bromide,溴化十六碳烷基三甲胺)充分溶解于40 mL的超纯水中,记为溶液B;③将A溶液沿着烧杯壁缓缓加入到B溶液中,二者混合均匀,即为CAS检测液。
1.2 试验设计
1.2.1拮抗菌株的拮抗性能及抑菌谱测定 菌株培养在GXZ-280C-LED型生化培养箱(宁波江南仪器厂)中。采用平皿对峙培养法(五点法)分别测定生防菌株17#、27#和Y1-7对病原菌N.clavispora的拮抗能力。在25 ℃恒温培养6 d的草莓根腐病菌菌落边缘用打孔器打取直径为8 mm的菌饼,放置于新的PDA平皿(d=90 mm)中心,用接种针挑取活化于LB培养基中的生防菌单菌落点接于距平皿中心4 cm的4个角点上,以只接病原菌的平皿作为对照,25 ℃恒温培养。待对照平皿内的病原真菌长满整个平皿时,测量处理平皿的抑菌带宽,每个处理5次重复。3株拮抗菌的抑菌谱测定则将病原菌分别换成茄腐镰刀菌、草莓灰霉病菌、苹果轮纹病菌、黄瓜霜霉病菌、西瓜枯萎病菌、小麦赤霉病菌,采用平皿对峙法评价其抗病广谱性。
1.2.2供试拮抗菌种间相互拮抗性试验 为了避免相互拮抗的菌株复配后相互干扰,抑制各自的防病或促生效果,将3株供试生防菌株分别接种到LB液体培养基中,恒温水浴振荡器中30 ℃、180 r·min-1震荡培养24 h,取100 μL均匀涂布于LB固体培养基上,待菌液干燥后,在平皿边缘位置对称放置无菌的滤纸片。在滤纸片上滴加10 μL其他待复配菌液,开盖待菌液干燥后,转移平板至30 ℃生化培养箱中培养,观察有无抑菌圈产生,以确定可以复配的菌剂组合。
1.2.3拮抗菌胞外粗提物对草莓根腐病菌Neopestalotiopsisclavispora的抑制作用 采用HCl沉淀法[18]对3株拮抗菌的拮抗物质进行提取:将3株拮抗菌活化后,按5%的比例接入液体LB培养基中(装液量为三角瓶总容量的5%),32 ℃、180 r·min-1摇床发酵培养20 h。待拮抗菌培养液培养结束后放入灭菌离心管中10 000 r·min-1离心20 min,收集上清液,用6 mol·L-1的HCl调至上清液pH至2.0,放入4 ℃冰箱静置过夜后取出,放入离心机中10 000 r·min-1离心20 min,去除上清液,向沉淀中缓慢加入pH 7.2的甲醇,用无菌棒搅动直至沉淀被完全溶解,记录消耗甲醇体积,3株拮抗菌的甲醇用量保持一致,在4 ℃的冰箱中放入8 h后取出10 000 r·min-1离心10 min,将上清液收集起来过0.22 μm的滤膜除菌,放入-20 ℃的冰箱保存备用。
拮抗菌胞外粗提取物的拮抗作用:用打孔器在25 ℃恒温培养6 d的草莓根腐病菌菌落边缘打取直径为8 mm的菌饼,放置于新的PDA平皿(d=90 mm)中心,在距病原菌中心3 cm处四周放置4个直径为8 mm的无菌滤纸片。吸10 uL胞外粗提取物加至滤纸片上,从而对其拮抗效果进行检测。设置对照培养皿中无菌滤纸片上加pH 7.2的甲醇10 μL,每个处理5次重复。
1.2.4拮抗菌株促生物质检测 ①吲哚乙酸(indoleacetic acid, IAA)检测。将3株拮抗菌株接种于2 mL NA培养液中培养过夜,然后将种子液转入含有5 mmol·L-1色氨酸的NA培养液中,于30 ℃、170 r·min-1振荡培养48 h。然后于7 000 r·min-1离心20 min,收集上清液。于1 mL的上清液中,加入2 mL salkawski显色剂,30 ℃显色30 min,若有粉红色产生,则说明该菌株能产生IAA[19],以不加菌的含有5 mmol·L-1色氨酸的NA培养液作为对照,重复3次。
②铁载体(siderophores)检测。采用Schwyn等[20]的方法对该菌株进行铁载体检测。将2 mL CAS显色液加入到2 mL无菌滤液中,室温显色,若颜色由青蓝色变为黄色,则说明有铁载体产生(在3 h内无颜色变化说明无铁载体产生),以不加菌的培养基作对照试验,重复3次。
1.2.5供试菌种对草莓根腐病Neopestalotiopsisclavispora的防治效果 为验证试验结果设计盆栽试验,在土培条件下比较单菌落与复合菌落对草莓根腐病N.clavispora的防治效果及对草莓植株的促生效果。供试土壤为山东省临沂市河东区地表土(≤10 cm),土壤基本理化性状指标:pH 6.4、碱解氮12.21 mg·kg-1、有效磷42.24 mg·kg-1、速效钾85.57 mg·kg-1、有机质8.81 g·kg-1,121 ℃ 灭菌3 h。栽培所用的盆钵盆口直径为28 cm、盆底直径20 cm、盆高30 cm。选择草莓品种为甜查理,选取生长一致的匍匐茎幼苗,每盆栽种一株,待缓苗15 d后进行生防菌防治效果验证盆栽实验。对幼苗进行刀片伤根处理(伤根处理则为每株割断两根须根),生防菌发酵液和病原菌孢子悬液均采用灌根方式。菌液浓度和接种时间见表1。实验设置14个处理组,每组处理10株草莓苗,相当于10次重复。每个处理统一管理,接菌10 d后开始进行病害观察,及时做好记录,30 d 后进行病害统计及相关生理指标测定。生理指标测定包括植株的株高和叶片面积。其中叶片面积检测选择草莓心叶外第三片叶子。草莓根腐病病情统计采用Vestberg等[21]的方法,分为6级:0级为整株正常;1级为根系发病率≤30%,叶片正常;2级为30%<根系发病率≤60%,叶片正常;3级为60%<根系发病率≤80%,叶片变黄;4级为根系发病率>80%,叶片枯萎;5级为整株死亡。
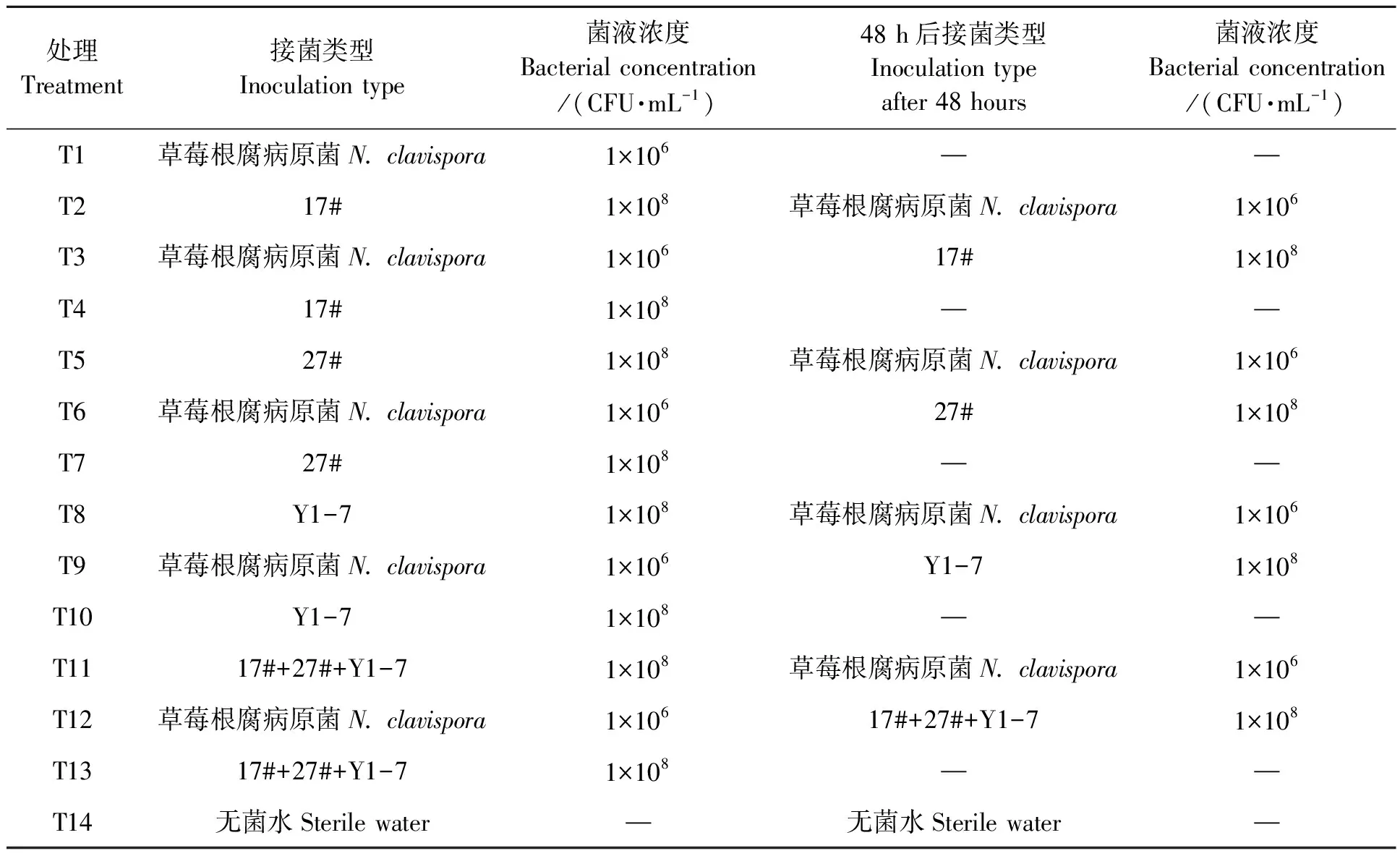
表1 不同拮抗菌对草莓根腐病Neopestalotiopsis clavispora防治的盆栽试验
病情指数=∑(病害的级别×该级别的植株数)/(总株数×病害的最高级别)×100
防治效果=(对照发病指数-处理发病指数)/对照发病指数×100%
1.2.6田间生防试验 试验在山东省临沂市莒南县草莓大棚进行,分析不同菌剂对草莓植株的防病促生作用和对草莓果实产量的影响。试验共设置2个棚区(A棚和B棚),这2个试验大棚已连作草莓6年,草莓根腐病发病率较高,供试病原菌N.clavispora分离自这2个试验大棚。A棚土壤pH 6.0,土壤碱解氮为139.84 mg·kg-1,有效磷为133.25 mg·kg-1,速效钾为568.32 mg·kg-1,有机质为24.45 g·kg-1;B棚土壤pH 5.71,土壤碱解氮为158.89 mg·kg-1,有效磷为140.5 mg·kg-1,速效钾为462.91 mg·kg-1,有机质为25.22 g·kg-1。2个试验棚内各设有4个处理组(M1、M2、M3和M4),1个对照组(CK)。M1处理为移栽前一周施用贝莱斯芽胞杆菌17#,M2处理为移栽前一周施用解淀粉芽胞杆菌27#,M3处理为移栽前一周施用枯草芽胞杆菌Y1-7,M4处理为移栽前一周施用复合菌剂(17#+27#+Y1-7),对照CK为不加菌处理。试验组所施用菌剂有效活菌数含量为500亿CFU·g-1,菌剂用量为6 kg·hm-2。4个处理组和1个对照组各设6个小区,即每个处理6次重复。3垄为一个小区,A棚每个小区面积为7.6 m×3.0 m=22.8 m2,B棚每个小区面积为7.2 m×3.0 m=21.6 m2,小区之间空出1垄作为保护行。A棚种植草莓品种为久香,B棚种植品种为甜查理,栽种前统一施肥覆膜,后期统一管理。
在草莓生长期内2个棚分别随机测产6次,病害调查于整个生长期跟踪记录,统计方法参考1.2.5中的方法。
1.3 数据处理
采用DPS 7.05软件对试验数据进行单因素方差分析,Duncan新复极差法检验差异显著性。采用 Excel 2003软件进行数据处理。
2 结果与分析
2.1 拮抗菌对Neopestalotiopsis clavispora等病原菌的平板生长抑制效果
从室内平皿对峙结果(图1)上看,拮抗菌株17#、27#和Y1-7对7种病原菌有不同程度的抑制作用。3株拮抗菌中,贝莱斯芽胞杆菌17#和解淀粉芽胞杆菌27#对各个供试病原菌的抑制程度差异不显著。而枯草芽胞杆菌Y1-7对草莓灰霉病原菌的抑制作用小于17#和27#,对小麦赤霉病原菌的抑制作用大于17#和27#。此结果说明,3株拮抗菌具有一定的广谱抗病功能,且对灰霉病病原菌这种通过空气、水等传播的病害同样有抑制作用,具有一定的开发应用价值。实际生产过程中,农户可根据病原菌的传播途径进行土施或喷施。由图2可以看出,拮抗菌导致病原菌菌丝畸形,菌丝分支增多,菌丝弯曲、畸形,生长停滞。初步判定供试生防菌对目标病原菌有抑制作用。
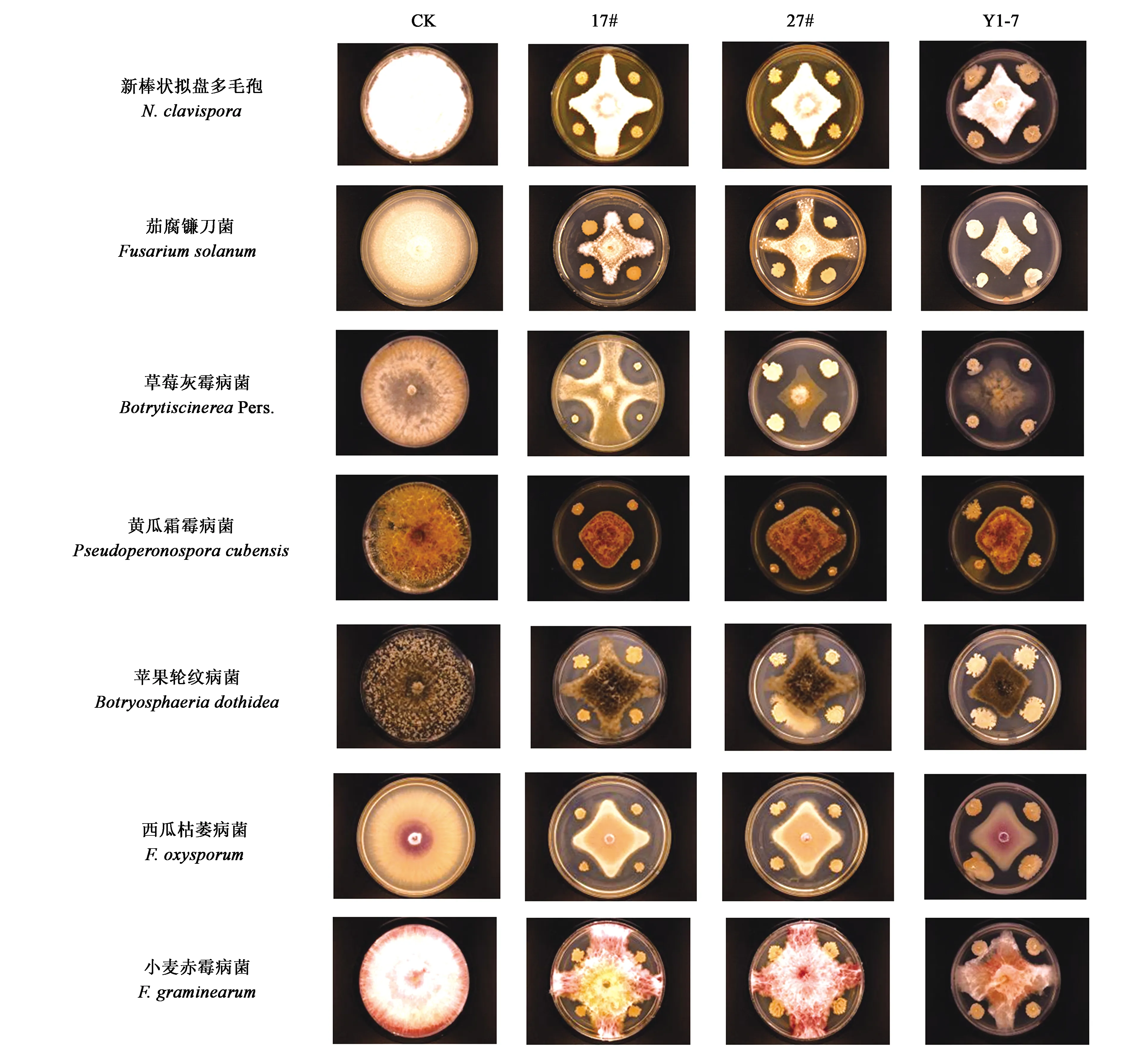
图1 拮抗菌对7种病原菌的抑制作用
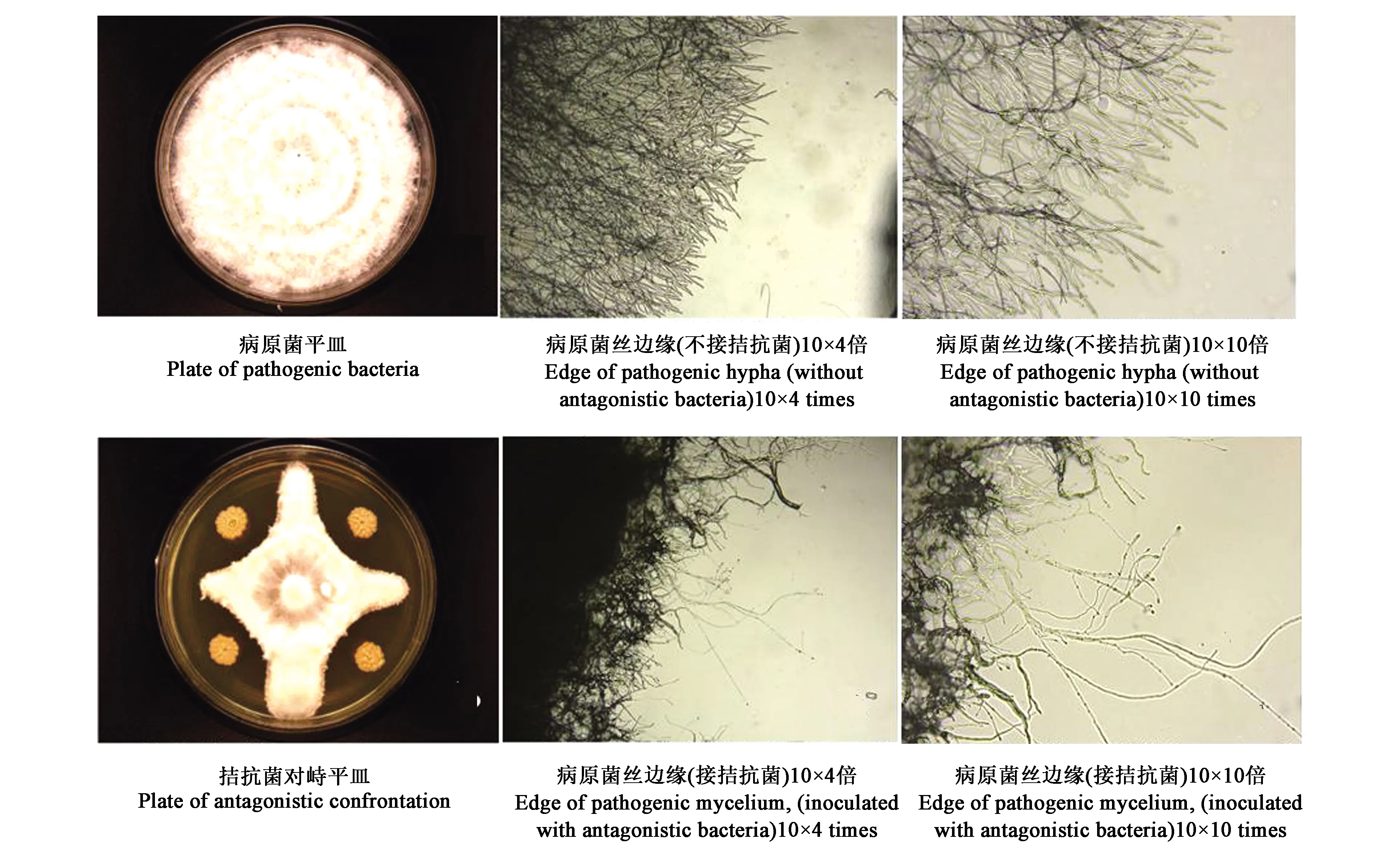
图2 病原菌丝形态镜检
2.2 供试拮抗菌种间相互拮抗性
由图3可知,3株拮抗菌17#、27#和Y1-7互不拮抗,可以避免复合菌之间相互竞争,相互抑制,影响其自身促生或抗病性这一问题。
A:17#与27#、Y1-7的拮抗性;B:27#与Y1-7的拮抗性。
2.3 拮抗菌胞外粗提取物对病原菌Neopestalotiopsis clavispora的抑制作用
从图4可以看出,利用HCl沉淀法能成功地从拮抗菌株发酵液中提取出抗病原真菌的活性物质。由试验观察得出,拮抗物质粗提取物对病原菌N.clavispora的拮抗作用不会随着时间的推移而减小,原因可能是抑菌物质不易被病原菌分解,其结果验证了生防菌株的拮抗效果。从图4还可以看出,相比于单株拮抗菌粗提取物的拮抗性,复合拮抗菌的粗提取物对病原菌N.clavispora的拮抗效果更好。
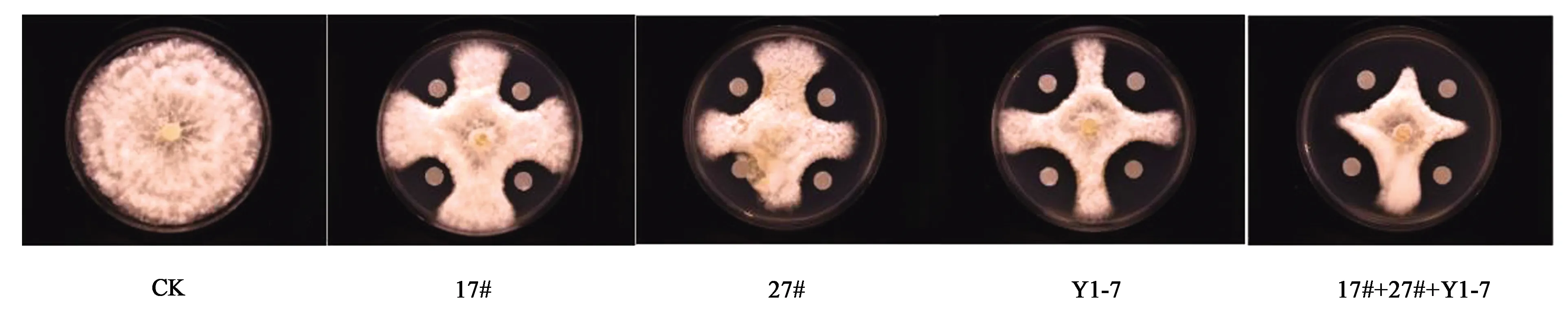
图4 拮抗菌胞外粗提取物对病原菌Neopestalotiopsis clavispora的抑制作用
2.4 拮抗菌株促生物质检测结果
图5显示,向供试菌株的滤液中加入salkawski显色剂后,颜色开始时为浅黄色,而后逐渐显粉红色,说明供试拮抗菌株均可产生吲哚乙酸(IAA),而Y1-7产IAA的量高于其他菌株。向滤液中加入CAS显色液后,室温静置1 h,供试拮抗菌株的滤液中产生絮状沉淀且颜色发生改变,由蓝绿色渐变为浅黄色,而对照颜色无明显变化,这说明3株拮抗菌均能产生铁载体,拮抗菌17#产铁载体的量高于其他菌株。此结果为供试菌株可作为促生菌的开发提供了科学依据。

图5 拮抗菌铁载体和吲哚乙酸的显色图
2.5 供试菌种对草莓根腐病Neopestalotiopsis clavispora的防治效果
由表2可知,同一株生防菌在种植过程中对目标病原菌N.clavispora的防治效果与接种时间有关,生防菌比病原菌早48 h接种可提高生防菌的防治效果8%~13%。本研究中,通过比较草莓植株的株高与叶面积,可知拮抗菌17#、27#和Y1-7具有一定的促生效果,印证了接抗菌促生物质检测结果。所有处理中,防病抗病和促生效果最好的是复合拮抗菌处理,其防治效果高达73.68%,相比于无菌水处理和单一菌株处理,对草莓株高的促进作用达到了极显著水平。
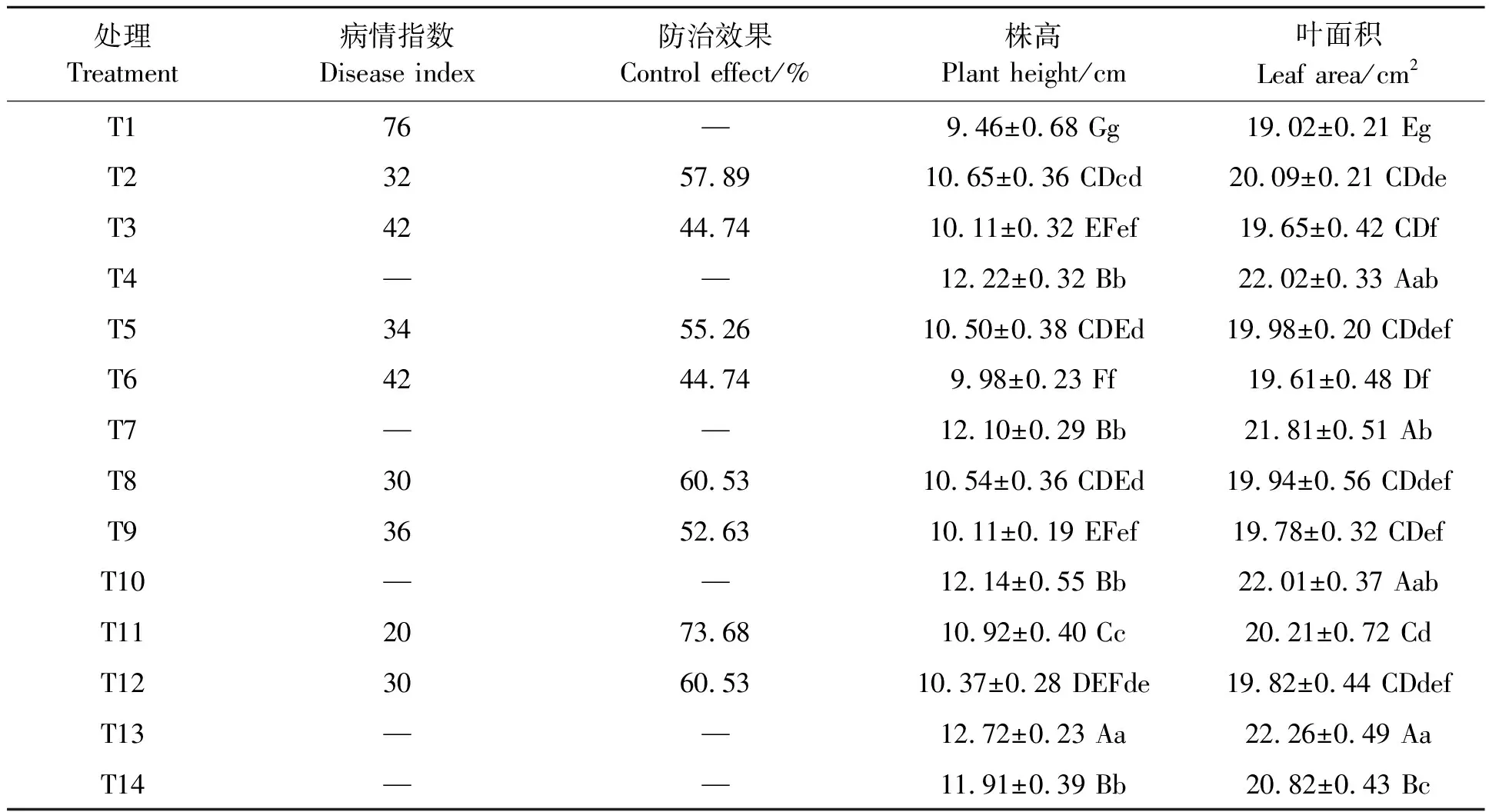
表2 供试菌种对草莓植株抗病和生长的影响
2.6 田间试验结果
2.6.1供试菌种对田间草莓根腐病的防治效果
为了避免试验结果的偶然性,在2个不同的草莓大棚(A棚和B棚)中进行菌株效果验证,由表3可知,5个处理中,相比于单一菌株,复合菌对田间草莓根腐病的防治效果最好,在A棚的防治效果达66.00%,在B棚的防治效果达57.18%,此结果与盆栽试验结果一致。可能是由于田间土地环境的多变性,不可控因素多,土壤中存留的草莓根腐病病原菌多样,导致田间防治效果达不到盆栽试验的防治效果。
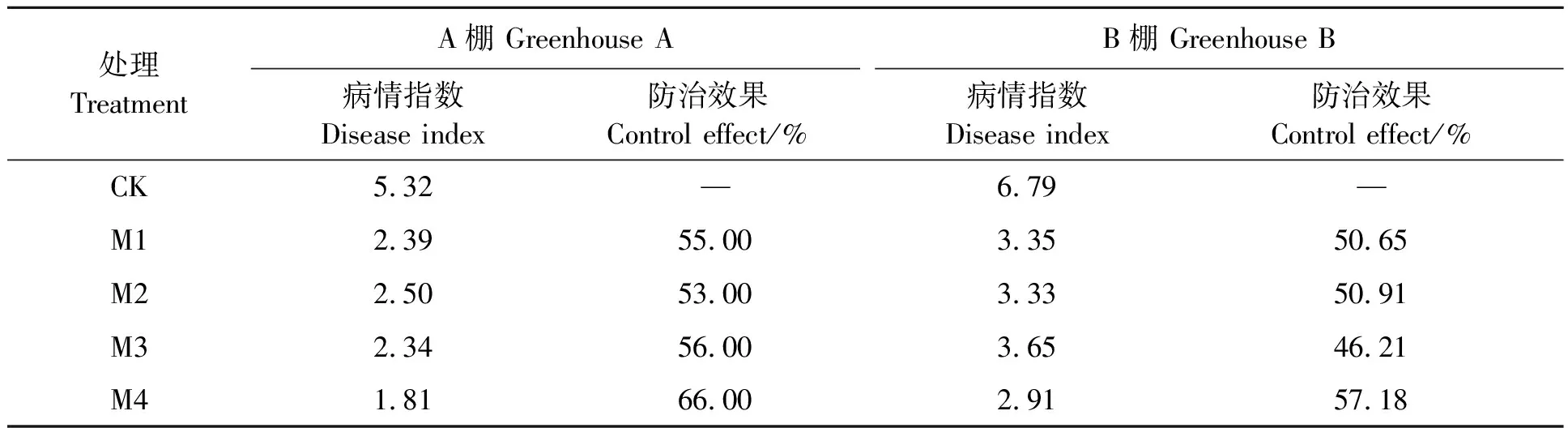
表3 供试菌种对草莓根腐病的防治效果
2.6.2供试菌种对草莓产量的影响 对A棚和B棚2个草莓大棚6次随机取样的产量进行统计分析,由表4结果可知,相比于不加菌处理和单一菌处理,复合菌处理的产量最高。A棚中复合菌处理相比于不加菌处理,每公顷产量增加了21.35%~37.99%;B棚中复合菌处理相比于不加菌处理,每公顷产量增加了12.97%~21.09%。产量的增加可能与病害的减少、植株存活率高有关。另外,由于复合菌的促生效果较单一菌株更好,健壮的植株开花结果数高。所以产量更高,此结果验证了病害防治在实际生产应用中的必要性。
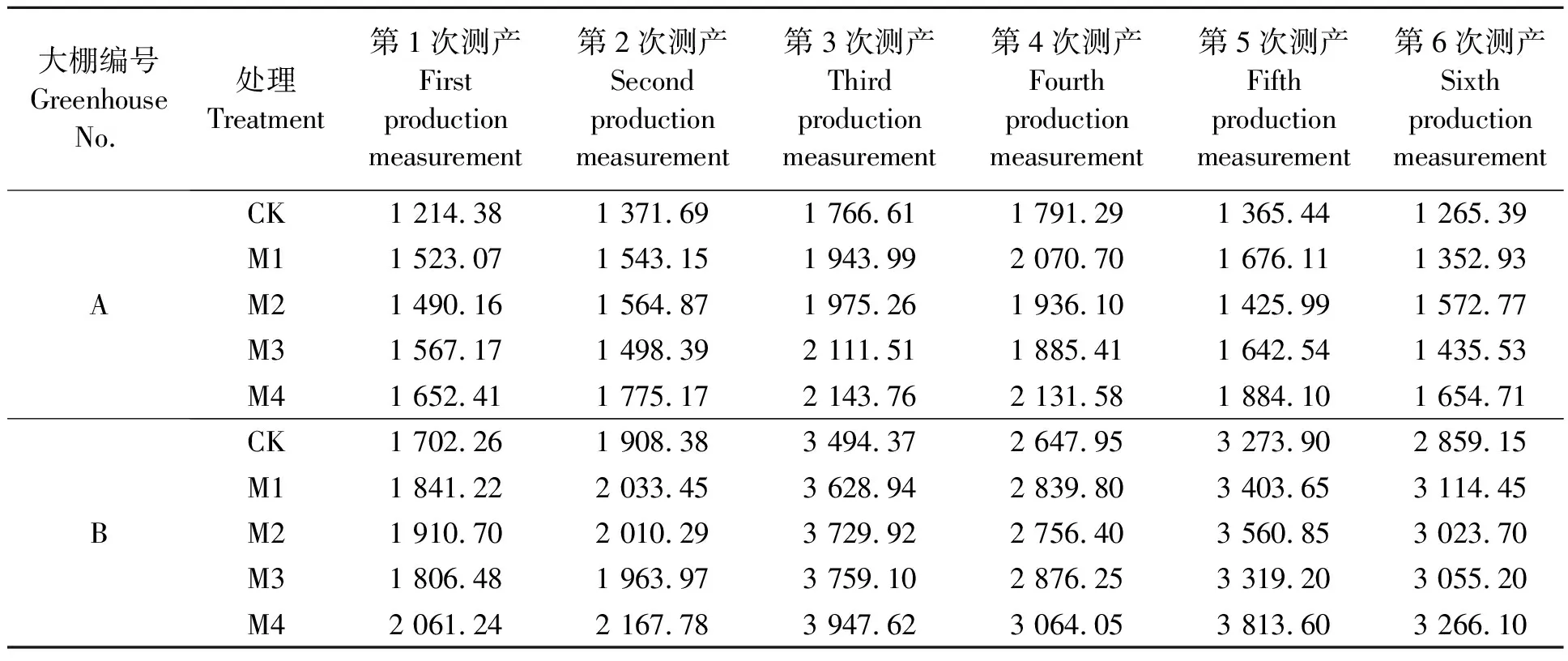
表4 供试菌种对草莓产量的影响
3 讨论
本研究对供试生防菌的促生抗病物质进行了初探,利用盆栽和田间试验验证了供试菌组合对草莓植株的防病、促生和增产效果。首次报道了将枯草芽胞杆菌、解淀粉芽胞杆菌与贝莱斯芽胞杆菌组合应用于防治N.clavispora所引发的草莓根腐病,并取得了良好防效。
N.clavispora除了引起草莓根部、叶片和果实病害,还能导致椰子、鳄梨、越橘、山核桃、蓝莓、月季和菜豆树等植株发病,对于N.clavispora的防治仅有化学药剂防治相关报道[22-24]。近年来,为了避免造成环境污染和病原菌的抗药性,利用有益微生物进行病害防治成为较为理想的途径之一[25]。生物防治中,具有环境相容性好、保存周期长、对人畜安全、植物病原菌不易产生抗性等优点的芽胞杆菌被广泛运用[26-27],生防芽胞杆菌在防治多种植物真菌性病害中效果显著[28-30]。Benizri等[31]研究指出,一些内生芽胞杆菌(如枯草芽胞杆菌、解淀粉芽胞杆菌等)能够在土壤和植物体内稳定定殖,具有产生促进植株生长和抗菌物质的能力,防病抗病时效长,克服了传统生物防治田间应用时效果不稳定等问题,具有良好的生防拓展潜力。曹晶晶等[32]在研究小麦黄花叶病的生物防治中发现,解淀粉芽胞杆菌对小麦病害的预防作用显著优于治疗作用,此结果与本研究的盆栽试验结果一致。戚家明等[33]基于全基因组数据分析,发现枯草芽胞杆菌BS-6基因组中存在7种芽胞杆菌属重要或特有的次生代谢产物基因簇,4种未知功能的次生代谢产物基因簇,证明其具有良好的抑制真菌生长的能力,此结论为本研究中供试生防菌的胞外粗提取物具有拮抗病原菌效果提供了理论基础。刘雪娇等[34]检测到贝莱斯芽胞杆菌3A3-15的抑菌基因包括yndJ、srfAB、ituC、bamC和fenD,促生长基因包括ysnE和dhbC,其分泌嗜铁素能力较强,次生代谢物能导致病原菌(尖孢镰刀菌)菌丝扭曲、膨大、畸形,对病原菌孢子萌发抑制作用较强,具有较好的生防和促生潜力。目前,生物防治大多使用单一菌剂,具有需菌量大、适应性差等问题。微生物菌剂的研究有向多菌复合发展的趋势,利用不同功能菌株组合能提高对环境的适应性,达到功能互补、更好地抑制病原菌的效果[35]。陈哲等[36]利用盆栽试验证实,复合菌芽胞杆菌对于草莓炭疽病的防治效果为 68.69%,比化学药剂的防治效果提高了23.63%;同时,复合菌芽胞杆菌对草莓株高、叶片面积、根鲜重以及茎叶鲜重都有显著促进作用。葛红莲等[37]研究发现,复合菌剂PB12能提高黄瓜幼苗的过氧化氢酶和过氧化物酶活性,从而提高了植物防御病害的能力。另外,复合菌剂的施用使土壤蛋白酶、纤维素酶、脲酶和蔗糖酶活性升高,表明复合菌剂在一定程度上可改善土壤质量,有助于土壤中的元素循环和生化反应,有利于农业的可持续生产。
