山竹的花色苷、黄酮、总酚含量及其抗氧化活性
2020-03-13祝思宇肖怡陈冠林张奎傅南琳
祝思宇,肖怡,陈冠林,张奎,傅南琳*
1. 广东药科大学附属第一医院(广州 510008);2. 佛山市职业病防治所(佛山 528000)
山竹(Garcinia mangostana L.)又名山竹子、莽吉柿、倒捻子、凤果,为藤黄科(Guttiferae)藤黄属(Garcinia)植物,原产于马来西亚,现主要分布于越南、泰国、印度尼西亚、马来西亚和菲律宾等东南亚国家以及我国广东、海南、福建、台湾等省[1-4]。山竹含有丰富的花色苷、黄酮、多酚、氧杂蒽酮和有机酸等化合物,从山竹中分离的化学成分约为114种[1,5-12]。在东南亚,用山竹的果皮、树皮以及树根作为药材治疗不同的疾病已有几百年历史[1]。目前已证实山竹的果皮提取物对腹痛、腹泻、感染性创伤、痢疾、慢性溃疡和淋病有一定的抑制作用[13-17]。在针对山竹果皮提取物的研究中,除了对山竹活性成分提取工艺[5,9-10]和提取物抗氧化活性[18-22]的研究外,也有对山竹果皮提取物的抑菌特性[23]、成分分析的研究[24],但对于山竹提取物模拟体外消化后测定其提取物含量及抗氧化活性变化的相关研究却未见报道。因此,此次试验以山竹为原料,采用一定比例的乙醇提取,在不同的pH条件下应用乙酸乙酯对提取液进行萃取分离,获得花色苷、黄酮以及多酚,测定模拟体外消化前后这些活性成分含量的变化,并系统地测定模拟体外消化后山竹各组分的抗氧化活性,为山竹的开发利用提供参考依据。
1 试验材料
1.1 材料与试剂
1.1.1 材料
山竹:市售。经广东药科大学中药学院中药鉴定学系李书渊教授鉴定,为藤黄科植物山竹(Garcinia mangostana L.)的成熟果实。
1.1.2 试验试剂
Trolox(6-hydroxy-2, 5, 7, 8-tetramethylchroman-2-carboxylic acid,水溶性维生素E)、ABTS(2,2-azino-bis-3-ethylbenzothiazoline-6-sulfonic acid,2, 2’-联氨-双-3-乙基-苯并噻唑啉-6-磺酸)以及福林-酚试剂(Folin-Ciocalteu reagent),美国Sigma公司;TPTZ(2, 4, 6-tris-2, 4, 6-tripiridyl-2-triazine,三吡啶三吖嗪)和DPPH(1, 1-diphenyl-2-picrylhydrazyl,1, 1-二苯基-2-三硝基苯肼),阿拉丁公司;胃蛋白酶,甘氨脱氧胆酸钠,牛磺脱氧酸钠,牛磺胆酸钠,美国Amresco公司;胰液素,日本TOYOBO公司;没食子酸:购于中国药品生物制品检定所;氢氧化钠、NaNO2、Al(NO3)3、FeCl3、HCl、过硫酸钾、乙酸钠、乙醇(分析纯),天津化学试剂厂。
1.2 仪器与设备
UV-9600紫外/可见分光光度计,北京瑞利分析仪器有限公司;LEO-150 S超声清洗仪,昆山力波超声波设备有限公司;多功能搅拌机(WBL 25 B26),美的集团有限公司;SY 2000旋转蒸发器,上海亚荣生化仪器厂;SHZ-Ⅲ型循环水真空泵,上海亚荣生化仪器厂。
1.3 样品的制备
山竹购回后用去离子水清洗干净,将果皮和果肉分离,切碎后用搅拌机将其分别搅拌均匀,备用。
2 方法
2.1 山竹的提取
准确称取1.0 g搅拌均匀的山竹果皮(或果肉),加入50 mL 50%乙醇,在40 ℃下超声10 min后抽滤,减压浓缩后,滤液备用[25]。
2.2 山竹提取物中花色苷、黄酮和总酚的分离
将滤液用乙酸乙酯(1∶1,体积比)萃取3次,水相减压蒸馏(50 ℃)去除有机溶剂后获得花色苷类物质。乙酸乙酯相减压蒸干后溶于水中,将水相的pH调至7.0,用乙酸乙酯(1∶1,体积比)萃取3次,乙酸乙酯相减压蒸馏至干后溶于水中,获得黄酮类物质。水相的pH调至2.0后,用乙酸乙酯萃取3次,乙酸乙酯相减压蒸馏至干后溶于水中,获得酚类物质[26]。
2.3 体外消化
将山竹提取物样品转移到棕色瓶与平衡盐溶液混合,使其总体积为20 mL。用1 mol/L的HCl将样品的pH调至2,加入1 mL胃蛋白酶,在37 ℃的水浴中振荡(95 r/min)1 h,模拟胃消化;经过胃蛋白酶消化后,用0.9 mol/L的碳酸氢钠将样品的pH调至5.3,加入0.2 mL甘氨脱氧胆酸钠、0.2 mL牛磺脱氧酸钠、0.2 mL牛磺胆酸钠和0.1 mL胰液素,再用1 mol/L的NaOH将样品的pH调至7.4后,置37 ℃的水浴中振荡(95 r/min)2 h,模拟肠道消化[27]。
2.4 花色苷的测定
将花色苷提取物与0.025 mol/L的氯化钾溶液按一定的比例混匀(pH 1.0),用蒸馏水调零,分别测定其在515和700 nm下的吸光度。将花色苷提取物与0.4 mol/L的醋酸钠缓冲液按一定的比例混匀(pH 4.5),用蒸馏水调零,分别测定其在515和700 nm下的吸光度,计算提取物的吸光度A。A=(A515-A700)pH1.0-(A515-A700)pH4.5。按以下公式计算总花色苷的含量:X(mg/L)=(A×MW×DF×1 000)/(e×1)。式中:A为样品的吸光度;DF为稀释倍数;MW为矢车菊素-3-葡萄糖苷的摩尔质量,MW=449.2;e为矢车菊素-3-葡萄糖苷的摩尔消光系数,e=26 900[28]。
2.5 黄酮含量的测定
取0.10 mL待测样品,加入0.3 mL 5%的NaNO3试剂中,反应6 min后,加入0.3 mL 10%的Al(NO3)3溶液,反应5 min后,加入2.0 mL 1 mol/L的NaOH,混匀,置室温下反应20 min,于510 nm下测定吸光度。结果以芦丁当量(Rutin equivalents,RE)表示,单位为mg RE/g WW(Wet weight)[29]。
2.6 总酚含量的测定
取0.10 mL待测样品,加入2.50 mL Folin-Ciocalteu试剂中,反应4 min后,加入2.00 mL 75 g/L的Na2CO3溶液,置室温下反应120 min,于760 nm下测定吸光度。结果以没食子酸当量(Gallic acid equivalents,GAE)表示,单位为mg GAE/g WW[30]。
2.7 FRAP法测定抗氧化活性
FRAP试剂由10 mmol/L的TPTZ(溶于40 mmol/L盐酸)、20 mmol/L的三氯化铁和300 mmol/L的乙酸钠缓冲液(pH 3.6)以体积比1∶1∶10混合而成。取100 μL待测样品,加入3 mL FRAP溶液中充分混合,反应120 min后于593 nm处测定吸光度。以Trolox溶液为标样作标准曲线,样品的抗氧化活性用μmol Trolox/g WW表示[31-32]。
2.8 DPPH法测定抗氧化活性
取0.1 mL待测样品,加入3.9 mL 0.06 mmol/L DPPH·80%乙醇溶液,振荡15 s,放置暗处反应2 h后,于515 nm处测定吸光度,按公式计算清除率:清除率=(A对照-A样品)×100%/A对照。以3.9 mL DPPH·+0.1 mL 80%乙醇作对照,空白为80%乙醇,以Trolox溶液为标样作标准曲线,样品的抗氧化活性用Trolox当量表示,单位为μ mol Trolox/g WW[33]。
2.9 ABTS法测定抗氧化能力
将7 mmol/L的ABTS(用pH为4.5、20 mmol/L的乙酸钠配制)和2.45 mmol/L的过硫酸钾等体积混合,室温下避光反应12~16 h,形成ABTS+·储备液。使用前用20 mmol/L乙酸钠(pH 4.5)将ABTS+·储备液稀释成为工作液,使其在734 nm处吸光度为0.700±0.005。取100 μL待测样品,加入3 mL ABTS+·工作液,室温下反应2 h后,在734 nm处测定吸光度。以20 mmol/L乙酸钠(pH 4.5)为空白,ABTS+·为对照,以Trolox溶液为标样作标准曲线,样品的抗氧化样品的抗氧化活性用TEAC(Trolox equivalent antioxidant capacity)表示[32]。单位为μ mol Trolox/g WW。
2.10 数据分析
试验一式三份,结果以均数±标准差表示。应用SPSS 17.0软件对数据进行ANOVA and Tukey’s多重比较分析(Tukey’s multiple comparison tests)。以a=0.05为显著性水平,判断各组之间差异是否具有统计学意义。
3 结果与讨论
3.1 线性关系
从表1可以看出,在测定范围内黄酮、多酚、FRAP、DPPH以及ABTS 5种测定方法具有很好的线性关系。
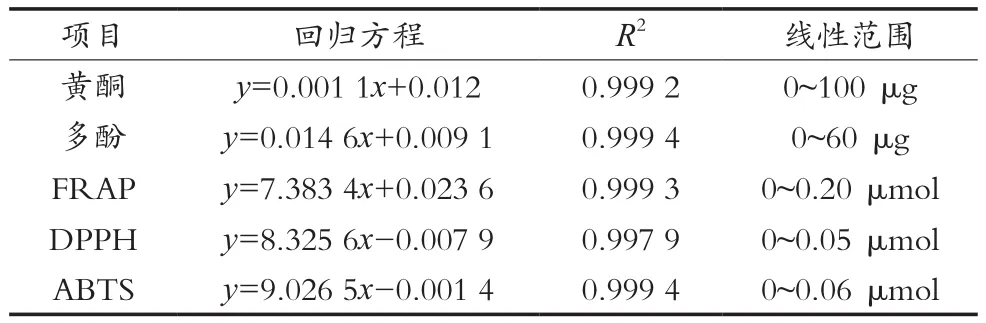
表1 黄酮、多酚、FRAP、DPPH以及ABTS的线性方程、相关系数和线性范围
3.2 山竹中花色苷、黄酮以及多酚的含量
从表2可以看出,消化前花色苷的含量为49.21 mg/L,经模拟胃肠道消化后,花色苷含量明显下降,差异具有统计学意义(p<0.05)。经模拟胃消化后山竹果皮和果肉的多酚含量均下降,差异具有统计学意义(p<0.05),与苹果、香蕉、圣女果、柑橘、葡萄、荔枝、芒果、山竹、梨、李子的研究结果一致[34]。与消化前比较,经模拟肠消化后山竹果肉多酚含量升高,差异具有统计学意义(p<0.05),而果皮多酚含量下降,差异没有统计学意义(p>0.05)。经模拟胃肠道消化后,果皮和果肉黄酮含量有所升高,但差异没有统计学意义(p>0.05)。此次试验中,山竹果皮的黄酮和多酚含量均较果肉高,与其他的研究结果一致[35]。陈海光等[2]研究发现,山竹果皮总酚含量为36.9 mg GAE/g FW,比此次试验中山竹果皮和果肉总酚含量高,其原因可能是山竹品种或者产地不同因而所含总酚不同。山竹果肉的总酚含量比榴莲、三华李、李子、杨梅、橙子、柑橘、芒果、樱桃、枣、番石榴、柿子、石榴、以及番荔枝果肉的总酚含量低[34,36]。
3.3 山竹提取物的铁离子还原能力
从表3可以看出,山竹各部分提取物的抗氧化能力均较强。消化前山竹果皮黄酮的FRAP值最高,其次是果皮花色苷和果皮多酚,而果肉多酚的FRAP值最低。经模拟胃消化后,果皮花色苷、黄酮和多酚的FRAP值均有所升高,差异具有统计学意义(p<0.05);而果肉黄酮和多酚的抗氧化能力有所下降,差异具有统计学意义(p<0.05),这与西瓜、甘蔗、杨梅、三华李、荔枝以及龙眼的研究结果是一致的[34]。与消化前比较,经模拟胃肠消化后果皮花色苷、黄酮和多酚的抗氧化能力均增强,差异具有统计学意义(p<0.05);消化后山竹果皮黄酮的FRAP值最高,其次是果皮花色苷和果皮多酚。而果肉多酚的FRAP值最低,这与消化前的结果是一致的。而山竹果肉无论是消化前还是经胃肠消化后其FRAP值均较芒果、三华李以及杨梅低[34]。山竹中富含花色苷、α-mangostin、儿茶素、香草酸、对香豆酸、咖啡酸和阿魏酸等活性成分[16,24,37-41],这些活性成分均具有较强的抗氧化能力[42-48]。研究发现,α-mangostin、咖啡酸、对香豆酸和儿茶素等活性成分对低密度脂蛋白胆固醇的氧化有很好的抑制作用[49-52],且混合酚类对低密度脂蛋白胆固醇氧化的抑制作用更强[53]。

表2 山竹中花色苷、黄酮以及多酚的含量
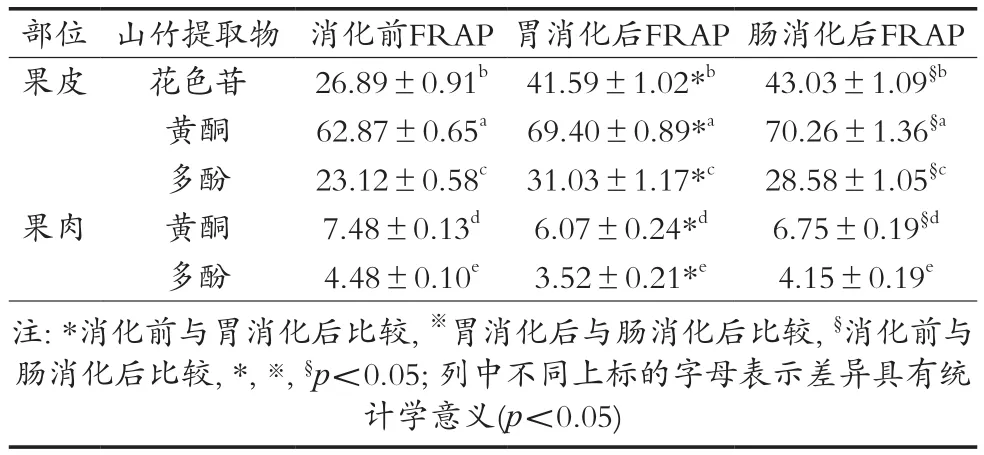
表3 山竹提取物的铁离子还原能力 μmol TE·g-1
3.4 山竹提取物的ABTS自由基清除能力
从表4可以看出,消化前山竹果皮黄酮对ABTS自由基的清除能力最高,其次是消化后花色苷和果皮多酚,而果肉多酚对ABTS自由基的清除能力最低,山竹果皮对ABTS自由基的清除能力高于果肉,这与以往的研究结果是一致的[54]。经模拟胃消化后,果皮黄酮、果肉黄酮和多酚对ABTS自由基的清除能力均有所升高,差异具有统计学意义(p<0.05);而果皮花色苷和多酚对ABTS自由基的清除能力有所下降,差异具有统计学意义(p<0.05),这与杨梅、芒果和李子的研究是一致的[34]。与消化前比较,经模拟胃肠消化后果皮黄酮、果肉黄酮和多酚对ABTS自由基的清除能力均有所升高,差异具有统计学意义(p<0.05)。消化后山竹果皮黄酮的ABTS值最高,其次是果皮花色苷,果皮多酚,而果肉多酚的ABTS值最低,这与消化前的结果是一致的。Fu等[36]研究发现,橄榄、石榴、番荔枝、番石榴、柿子和李子对ABTS自由基的清除能力较强,而香梨对ABTS自由基的清除能力较弱。此次试验中经胃肠消化前,山竹果肉对ABTS自由基的清除能力较葡萄(绿)、葡萄(USA)、菠萝蜜、柠檬、甜瓜、脐橙、番木瓜、百香果、香梨以及西瓜强[36]。而山竹果肉无论是消化前还是经胃肠消化后其对ABTS自由基的清除能力均较榴莲、芒果、三华李以及杨梅弱[34]。山竹果肉有较强的ABTS自由基清除能力,其总多酚(Total polyphenols)的ABTS自由基清除能力为1 268.6 mmol TE/100 g FW(Fresh weight),而游离酚(Free polyphenols)的ABTS自由基清除能力为260.4 mmol TE/100 g FW[55],其对ABTS自由基的清除能力较此次试验强。另一项山竹果皮提取物对ABTS自由基清除能力的研究显示,山竹果皮的乙醇、石油醚、氯仿、乙酸乙酯、正丁醇和水提取物的IC50值分别为6.82,16.95,11.15,3.04,4.39和45.86 μg/mL,其中乙酸乙酯提取物对ABTS自由基的清除能力最强,但比维生素C(IC50值为2.62)弱[56]。
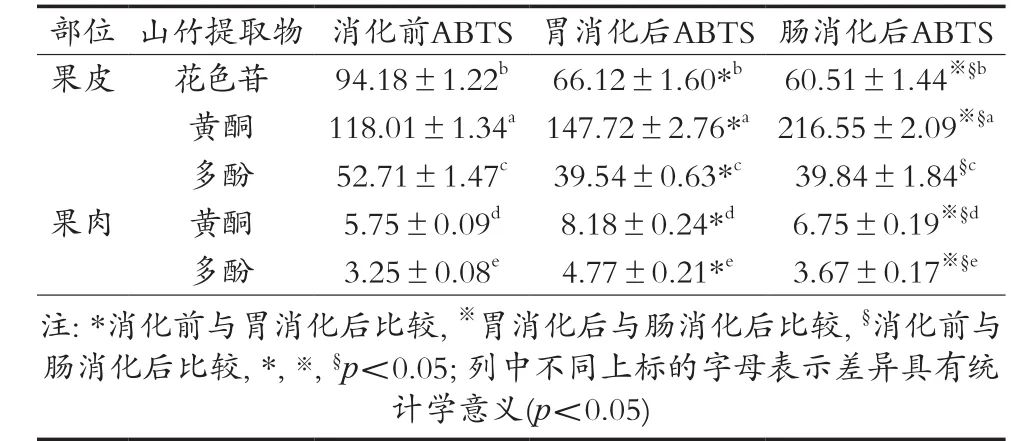
表4 山竹提取物对ABTS自由基的清除能力μ mol TE·g-1
3.5 山竹提取物的DPPH自由基清除能力
从表5可以看出,消化前山竹果皮黄酮对DPPH自由基的清除能力最高,其次是果皮多酚和花色苷,而果肉多酚对DPPH自由基的清除能力最低,山竹果皮对DPPH自由基的清除能力高于果肉,这与以往的研究是一致的[54]。经模拟胃消化后,果皮花色苷、黄酮、多酚,果肉黄酮和多酚对DPPH自由基的清除能力均有所升高,差异具有统计学意义(p<0.05)。与消化前比较,经模拟胃肠消化后果皮花色苷、果肉黄酮和多酚对DPPH自由基的清除能力均有所升高,差异具有统计学意义(p<0.05),这与苹果、圣女果、香蕉、葡萄、芒果、山竹、梨、火龙果、西瓜等研究是一致的[34]。消化后山竹果皮花色苷的DPPH值最高,其次是果皮黄酮和果皮多酚,而果肉多酚的DPPH值最低,这与消化前的结果是一致的。山竹果皮中的化学成分α-mangostin、γ-mangostin、gartanin、garcinone D和6-methoxy-bis pyrano xanthone均具有较强的DPPH自由基清除能力,其IC50值分别为35.03,21.52,25.61,73.79和48.67 μg/mL,但山竹中的mangostanate不具有清除DPPH自由基的能力[57]。另一研究发现,山竹水提物和α-mangostin呈浓度依赖性地抑制DPPH自由基的活性,其IC50值分别为54.37和183.95 mg/mL,山竹水提物对DPPH自由基的清除能力更强[58]。从山竹果皮分离的Mangostanaxanthones I和Mangostanaxanthones II也具有较强的DPPH自由基清除能力,其IC50值分别12.07和14.12 μmol/L[59]。研究发现,γ-mangostin具有减弱叔丁基过氧化氢(t-BHP)诱导肝细胞损伤的活性,可显著改善t-BHP诱导活性氧的积累,以及线粒体膜去极化和肝细胞(HL-7702)细胞核形态的改变,同时还可以逆转由t-BHP所引起的谷氨酸丙酮酸转氨酶和谷氨酸草酰乙酸转氨酶的降低。此外,γ-mangostin还能显著降低脂质过氧化物的水平,增加还原型谷胱甘肽和超氧化歧化酶的水平,从而减轻氧化应激[56]。
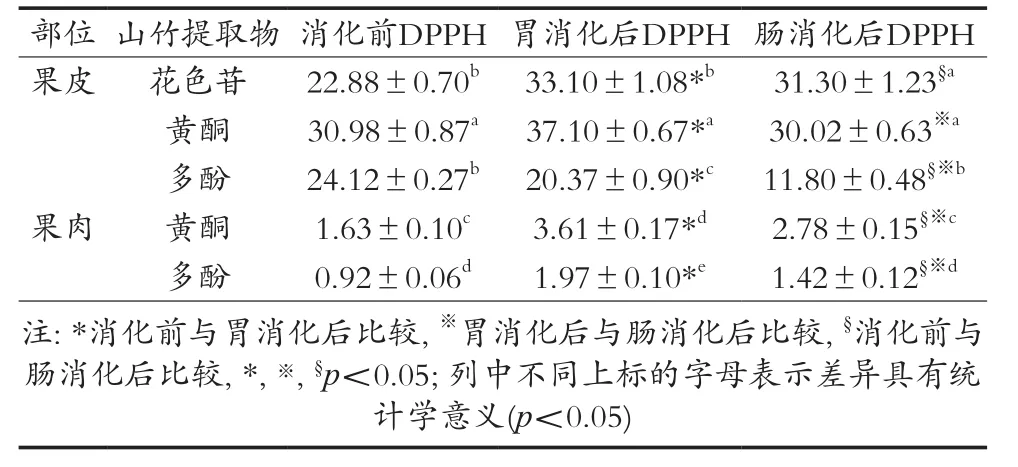
表5 山竹提取物对DPPH自由基的清除能力μmol TE·g-1
4 结论
研究采用DPPH、ABTS和FRAP三种方法分别测定了模拟胃肠消化前后山竹提取物的抗氧化活性,并用示差法、福林-酚法和NaNO2-Al(NO3)3-NaOH法测定了花色苷、总酚和黄酮含量。结果表明,山竹提取物表现出不同的抗氧化活性,其中山竹果皮黄酮组分的抗氧化活性最强。
