猪胰脏中胰淀粉酶的提取及其稳定性
2020-03-13岳晓禹陈贵敏
岳晓禹,陈贵敏
河南牧业经济学院食品与生物工程学院(郑州 450046)
在科学技术进步、能源发展、绿色环保等影响下,绿色健康、动物副产品产业取得发展,并不断扩大,畜产品加工成为农村小康生活进步、国家经济发展、实现绿色环境和绿色食品开发的途径。利用高新技术,特别是生物分离、酶工程、发酵、高压、高真空处理技术的进步,促进畜产品生产和市场的需求[1]。胰腺作为畜牧业的副产品,具有很高的利用价值。胰腺中可以分泌胰岛素平衡体内血糖量和蛋白酶、淀粉酶等分解碳水化合物、蛋白质、脂肪的酶。淀粉酶作为一种大型工业原料,主要应用的是水解产物葡萄糖、麦芽糖、低聚糖糖浆等,这些水解后的糖浆将被用于酒精发酵、酱油制作等,或直接作为产品用于其他领域(面包保鲜、医疗、洗涤剂)[2]。基于中国淀粉行业的发展需求,淀粉酶是中国需求量最大的酶。α-淀粉酶分布在自然界各种动物、植物、微生物体内中[3]。微生物与动植物比较,微生物繁殖速度快,外界影响易去除,而动植物则不同,受大自然的影响,繁殖速度慢,外界影响大,所以应市场需求量大部分淀粉酶是从微生物中提取。随着科技进步,细胞重组、DNA重组等技术促进动植物繁殖的速度,动植物提取淀粉酶成为越来越常使用的原料。
文献报道的提取胰淀粉酶的方法主要是机溶剂和盐析法结合的方法,如异丙醇沉淀和不同浓度铵盐溶液盐析结合的方法[4]、不同浓度硫酸铵盐析和凝胶层析法[5]。随着科技进步,环境恶化,有机溶剂和盐析法带来的危害受到重视。有文献报道使用低浓度的有机溶剂(35%~38%稀乙醇[6])和盐溶液(磷酸盐缓冲液[7])提取工艺。胰酶提取主要还是使用有机溶剂(乙醇、丙酮)和盐析法提取;有机溶剂不仅危险而且污染环境、成本高,盐析法除盐困难、对产品质量有影响等弊端[8]。所以,需要研究开发一种绿色环保、高质量、高品质的提取α-淀粉酶工艺[9]。如何提取高活力的α-淀粉酶具有重要的实际意义。中国生猪加工行业发展巨大,能提供大量原料。
试验以猪胰脏为原料,减少或尽量不用有机溶剂做提取剂,从胰脏中提取α-淀粉酶,使用透析袋对α-淀粉酶进行反渗透浓缩,向提取的液体酶中加入稳定剂配方,使液体酶在高温下仍能保持α-淀粉酶的酶活力。
1 材料与方法
1.1 试验材料
1.1.1 试剂
猪胰脏(郑州双汇集团);氢氧化钠(天津市永大化学试剂有限公司);氯化钙(天津市科密欧化学试剂有限公司);马铃薯淀粉(菱湖)、碘(天津永大化学试剂有限公司);碘化钾(天津永大化学试剂有限公司);硫代硫酸钠(郑州派尼化学试剂厂);盐酸(烟台市双双化工有限公司);硫酸(烟台市双双化工有限公司);碳酸钙(天津市科密欧化学试剂有限公司)等。
1.1.2 设备与仪器
磁力搅拌器、离心机、恒温水浴锅HH-S(江苏医疗仪器厂);干燥箱;绞肉机(PY-790,中山市鹏宇电器有限公司);酸度计(上海仪迈仪器科技有限公司);全温培养摇床(QYC-2102,上海新苗医疗器械制造有限公司);移液枪(规格100~1 000 μL);细菌培养箱(SPX-250L-B-1,上海福马实验设备有限公司);透析袋(20000,美国)等。
1.2 工艺流程与部分操作要点
胰脏(冻藏)→预处理→提取→过滤→胰乳滤液→粗酶→浓缩→保存
1) 预处理
将新鲜猪胰或冷冻猪胰脏除去大块脂肪,用绞肉机制成胰浆。
2) 提取
取10 g胰浆,加入20 mL(按1∶2比例)不同试剂,磁力搅拌1 h,2层纱布过滤,得到滤液,滤渣再次提取,2次滤液合并。
3) 浓缩
酶的纯度越高酶活越高,采用透析浓缩的方法,对胰淀粉酶进行浓缩提纯,并研究浓缩对胰淀粉酶活力的影响,确定最佳浓缩倍数。
4) 保存稳定性的研究
采用向胰淀粉酶中加入稳定剂、改变温度或pH等因素对胰淀粉酶的稳定性影响,找出可以长期稳定性保存的方法。
1.3 胰淀粉酶提取过程试验设计
1.3.1 单因素试验设计
1) 提取剂对胰淀粉酶酶活力的影响
准确称取10 g猪胰浆4份,置于干净已标记好的烧杯中,分别加入提取剂为:磷酸盐缓冲液、氯化钠溶液、水、澄清石灰水,搅拌均匀,调节各个提取剂pH 6.8、温度25 ℃、磁力搅拌器搅拌1 h,2层纱布过滤,得胰乳,2次提取,2次提取液合并。测定胰淀粉酶活力,试验重复至少3次,确定最佳提取剂。
2) 提取pH胰淀粉酶酶活力的影响
准确称取10 g猪胰浆6份,置于干净已标记好的烧杯中,分别加入提取剂澄清石灰水,搅拌均匀,调节pH分别为6.5,6.6,6.7,6.8,6.9和7.0,常温下,磁力搅拌器搅拌1 h,2层纱布过滤,得胰乳,2次提取,2次提取液合并。测定胰淀粉酶活力,试验重复至少3次,确定最佳提取pH。
3) 提取时间胰淀粉酶酶活力的影响
准确称取10 g猪胰浆4份,置于干净已标记好的烧杯中,分别加入提取剂澄清石灰水,搅拌均匀,调节最佳pH 6.8,常温下,磁力搅拌器搅拌时间分别为1,2,4和6,2层纱布过滤,得胰乳,2次提取,2次提取液合并。测定胰淀粉酶活力,试验重复至少3次,确定最佳提取时间。
4) 提取温度胰淀粉酶酶活力的影响
准确称取10 g猪胰浆7份,置于干净已标记好的烧杯中,分别加入提取剂澄清石灰水,搅拌均匀,调节最佳pH 6.8,调节温度4,15,25,30,35,40和45 ℃,最佳磁力搅拌器搅拌2 h,2层纱布过滤,得胰乳,2次提取,2次提取液合并。测定胰淀粉酶活力,试验重复至少3次,确定最佳提取温度。
1.3.2 正交试验设计
根据单因素试验设计结果,选择提取pH、提取时间、提取温度、提取剂4个因素。每个因素选择3个水平。设计正交试验,采用L9(34)正交试验设计,确定最佳提取工艺。正交试验设计水平表如表1。

表1 猪胰淀粉酶提取单因素正交试验水平表
1.4 胰淀粉酶活力测定
《中国药典》2015版,胰淀粉酶活力测定。
1.5 试验数据处理方法
数据处理方法采用SPSS软件进行方差分析和多重比较的方法,判断是否显著的方法,用字母表示法表示,在表格中,在0.01水平上数据上肩注A、B、C等表示,0.05水平上数据上肩注a、b、c表示。只要同一列平均数间有一个相同字母的即为差异不显著;凡是无相同字母的则为差异显著。
2 结果与分析
2.1 单因素试验结果
2.1.1 提取剂对胰淀粉酶酶活力的影响
有机溶剂污染环境、盐析影响酶的质量[8]。所以提取剂采用磷酸盐缓冲液[7]、氯化钠[10]、水[11]、澄清石灰水[12]为提取剂,减少有机溶剂的使用和盐含量。表2可知,提取剂为磷酸盐缓冲液、氯化钠、水时,胰淀粉酶酶活力没有明显差异(p>0.05),提取剂为水、澄清石灰水时,胰淀粉酶酶活力明显增加(p<0.05)。澄清石灰为提取剂时,胰淀粉酶活力最高。所以,最佳提取剂为澄清石灰水。

表2 提取剂对胰淀粉酶酶活力的影响
2.1.2 提取pH对胰淀粉酶酶活力的影响
胰淀粉酶的最适pH范围为6.5~7.0,最适pH 6.9[4]。但猪胰脏本身都存在pH,所以探究不同pH提取对有胰淀粉酶活力的影响。有表3可知,pH 6.5~6.8时,胰淀粉酶活力增高极显著(p<0.05)。pH 6.8~6.9时,胰淀粉酶活力明显下降(p<0.05)。pH 6.9~7.0时,胰淀粉酶活力没有明显变化(p>0.05)。因为pH 6.8时,酶活力值最高。所以,最适pH 6.8。

表3 提取pH对胰淀粉酶酶活力的影响
2.1.3 提取时间对胰淀粉酶酶活力的影响
由表4可知,提取时间1~2 h时,胰淀粉酶活力急剧升高(p<0.05),提取时间2~6 h时,胰淀粉酶活力急剧下降(p<0.05)。说明提取时间对胰淀粉酶活力极为重要。

表4 提取时间对胰淀粉酶酶活力的影响
2.1.4 提取温度对胰淀粉酶酶活力的影响。
酶作为一种生物催化剂,其半衰期短,易失活,严重影响酶的使用。所以提取时温度过高过低会对胰淀粉酶活力产生影响。对提取温度做出研究。由表5可知,不同温度下提取胰淀粉酶差异极显著(p<0.01),提取温度为4~40 ℃时,胰淀粉酶活力变化明显(p<0.01),温度40 ℃时,胰淀粉酶活力到达最高值,温度再次升高至45 ℃时,胰淀粉酶活力急剧下降(p<0.01),说明提取温度对胰淀粉酶活力极为重要。因为40 ℃时胰淀粉酶活力达到最高值,所以最适提取温度为40 ℃。

表5 提取温度对胰淀粉酶酶活力的影响
2.1.5 正交试验结果
根据表1猪胰淀粉酶提取单因素正交试验水平表)所得表6(猪胰淀粉酶提取单因素正交试验方案)。
由单因素结果表明,提取剂采用澄清石灰水、磷酸盐缓冲液、水;提取pH 6.8~7.0;提取温度30~40℃;提取时间1~4 h,通过L9(34)正交试验确定最佳的提取工艺。根据表6的数据显示,影响胰淀粉酶活力的因素主次为:提取剂>提取pH>提取温度>提取时间。通过极差分析得到的优化方案为A1B2C1D3,即:提取剂采用磷酸盐缓冲液,提取pH 6.8,提取时间2 h,提取温度30 ℃。

表6 猪胰淀粉酶提取单因素正交试验方案
根据正交试验结果,提取剂采用磷酸盐缓冲液、提取pH 6.8、提取时间2 h,提取温度30 ℃进行工艺验证,验证结果表明,胰淀粉酶酶活力为1 375.00 U/mL,比表6(猪胰淀粉酶提取单因素正交试验方案)中提取工艺的胰淀粉酶酶活力都要高,所以提取剂采用磷酸盐缓冲液、提取pH 6.8、提取时间2 h,提取温度30 ℃为最佳工艺。
2.2 透析浓缩的影响
用30%聚乙二醇20000溶液进行反渗透浓缩,透析液2~3 h后换透析液:第1次透析,胰淀粉酶记为酶2;5~6 h后再次换透析液,记为第2次透析,胰淀粉酶记为酶3;换完透析液后将样液放入4 ℃条件下,进行过夜透析,过夜透析后的酶为记为酶3;经过过夜透析后的胰淀粉酶小分子物质已透析完全,胰淀粉酶记为酶4;提取后的胰淀粉酶记为酶1。如图1所示。
结果表明,酶在透析浓缩过程中胰淀粉酶酶活力越来越高,随着透析次数增加,酶4平均胰淀粉酶酶活力是酶1平均胰淀粉酶酶活力的5.2倍。
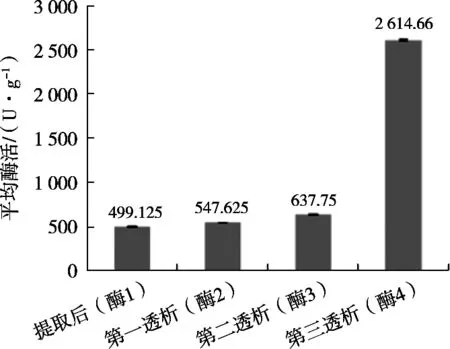
图1 不同程度透析浓缩对酶活力的影响
2.3 稳定保存的确定
加入稳定剂配方,放在35 ℃恒温培养箱内,每隔一段时间测1次酶活,观察胰淀粉酶酶活力变化,因为胰淀粉酶是液体酶,在高于常温下液体易变质,产生难闻臭味,故在原配方的基础上加入甘油防止腐败变质,产生臭味。
2.3.1 原配方
配方一[13-15]:淀粉0.01 g/mL、乳糖0.09 g/mL、糊精0.01 g/mL、氯化钙1.5 mg/mL、氯化钠0.1 mg/mL。
配方二[14-15]:硝酸钾0.1 mg/mL、甘油0.05 g/mL、D-山梨醇0.05 g/mL、葡糖糖0.05 g/mL、海藻糖0.05 g/mL。
2.3.2 改进配方
配方一:淀粉0.01 g/mL、乳糖0.09 g/mL、糊精0.01 g/mL、氯化钙1.5 mg/mL、氯化钠0.1 mg/mL、甘油0.025 g/L。
配方二:硝酸钾0.1 mg/mL、甘油0.075 g/mL、D-山梨醇0.05 g/mL、葡糖糖0.05 g/mL、海藻糖0.05 g/mL。
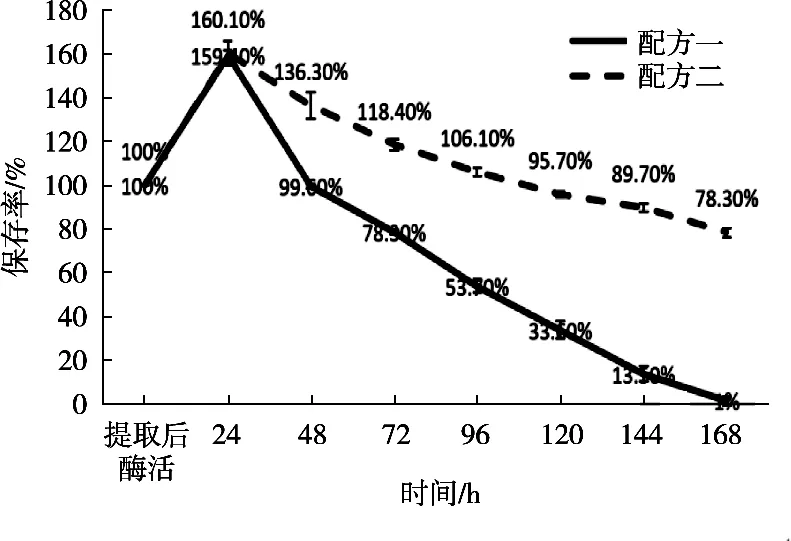
图2 加入稳定剂配方酶活力的保存率
刘晶晶[13]和聂国兴等[14]研究表明,添加稳定助剂或者无机离子成分在一定含量范围内可以激活胰淀粉酶活力,认为稳定剂配方内含有这些物质,所以胰淀粉酶活力增高。加入稳定剂配方后,在温度35 ℃条件下,随着时间加长,配方一保存24 h,胰淀粉酶酶活力升高,但保存48 h后胰淀粉酶酶活力保存率为99.60%,保存144 h后,胰淀粉酶酶活力保存率1%,近失活状态。配方二和配方一相同,保存24 h胰淀粉酶酶活力升高,但超过24 h后,配方二胰淀粉酶酶活力开始下降,保存144 h,胰淀粉酶酶活力仍保存89.70%的酶活。
由图3可知,随着温度上升胰淀粉酶保存的酶活力下降越快,25与35 ℃相比,保存时间168 h时,25℃胰淀粉酶酶活力的存活率为90.08%,而35 ℃则下降到78.30%。下降速度,30与35 ℃胰淀粉酶酶活力的下降速度相近,但30,35和25 ℃相比,25 ℃时胰淀粉酶酶活力下降速度缓慢较明显。所以温度越低胰淀粉酶的酶活力保存时间越长,且胰淀粉酶酶活力下降速度越慢。

图3 配方二不同温度下保存酶活的保存率
3 结论
通过对猪胰脏中胰淀粉酶的提取的单因素及其稳定性的研究,确定对胰淀粉酶活力最大的因素是提取剂,其次是提取pH,影响最小的是提取温度。确定最佳工艺为:原料采用冷冻猪胰脏,提取剂采用磷酸盐缓冲液,提取pH 6.8,提取时间2 h,提取温度30 ℃,用透析袋方法对粗酶进行反渗透浓缩,酶活力比粗酶的酶活力高5.2倍。加入稳定剂配方为:硝酸钾0.1 mg/mL、甘油0.075 g/mL、D-山梨醇0.05 g/mL、葡糖糖0.05 g/mL、海藻糖0.05 g/mL。在35 ℃条件下,胰淀粉酶能保存近1周,保存率89.7%。胰淀粉酶保存温度越低胰淀粉酶的酶活力保存时间越长,且胰淀粉酶酶活力下降速度越慢。此方法简单易操作,时间短,成本低,环保、易于产业化生产。在酶稳定性保存中有些物质利于酶活增高,可以考虑在提取过程中加入,此方法有待研究。
