大肠杆菌外膜蛋白omp F 基因与Ⅰ类整合酶基因在生物被膜状态下表达相关性的研究
2020-03-13王艺凝周建华马丽娜李学瑞刘永生中国农业科学院兰州兽医研究所家畜疫病病原生物学国家重点实验室农业部草食动物疫病重点开放实验室甘肃兰州730046
王艺凝,周建华,马丽娜,李学瑞,刘永生 (中国农业科学院 兰州兽医研究所 家畜疫病病原生物学国家重点实验室/农业部草食动物疫病重点开放实验室,甘肃 兰州730046)
大肠杆菌(Escherichia coli,E.coli)是肠杆菌科细菌中最广泛分布及最常分离的革兰阴性菌。由于抗生素的广泛使用,出现了大量的多重耐药(multidrug resistant,MDR)大肠杆菌,对人类和动物的健康产生了严重的威胁[1-2]。耐药性广泛传播的主要原因是耐药基因在病原菌和其他细菌之间的横向转移,整合子作为耐药基因水平转移的主要遗传元件,是细菌多重耐药性形成和广泛扩散的重要原因之一[3]。Ⅰ类整合子作为最广泛存在的一种整合子,是耐药基因传递的重要载体,可在Ⅰ类整合酶的作用下整合外源基因,使之转变为功能性基因,从而影响多重耐药基因在细菌间的水平传播。细菌的生存状态有2种,即浮游及生物被膜状态,在生物被膜状态下,细菌彼此接触密切,环境适应能力增强,更有利于菌体间基因的水平转移[4],耐药机制比浮游状态更加错综复杂。
外膜蛋白(OMPs)是革兰阴性菌细胞壁特有的结构,omp F作为大肠杆菌重要的外膜亲水性非特异孔道蛋白之一,与大肠杆菌的耐药性密切相关。外膜通透性的改变可以影响抗菌药物的耐药机制,已有研究发现膜孔蛋白缺失株对抗生素的敏感性有所降低。目前的研究发现某些革兰阴性菌的致病性和耐药性与生物被膜的形成密切相关[4],金属离子、质粒、整合子及外膜蛋白的表达水平可能对其有一定的影响[5]。因此本研究以Ⅰ类整合酶(intⅠ)为研究对象,应用实时荧光定量PCR(RT-PCR)分析在生物被膜状态下,亲本株、omp F基因缺失株和回复株的Ⅰ类整合酶基因m RNA 的表达差异,通过探究omp F基因对Ⅰ类整合酶表达量的影响,探讨生物被膜状态下耐药基因水平传播的机制。
1 材料与方法
1.1 菌株来源收集2017年5月-2017年12月从甘肃、青海两省的500份粪便样品中分离鉴定的非重复性大肠杆菌245株,筛选出其中符合本试验条件的菌株N46野生株,此株大肠杆菌Ⅰ类整合酶阳性且具有生物被膜形成能力(图1),对氨苄西林和氯霉素均敏感(Red同源重组技术中工具质粒的抗性特征),大肠杆菌ATCC25922标准菌株作为质控菌株。
1.2 质粒Red同源重组进行基因敲除所需的质粒p KD46、p KD3、pCP20由中国农业科学院哈尔滨兽医研究所李干武研究员赠送;质粒ps TV28购自宝生物工程(大连)有限公司(Ta KaRa)。
1.3 主要试剂和仪器细菌基因组提取试剂盒、质粒提取试剂盒、DNA 胶回收试剂盒均购自北京天根生物科技有限公司(TIANGEN);L-阿拉伯糖购自Sigma公司,E.ColiTrans5α感受态细胞购自北京全式金生物技术有限公司;p MD-18T 载体、PremixTaq酶(ExTaq2.0 Plus)、DL2000 DNA Marker、DpnⅠ,HindⅢ和Bam HⅠ限制性内切酶购自宝生物工程(大连)有限公司(Ta KaRa);逆转录试剂盒购自宝日医生物技术(北京)有限公司;qPCR Master Mix荧光定量试剂盒购自Vazyme公司,TRIzol购自生工生物工程(上海)股份有限公司,其他试剂均为国产分析纯。Real-time PCR System 和电转化仪购自Bio-Rad公司。
1.4 引物的设计根据筛选出的菌株omp F基因的测序结果,利用软件Primer Premier 5.0 设计omp F基因重组引物及鉴定引物(表1)。O1/O2用于扩增含omp F基因同源臂的氯霉素抗性基因的片段,Omp FF/Omp FR 用于鉴定omp F基因,intⅠF/intⅠR 用于扩增Ⅰ类整合酶基因,16S RNA F/16S RNA R,Qint F/Qint R 用 于 荧 光 定 量PCR 扩增Ⅰ类整合酶基因。引物由苏州金唯智生物科技有限公司合成。

表1 引物序列
1.5 N46/omp F 基因缺失株的构建和鉴定参照文献的方法[6],利用Red同源重组技术构建大肠杆菌N46omp F基因缺失株。按照常规方法制备大肠杆菌N46感受态细胞[7],将p KD46质粒,电转入大肠杆菌N46 菌株中,构建重组菌p KD46/N46。制备p KD46/N46电转感受态细胞。以质粒p KD3为模板,O1、O2为引物,通过PCR 扩增含有omp F基因同源臂和氯霉素抗性的打靶DNA 片段,胶回收后用DpnⅠ限制性内切酶进行酶切,除去体系中未反应的p KD3 质粒,再将酶切体系进行胶回收。将其电转入p KD46/N46感受态细胞中,通过Gam、Bet和Exo 3种λ噬菌体重组酶的作用,进行同源重组,产物为N46/omp FΔ。用引物Omp F-F,Omp FR 鉴定,成功后,电转入pCP20质粒,去除氯霉素抗性基因,通过PCR 扩增和测序鉴定omp F基因敲除成功。
1.6 N46/omp F 基因回复株的构建和鉴定首先根据N46野生株omp F基因的测序结果,设计含有HindⅢ和Bam HⅠ酶切位点的引物Omp F-N46-F、Omp F-N46-R,PCR 扩增出含有启动子的omp F完整片段,胶回收。将目的片段和pSTV28质粒分别用HindⅢ和Bam HⅠ进行双酶切,用T4连接酶进行连接,再转化至大肠杆菌Trans5α感受态细胞中,氯霉素抗性平板筛选阳性克隆。通过PCR 扩增确定获得回复质粒。将回复质粒电转入N46/omp FΔ基因缺失株中,经氯霉素抗性平板筛选获得回复株,通过PCR 扩增和测序鉴定omp F基因回复株构建成功。
1.7 大肠杆菌Ⅰ类整合酶基因在生物被膜状态下的转录水平研究
1.7.1 大肠杆菌在浮游及生物被膜状态下生长曲线的测定 挑取大肠杆菌N46野生株,omp F基因缺失株和回复株的单菌落接到5 m L LB 液体培养基中,37℃200 r/min振荡培养过夜,将此菌液作为种子液,按照1∶100的比例加入10 m L LB液体培养基中,37℃200 r/min振荡培养,同时开始计时,在未加入种子液前和开始培养的0,1,2,3,4,6,8,10,12,22,24 h分别吸取200μL 菌液置于96孔板中,设置3个复孔,测D600的吸光值,培养结束后根据各D值和对应时间点做标准曲线,即为浮游状态下的生长曲线。
根据生长曲线,将培养至平台期的菌液稀释至D600为0.01,取200μL加入96孔板中,每株菌接3列24孔,并用LB 液体培养基200μL 接3孔,作为空白对照,37℃静置培养。分别在12,24,36,48,60,72,84,96 h取板测其D600值,培养结束后根据各D值和对应时间点做标准曲线,即为生物被膜状态下的生长曲线。
1.7.2 生物被膜状态下大肠杆菌RNA 的提取和反转录合成cDNA 将大肠杆菌N46 野生株,omp F基因缺失株和回复株按照1∶100 的比例加入LB液体培养基中37℃200 r/min振荡培养至对数生长期,稀释至D600为0.1,放置于6孔细胞培养板中,3 m L/孔,同时在孔中放入1片灭菌盖玻片,37℃静置培养至形成成熟的生物被膜,弃去浮游菌,用生理盐水清洗,用细胞刮刮取盖玻片表面和6孔板表面生物被膜,用生理盐水将菌体打散,离心备用。用TRIzol法提取细菌的总RNA,采用紫外分光光度计测定RNA 的纯度和浓度。取5μL 提取的总RNA 通过琼脂糖凝胶电泳检验提取RNA 的完整性,-70℃保存备用。用宝日医生物技术(北京)有限公司的PrimeScriptTMReverse Transcriptase 试剂盒,将提取的总RNA 经二步法反转录合成cDNA。
1.7.3intⅠ和16S RNA PCR 扩增 采用25.0μL体系:PremixTaq酶(ExTaq2.0 plus)12.5μL,上、下游引物(10μmol/L)各1.0μL,c DNA 1.0μL(200 mg/L),dd H20 补足至25.0μL。16S RNA 的扩增循环参数为:95℃预变性90 s;95℃变性40 s,56℃退火30 s,72℃延伸1 min,循环30 次;最后72℃终止延伸5 min。intⅠ的扩增循环参数为:95℃预变性5 min;95℃变性30 s,58℃退火30 s,72℃延伸1 min,循环30 次;最后72℃终止延伸5 min。PCR 产物用含溴化乙锭(EB)的1.0%琼脂糖凝胶进行电泳分析。
1.7.4 实时定量PCR 分析不同状态大肠杆菌intⅠm RNA 的表达量 以Qint为实时荧光定量PCR的目的基因,16S RNA 为内参基因,片段大小分别为110 和218 bp,荧光定量PCR 反应体系为20.0μL,cDNA 模板2.0μL(50 ng),上、下游引物各0.4μL(终浓度10.0μmo L/L),Vazymeq PCR Master Mix 12.5μL,Nuclease-Free Water补足至20.0μL。反应条件为:预变性95℃30 s;95℃5 s,60℃30 s,95℃15 s,循环40次,于退火阶段收集荧光信号;最后运行熔解曲线分析程序。每组样本重复检测3~5次。
1.7.5 数据处理 应用相对定量(2-△△Ct)法计算大肠杆菌野生株,omp F基因缺失株和回复株在生物被膜状态下整合酶基因的表达情况。应用SPSS 13.0 统计分析软件,采用方差分析对各组intⅠm RNA 相对表达量差异进行统计分析,P≤0.05认为差异有统计学意义。
2 结果
2.1 大肠杆菌N46 omp F 基因缺失株的构建以p KD3质粒为模板,利用引物O1/O2扩增出含有氯霉素抗性基因的打靶片段,经琼脂糖凝胶电泳鉴定大小约为1 150 bp,与预期结果相符(图2),将其电转入含有p KD46质粒的N46大肠杆菌中,在含有氯霉素的LB 平板上,37℃过夜培养后筛选阳性克隆,经Omp FF/Omp FR 引物鉴定,阳性克隆条带大小为1 122 bp,亲本株条带大小为950 bp(图3),利用质粒p CP20 消除抗性基因,再次使用Omp FF/Omp FR 引物对抗性消失的克隆进行检测,此时菌株条带大小约为200 bp(图4)。PCR 及测序结果表明,氯霉素抗性基因成功去除,获得N46/omp FΔ基因缺失株。
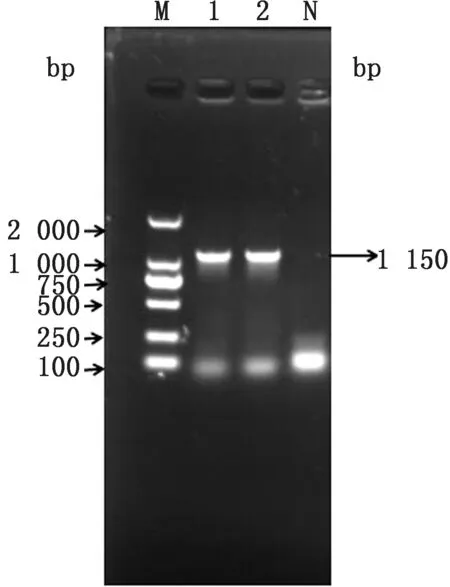
图2 打靶片段的扩增 M.DL2000 DNA Marker;1~2.PCR 产物;N.阴性对照
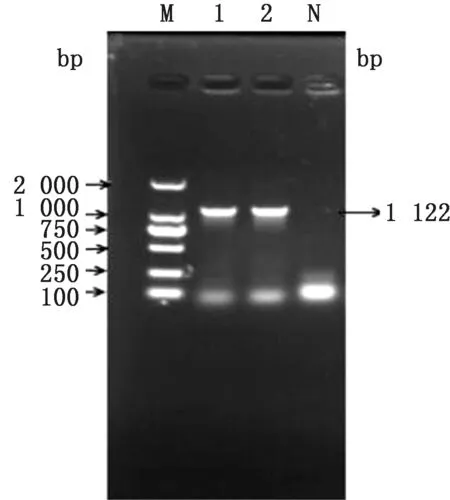
图3 omp F 和打靶片段重组的结果 M.DL2000 DNA Marker;1~2.阳性重组子;N.阴性对照
2.2 大肠杆菌N46 omp F 基因回复株的构建以大肠杆菌N46 的基因组为模板,用Omp F-N46-F和Omp F-N46-R 为引物,PCR 扩增出含有启动子的omp F完整片段,经琼脂糖凝胶电泳鉴定大小约为950 bp,与预期结果相符(图5),将构建的回复质粒转化入Trans5α感受态细胞中,挑取转化子,提取质粒转化入相应的缺失株中,挑取的阳性克隆,利用引物OF、OR 进行鉴定,此时菌株条带大小约为1 000 bp(图6)即为转化成功菌株,命名为N46/omp Fcom基因回复株。
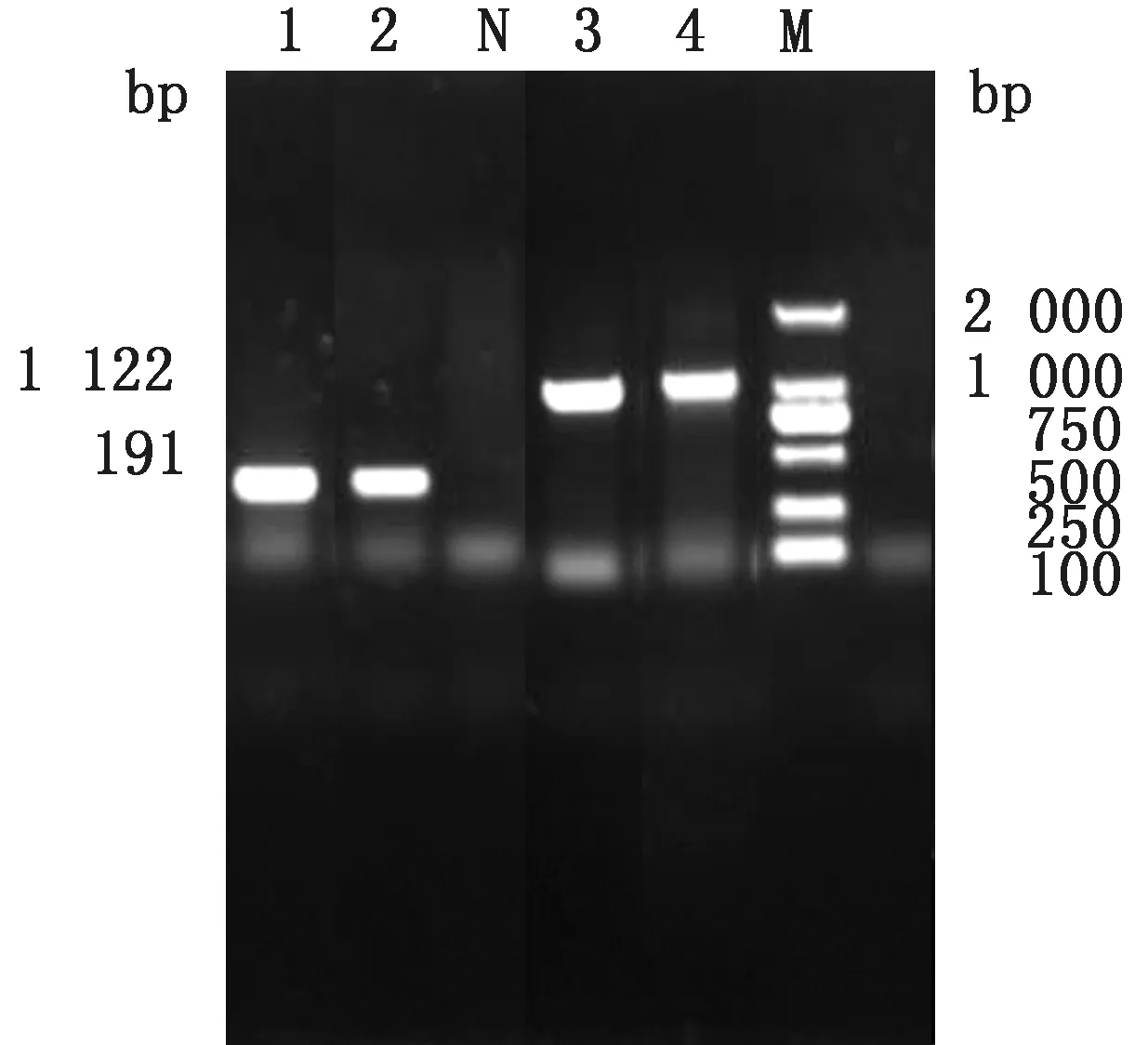
图4 Omp F F/Omp F R 鉴定的结果 M.DL2000 DNA Marker;1~2.氯霉素抗性去除菌株;3~4.氯霉素抗性未去除菌株;N.阴性对照
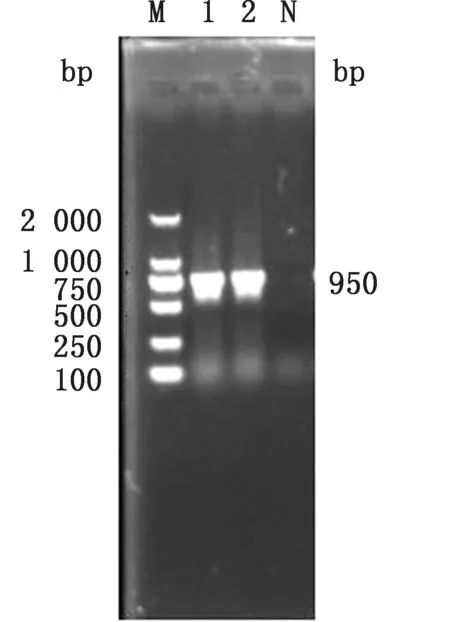
图5 omp F 基因扩增结果 M.DL2000 DNA Marker;1~2.含有启动子的omp F 完整片段;N.阴性对照
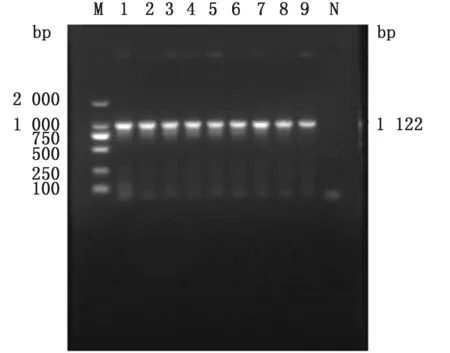
图6 回复株鉴定结果 M.DL2000 DNA Marker;1~9.阳性重组子;N.阴性对照
2.3 生长性能的差异比较在浮游状态下,omp F基因缺失株相对于野生株生长较为缓慢(图7),达到平台期的D600的值低于野生株,回复株的生长速度略有回升,但达不到野生株的水平。在生物被膜状态下(图8),48 h达到平台期,野生株、缺失株和回复株基本没有生长差异。
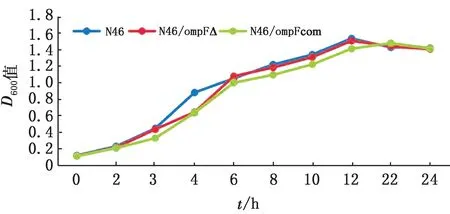
图7 生长曲线
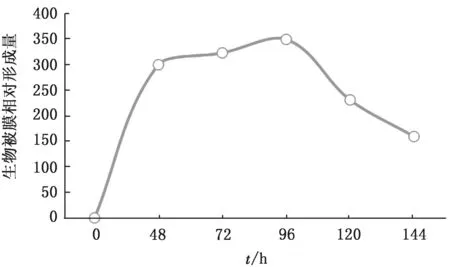
图8 生物被膜形成周期
2.4 RNA质量分析在生物被膜状态下提取的大肠杆菌N46野生株,omp F基因缺失株和回复株的总RNA 的A260∶A280在1.8~2.0之间,质量浓度均超过100 mg/L,琼脂糖凝胶电泳后,凝胶成像分析可见5S,16S和23S 3条明显的条带(图9),提取总RNA 质量较好,无明显降解。
2.5 mRNA的定性检测逆转录后,分别以16S RNA R 和16S RNA F,intⅠF,intⅠR 为引物进行PCR,经琼脂糖凝胶电泳鉴定各样本均有16S RNA(218 bp)和intⅠ(565 bp)表达(图10,11),表明各菌株在2 种状态下提取的RNA 基本完整且均有intⅠm RNA 转录。
2.6 intⅠ基因在生物被膜状态下mRNA 表达水平差异比较荧光定量PCR 结果显示,大肠杆菌野生株,omp F基因缺失株和回复株在生物被膜状态下的c DNA 的内参基因16S RNA 和intⅠ均得到有效扩增(图12,13),有明显的指数期和平台期,熔解曲线形成单一峰,无非特异性峰出现,说明扩增产物特异性较好。根据16S RNA 和intⅠ的Ct 值,应用相对定量法(2-△△Ct)分别计算N46野生株,
omp F基因缺失株和回复株在生物被膜状态下intⅠ表达量。结果显示,在生物被膜状态下omp F基因缺失株intⅠ基因的表达水平比野生株明显降低,回复株的表达水平会有所升高,但回复不到野生株的表达水平(表2)。
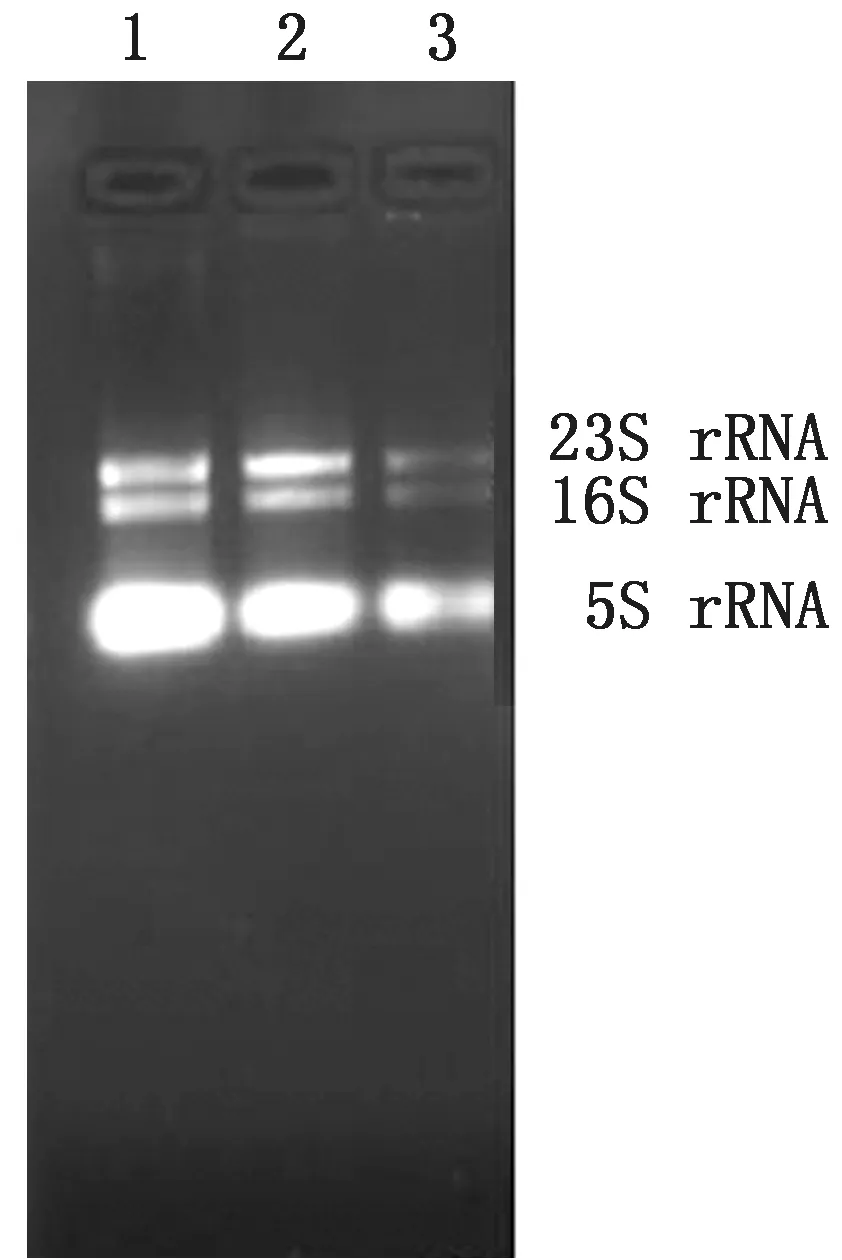
图9 总RNA 提取电泳图 1.野生株;2.缺失株;3.回复株
图10 cDNA 16S RNA PCR 电泳图 M.DL2000 DNA Marker;1.野生株;2.缺失株;3.回复株
图11 cDNA intⅠPCR 电泳图 M.DL2000 DNA Marker;1.野生株;2.缺失株;3.回复株
3 讨论
大肠杆菌作为一种条件性致病菌,分布广泛,能够引起人和动物全身性疾病。随着规模化,集约化畜牧业的发展,大肠杆菌病已经成为危害中国畜牧业的主要传染病之一,给畜牧业造成重大的经济损失。尤其随着抗生素的滥用,使大肠杆菌耐药现象已经成为全世界共同关注的热点问题。但由于耐药机制错综复杂,获得耐药性的速度越来越快,对临床目前使用的药物广泛耐药已成为治疗的难题。
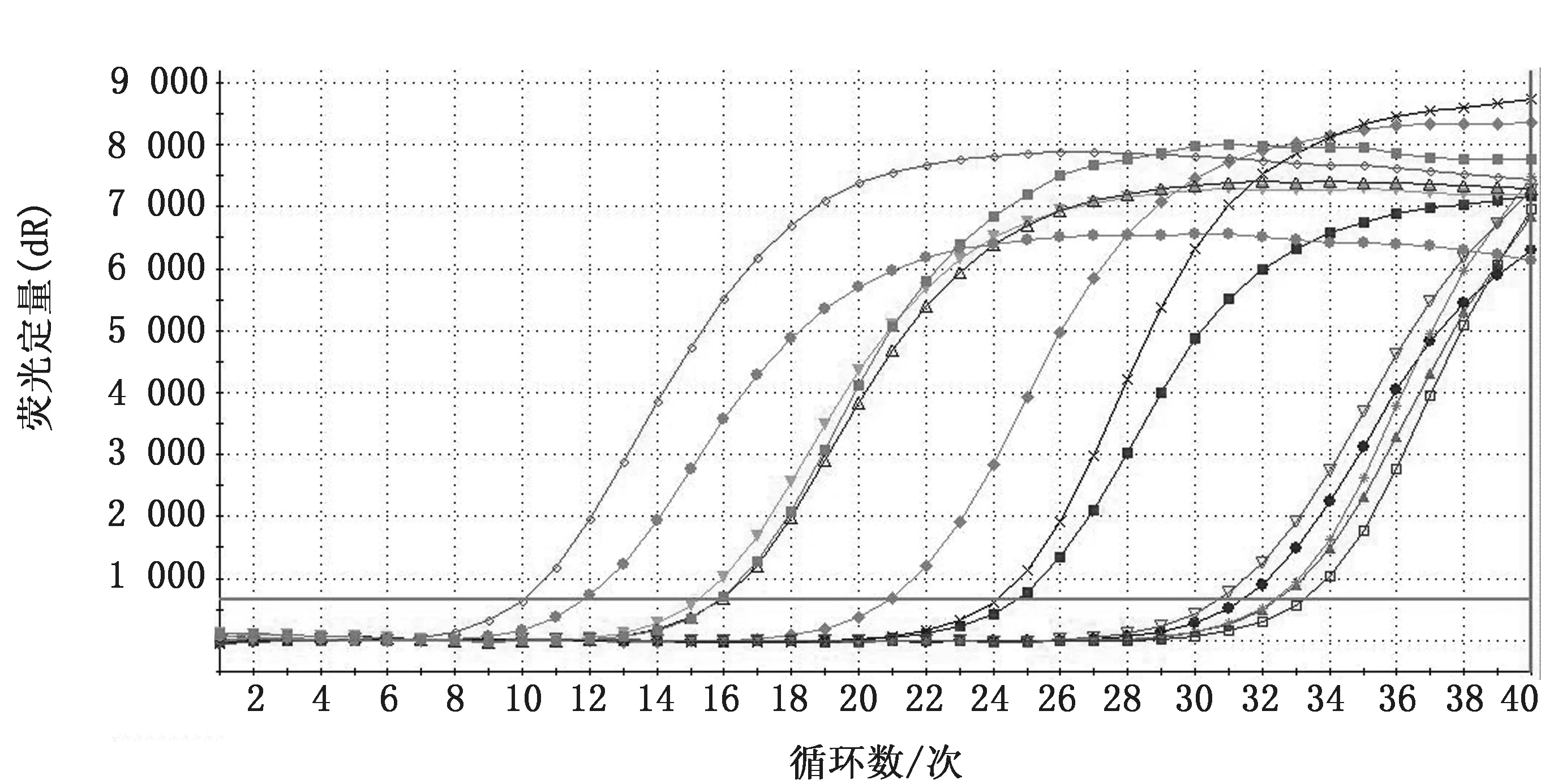
图12 intⅠ荧光定量RT-PCR 扩增曲线
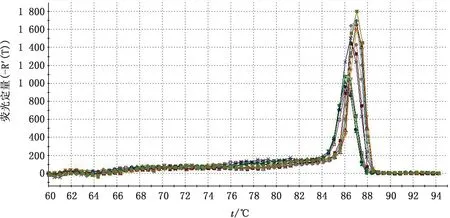
图13 intⅠ荧光定量RT-PCR 熔解曲线

表2 各菌株intⅠm RNA 相对表达结果
细菌的生物被膜是其为适应环境而形成的菌落聚集物,由多糖蛋白等复合物将细菌包裹其中而形成的膜样结构。细菌形成生物被膜后,由于其特殊的结构,耐药性会发生一定程度的改变。有研究发现,某些能形成生物被膜的革兰阴性菌的耐药率显著高于不能形成生物被膜的菌株[8],一些基因的表达水平和质粒传递效率与浮游状态相比也有所变化,LARISSA 等[9]发现生物被膜状态下细菌质粒的传递效率比浮游状态高,还有研究发现生物被膜状态下很多蛋白的表达量会出现不同程度的上调和下降[10]。
对于Ⅰ类整合酶的研究虽然已经从最初的检测阶段进入到了研究其影响机制方面,但依旧鲜少研究报道。人们只知道rec A基因可以通过应激反应影响Ⅰ类整合酶基因的表达[11-12],omp F基因作为抗生素进入细胞的主要通道,它对耐药基因的转移是否也有影响,目前尚无报道。
本试验以耐药基因的水平转移为出发点,研究了omp F基因对大肠杆菌I类整合酶基因在生物被膜状态下表达量的影响,我们发现在生物被膜状态下omp F基因缺失株intⅠ基因的表达水平比野生株明显降低,回复株的表达水平会有所升高,但仍回复不到野生株的表达水平。原因可能有以下几个:(1)外膜蛋白是小分子亲水物质出入细菌的通道,对生物被膜的形成有一定的影响[13],所以由于omp F基因的缺失,大肠杆菌形成生物被膜后,抗生素进入细菌的数量减少,Ⅰ类整合酶基因的表达水平会显著下降,影响细菌进行密集接触并获得和传递耐药基因盒,降低整合酶对耐药基因的捕获概率。(2)生物被膜内的细菌在生长过程中会分泌一些小分子信号到周围环境中,当它们的浓度达到一定程度,就会调节某些基因表达,使某些细菌的基因水平转移和DNA 合成更频繁。但由于omp F基因的缺失,小分子出入细菌通道被破坏,所以降低了基因的水平转移和DNA 合成。(3)通过生长曲线可以看出,虽然omp F基因不是大肠杆菌生长繁殖的必需功能性基因,敲除该基因不会导致菌株的死亡,但会对菌株的生长有一定的影响。所以其基因回复株虽然能使其Ⅰ类整合酶的表达水平有所升高,但不能回复到野生株的表达水平。
综上所述,生物被膜的形成与外膜蛋白密切相关,本研究中生物被膜的状态是其成熟的生物被膜状态,但生物被膜的形成过程比较复杂,在其形成的不同阶段,基因的表达水平也发生着一定的变化,所以omp F基因在生物被膜形成的不同阶段对Ⅰ类整合酶基因的表达的影响有待于进一步的探讨。此外,由于生物被膜是很多抗生素进入细菌的主要通道,所以在不同抗菌药物压力下,Ⅰ类整合酶基因的m RNA 转录水平是否存在差异仍有待研究。
