鸡源抗血清4型Ⅰ群禽腺病毒单链抗体文库构建及筛选
2020-03-13高倩文尹燕博徐守振青岛农业大学动物医学院山东青岛266109
高倩文,孙 举,尹燕博,徐守振 (青岛农业大学 动物医学院,山东 青岛266109)
血清4型Ⅰ群禽腺病毒(group Ⅰfowl adenovirus serotype 4,FAd V-4)感染,是以鸡包涵体肝炎和心包积液为主要临床症状的鸡急性传染病,临床上又称“鸡心包积液-肝炎综合征”[1],该病发病急,传播速度快,主要感染4~8周龄鸡,感染后病死率可达40%~90%[2],该病的发生给养鸡业造成了重大的经济损失。已有研究表明高免卵黄抗体对该病有明显的预防和治疗效果[3],但却存在生产工艺繁琐、环境污染等问题。近年来基因工程抗体技术的发展,为抗体生产技术开拓了一个新局面,尤其以噬菌体展示研发靶动物源化基因工程抗体的技术,发展最为迅速[4]。该技术已经在猪[5]、犬[6]、禽[7]等抗体研究领域得到广泛应用。到目前为止,国内外尚未见有关FAd V-4 基因工程单克隆抗体研究的报道。因此制备FAd V-4 特异性基因工程单克隆抗体,省去了养鸡、免疫、收集高免蛋卵黄液提纯抗体等繁琐过程,更符合低碳、环保的现代理念[8],对预防和治疗鸡心包积液-肝炎综合征具有积极意义。本研究通过噬菌体展示技术构建鸡源抗FAd V-4基因工程抗体文库,筛选出与FAd V-4结合的单链抗体,为鸡心包积液-肝炎综合征的诊断和治疗奠定基础。
1 材料与方法
1.1 菌种、质粒与试剂XL1-Blue感受态细胞由本实验室制备,pComb3XSS 载体由中国科学院微生物所惠赠;鸡外周血淋巴细胞分离液试剂盒、TMB显色液购自北京索莱宝科技有限公司;TRIzol、PrimeScriptTMⅡ1st Strand cDNA Synthesis Kit、T4DNA 连接酶购自宝生物(大连)工程有限公司;限制性内切酶SfiⅠ、M13K07 辅助噬菌体购自NEB(美国)生物工程公司;微量琼脂糖凝胶DNA回收试剂盒购自康为世纪生物技术有限公司。
1.2 引物根据Gen Bank中登录的鸡抗体基因序列,分别在保守区域设计1对扩增抗体重链可变区基因(VH)和轻链可变区基因(VL)的简并引物。在重链VH5′端和轻链VL3′端插入部分Linker片段(斜体部分),在重链VH3′端和轻链VL5′端插入SfiⅠ酶切位点(下划线部分),引物序列见表1,由睿博兴科生物技术有限公司合成。

表1 抗体可变区基因扩增引物及扩增片段大小
1.3 动物与免疫以60日龄SPF来航鸡为试验动物,采用皮下注射进行免疫,免疫原为灭活纯化的FAd V-4疫苗;第1次免疫使用弗氏完全佐剂,剂量为1.0 m L/只,第2,3,4次免疫使用弗氏不完全佐剂,剂量为1.5 m L/只,每次免疫间隔时间为14 d。
1.4 免疫血清抗体效价的测定第4次免疫结束后7 d翅静脉采血,离心收集抗血清,采用琼脂扩散试验检测血清抗体效价,抗体效价在1∶24以上的为免疫合格试验动物[9]。
1.5 外周血淋巴细胞的分离及总RNA 的提取取鸡外周血,按照Solarbio鸡外周血淋巴细胞分离液试剂盒说明书分离淋巴细胞,TRIzol法提取细胞总RNA,用超微量分光光度计测定其浓度及A260/A280比值,分析其纯度;1.0%琼脂糖凝胶电泳分析其完整性。
1.6 VH 和VL 基因的扩增以提取的总RNA 为模板,按照TaKaRa反转录试剂盒说明书合成cDNA,以cDNA 为 模 板PCR 扩 增VH和VL基 因。反应体系:1× PCR Mix 18μL,上、下游引物各0.5μL,cDNA 1μL;反应程序:95℃预变性5 min;95℃变性30 s,55℃退火30 s,72℃延伸40 s,35个循环;72℃终延伸10 min。PCR 产物经1.0%琼脂糖凝胶电泳鉴定后,回收纯化VH和VL片段。
1.7 重组sc Fv 基因的构建以纯化的VH和VL片段为模板,通过SOE-PCR 将含有Linker序列的VH和VL基因连接成sc Fv基因,将等量的VH和VL加到PCR 反应体系中,反应程序同1.6。PCR产物经1.0%琼脂糖凝胶电泳鉴定后回收纯化目的片段。
1.8 scFv与pComb3XSS载体的连接用SfiⅠ分别酶切scFv基因和p Comb3XSS载体,酶切后进行胶回收,将回收的sc Fv与pComb3XSS用T4连接酶进行16℃过夜连接,连接体系为:sc Fv 1.5μL,p Comb3XSS 2.0μL,T4DNA Ligase 1.0μL,10×T4DNA Ligase Buffer 1.0μL,dd H2O 4.5μL。
1.9 scFv抗体文库的构建将20μL 连接产物电转化至80μL XL1-Blue感受态细胞中,电击后加入1 m L SOC 培养基,37℃,220 r/min振荡培养1 h,取20μL菌液涂在含Amp(100 mg/L)的平板上,检测连接产物的转化效率。向菌液中加入9 m L 含Amp和葡萄糖的培养基,37℃,220 r/min振荡培养至D600=0.5。加入M13K07辅助噬菌体进行感染,振荡培养1 h。离心去除培养基,用等体积含100 mg/L Amp,50 mg/L Kana,1 mol/L IPTG 的培养基重悬菌体,220 r/min过夜培养;离心收集上清,向上清中加入NaCl/PEG8000沉淀噬菌体,4℃过夜后离心,弃上清,用PBS 重悬沉淀,上清即为scFv抗体初级文库。
1.10 scFv抗体文库滴度的测定取1μL scFv抗体文库,用PBS进行10倍比稀释,从10-7~10-9稀释度的液体中各取出20μL 加入到180μLD600=0.5的XL1-Blue菌液中,感染30 min。各取20μL菌液涂在含有Amp的LB 平板上,37℃培养过夜,次日计算菌落数。
1.11 scFv抗体文库的富集淘筛用50 mmol/L Na HCO3(p H9.6)溶液将纯化的FAd V-4包被在酶标板上,每孔100μL,4℃过夜;次日弃去包被液,每孔加入100μL封闭液37℃封闭2 h,弃去封闭液,用PBST 洗 涤3 次;每 孔 加 入100μL scFv 抗 体,37℃孵育1 h;PBST 洗涤3次后加入洗脱液,洗脱吸附在酶标板孔中的产物,用中和缓冲液进行中和,取1μL液体进行抗体文库滴度测定,剩余液体感染XL1-Blue感受态细胞,在辅助噬菌体M13K07的作用下产生大量噬菌体,即可制备出第1轮筛选后的scFv抗体文库,取1μL抗体文库进行滴度测定,剩余的进行下一轮筛选;重复以上富集筛选步骤,如此重复4轮。
1.12 Phage ELISA鉴定scFv抗体随机挑取第4轮筛选的单克隆接种于5 m L LB液体培养基中,37℃振荡培养至D600=0.5,加入辅助噬菌体M13K07进行拯救,用NaCl/PEG8000沉淀噬菌体,用PBS 重悬沉淀,获得的上清即为单个克隆的scFv抗体,直接用于Phage ELISA 检测。用50 mmol/L Na HCO3(p H9.6)溶液将1 000 TCID50的FAd V-4包被在酶标板上,M13K07 为阴性对照,BSA 为空白对照,4℃过夜;次日加入封闭液37℃封闭2 h,用PBST洗涤3 次;加入单个克隆的sc Fv 抗体,37℃孵育2 h;PBST 洗涤3次,加入HRP 标记的抗M13 酶标二抗,37℃孵育1 h;PBST 洗涤3次,加入TMB显色液,37℃反应10 min;加入2 mol/L H2SO4终止反应,用酶标仪检测D450读值。
2 结果
2.1 免疫血清抗体效价测定结果第4次免疫结束后7 d采血,收集抗血清,采用琼脂扩散试验检测血清抗体效价,抗体效价为1∶25(图1),说明试验动物免疫合格。
2.2 VH 和VL 基因扩增结果从免疫鸡的外周血淋巴细胞中提取总RNA,经反转录合成cDNA,以cDNA 为模板扩增抗体的VH和VL基因,琼脂糖凝胶电泳结果显示,VH基因片段长度约为420 bp,VL基因片段长度约为390 bp(图2),与预期结果相符。

图1 FAd V-4琼脂扩散试验结果 a.2-5 FAd V-4血清;b.未稀释FAd V-4血清;c.2-4 FAd V-4血清;d.FAd V-4病 毒;e.2-1 FAd V-4 血 清;f.2-3 FAd V-4 血 清;g.2-2 FAd V-4血清

图2 VH 和VL 基因PCR 扩增结果 M.DL2000 DNA Marker;1.VH 基因PCR 产物;2.VL 基因PCR 产物
2.3 重组sc Fv 基因构建结果以VH和VL基因为模板,通过SOE-PCR 扩增引入Linker接头构建VL-Linker-VH片段,扩增的目的片段大小约为850 bp(图3),与预期结果相符。
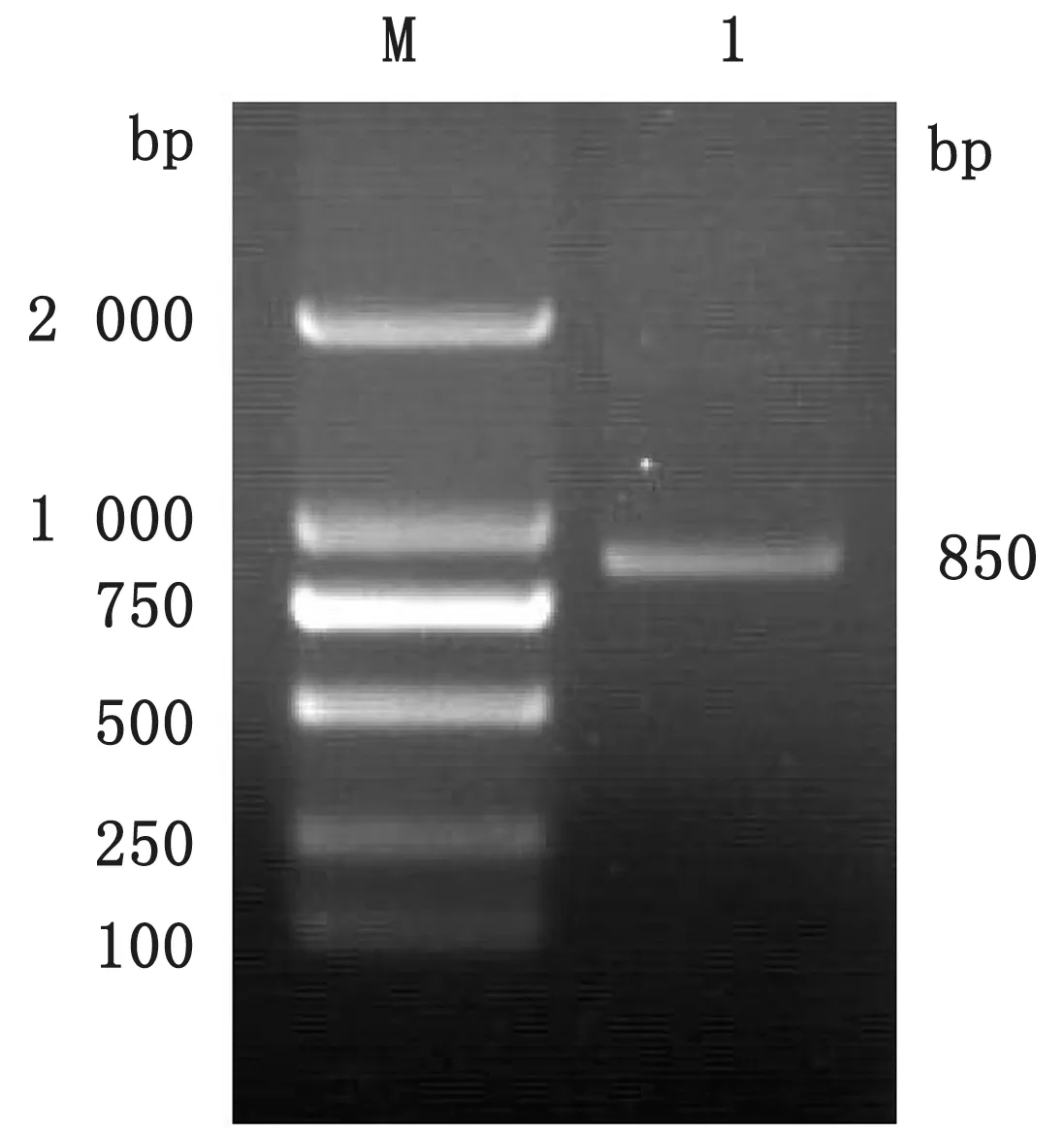
图3 sc Fv 基因PCR 扩增结果 M.DL2000 DNA Marker;1.sc Fv 基因PCR 产物
2.4 scFv抗体文库验证结果将连接产物电击转化至大肠杆菌XL1-Blue感受态细胞中,电转产物涂板检测转化效率。从平板上随机挑取12个菌落进行PCR检测,PCR产物条带大小约为1 000 bp,转化效率约为83%(图4);随机将PCR 检测结果为阳性的菌液抽提质粒,经SfiⅠ酶切鉴定,在850 bp 位置处有特异性目的条带(图5)。

图4 单链抗体文库菌落PCR 扩增结果 M.DL2000 DNA Marker;1~12.单克隆菌落

图5 单链抗体文库酶切验证结果 M.DL5000 DNA Marker;1~8.酶切结果
2.5 scFv抗体文库滴度测定结果通过细菌电转化技术构建单链抗体文库,采用抗体文库容量鉴定方法,将10-7,10-8,10-93个稀释度的菌液涂布在含Amp(100 mg/L)的LB 平板上,37℃培养过夜,估算出单链抗体原始文库的库容量为9.5 ×1010PFU/m L(图6)。
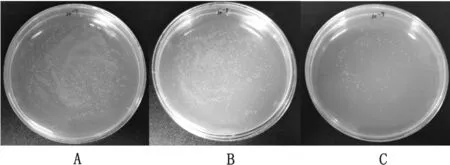
图6 单链抗体文库构建结果 A.10-7;B.10-8;C.10-9
2.6 scFv 抗体文库富集淘筛结果以纯化的FAd V-4为抗原,对构建的单链抗体文库进行4轮“吸附-洗脱-富集”筛选,每轮筛选做滴度测定。结果显示(表2),富集后的抗体文库滴度比初级抗体文库提高了276倍,说明特异性噬菌体得到有效富集。

表2 单链抗体文库的富集淘筛结果
2.7 Phage ELISA鉴定结果从第4轮淘筛库中随机挑选48 个scFv阳性单克隆进行Phage ELISA鉴定,根据判定标准[10],P/N>2.1且P>0.2为阳性,结果显示4株单克隆为阳性,其中2和44号2株sc Fv抗体与FAd V-4亲和活性较高(图7),将这2株单克隆送至公司测序,序列比对分析发现这2株单克隆的基因序列以及推导的氨基酸序列完全一致,最终筛选到1株与FAd V-4具有高亲和力的单链抗体。
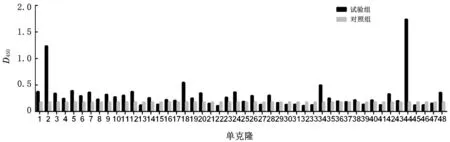
图7 噬菌体抗体结合活性
3 讨论
本研究采用的噬菌体展示靶动物源化基因工程抗体技术,较传统的单克隆抗体制备技术有其独特的优势[11]。研究中以鸡抗体序列为参照设计特异性引物,构建鸡源抗FAd V-4单链抗体文库,相对于传统的鼠源单抗而言,省去细胞融合的步骤,避免了反复亚克隆的繁琐程序。传统单抗的筛选能力在上千个克隆以内,而噬菌体展示技术可筛选108以上个克隆,该技术可以使特异性抗体得到有效富集,能高度简化筛选过程,增加筛选容量,扩大筛选范围[12]。
本研究构建的鸡源抗FAd V-4单链抗体文库库容为9.5×1010PFU/m L,一般而言构建的抗体库容越大,筛选得到特异性抗体的机率就越大。鸡免疫后,抗原刺激机体免疫系统,致使淋巴细胞产生多种不同的、并与之相适应的特异性抗体,用免疫后的鸡外周血淋巴细胞为抗体基因来源,不仅可以增加抗体库的多样性[13],而且更容易筛选到特异性的单链抗体。重组质粒的转化效率也是影响库容的限制性因素,先前有文献报道,采用CaCl2转化感受态细菌转化效率较低[9],因此本试验采用转化效率较高的细菌电转化技术,并通过多次电转累积库量。总的来说,本研究构建的单链抗体文库的阳性克隆率较高,多样性较好。通过4 轮“吸附-洗脱-富集”筛选,采用Phage ELISA 方法鉴定抗FAd V-4单链抗体的特异性,在筛选过程中可能由于缺乏对某些操作过程具体条件的摸索,包括抗原的包被浓度,抗体的稀释度以及洗涤次数等,导致在筛选过程中大量抗体链丢失,最终只筛选到1株与FAd V-4具有高亲和力的单链抗体。后续我们将继续优化试验条件,筛选出尽可能多的与FAd V-4具有较高亲和力的单链抗体。
本研究成功构建鸡源抗FAd V-4 单链抗体文库,并通过噬菌体展示技术筛选到1株与FAd V-4具有较高亲和力的单链抗体,以期为鸡心包积液-肝炎综合征的诊断和治疗提供帮助。
