基于网络药理学对山楂治疗非酒精性脂肪肝病主要活性成分及潜在靶点分析❋
2020-03-13林道斌程亚伟
林道斌,杨 华,程亚伟
(海南省中医院脾胃肝病科 海口 570000)
非酒精性脂肪性肝病(NAFLD)是指排除酒精性因素及其他明确肝损害因素外,以甘油三酯为主的脂肪类物质在肝细胞中异常堆积为主要病理特征的一种肝脏代谢疾病[1]。大量脂肪类物质在肝脏的蓄积极易诱发肝细胞脂肪变性及炎症反应,致使肝纤维化形成,最终将导致肝脏恶性病变的发生[2]。流行病学调查表明,NAFLD在我国的发病率约为15%[3],积极发掘治疗NAFLD的药物已刻不容缓。
山楂为常见的药食两用类药物,有文献表明对NAFLD有着良好治疗效果[4]。山楂提取物山楂总黄酮能从抗氧化应激[5]、促进肝脏脂质代谢[6]、抗血小板聚集[7]等多个方面对NAFLD产生治疗作用。目前关于山楂的中药药理学研究多从单个成分展开,与中草药多成分、多靶点发挥功效的实质相悖。因此课题组运用网络药理学[8]方法,研究山楂治疗NAFLD的作用机制,并为进一步试验室研究提供先导信息。
1 材料与方法
1.1 山楂主要活性成分及作用靶点筛选
中药系统药理学分析平台(TCMSP)(http://lsp.nwu.edu.cn/tcmsp.php)是由西北农林科技大学依托文献挖掘和数据库整合建立的中药系统药理学数据库和分析平台。该数据库收录了500 味常用中药以及30069 个中药化合物的药物化学和药物-靶标蛋白网络-疾病网络、药物代谢动力学的基本信息[9],是目前研究网络药理学最常用的的数据库。通过该数据库检索山楂的所有活性成分,再根据口服利用度(OB)≥30%和类药性(DL)≥0.18进一步筛选药物的主要活性成分,OB和DL是评判药物有效利用度的关键指标。一般而言,OB≥30、DL≥0.18的活性成分可视为药物的主要活性成分[10]。再通过TCMSP检索各个活性成分的作用靶点蛋白,然后利用Uniprot数据库[11]将获取的蛋白名称转换为基因名。
1.2 疾病靶点的获取与交集靶点的筛选
运用gene cads数据库(https://www.genecards.org/)[12]、人类孟德尔遗传综合数据库(OMIM) (http://www.omim.org/)[13]和治疗靶点数据库(TTD) (http://bidd.nus.edu.sg/group/cjttd/)[14]寻找NAFLD的疾病靶点建立数据集,并与1.1筛选出的药物靶点进行vnne分析,获取交集靶点。
1.3 活性成分-靶点网络的建立
运用Cytoscape3.6.1软件[15]建立活性成分-靶点的相互作用网络关系图,再通过Network Analysis插件分析各个节点的度值(Dgree),根据网络节点的Dgree大小做进一步分析。
1.4 京都基因与基因组百科全书通路注释分析
最后再将1.2获取的交集靶点导入DAVID在线平台(https://david.ncifcrf.gov/)[16]行GO、KEGG功能注释和富集分析。在DAVID平台,基因标识符合选择OFFICIFAL-GENE-SYMBOL,基因背景栏勾选HomoSapiens,然后选择“Functional Annotation Tool”作为分析工具,所有检取结果根据FDR(错误发现率)<0.01进行筛选。
2 结果
2.1 活性成分及药物靶点筛选结果
在TCMSP数据库并无山楂常用药用部位果肉的条目,但有山楂叶相关条目。后通过检索文献[17]山楂叶活性成分与果肉相似,并常作为代用品使用。故以TCMSP数据库中山楂叶活性成分作为研究对象,并根据OB≥30%和DL≥0.18作为条件共检索到6种主要活性成分,分别是槲皮素(quercetin)、山柰酚(kaempferol)、异鼠李素(isorhamnetin)、豆甾醇(Stigmasterol)、表儿茶素(ent-Epicatechin)、谷甾醇(sitosterol)等。药物靶点共检索到279个,去重保留唯一值后有194个,6种活性成分均有各自的作用靶点。
2.2 交集靶点筛选结果与活性成分-靶点网络的建立
以NAFLD的英文全称non alcohol fatty liver disease为关键词,在genecads数据库共找到3538个相关靶点基因,OMIM数据库找到202个,TTD数据未发现相关靶点。上述靶点去重保留唯一值后共获得NAFLD靶点基因3645个,与2.1经Uniprot数据库校正过基因名的靶点进行vnne分析后,确定了148个山楂治疗NAFLD发挥作用靶点(见图1)。而后将这148个靶点与其对应的活性成分导入Cytoscape3.6.1软件后,建立一个各个节点联系密切的相互作用网络关系图(见图2)。在该图中共有154个节点,绿色三角形的活性成分节点有6个,红色圆形的靶点节点有148个。本研究还运用Cytoscape 中的Network Analysis-Analyze Network插件对该网络图中的每个节点进行分析,得到网络中各个节点的度值(Degree),槲皮素、山柰酚、异鼠李素、豆甾醇等4个活性成分节点Degree明显高于表儿茶素和谷甾醇(见表1),这也意味着这4种活性成分在山楂治疗NAFLD过程中占有重要地位。靶点方面,Degree均值约等于1,有48个靶点节点Degree高于均值(见表2),这些靶点可能是山楂治疗NAFLD的关键调控靶点,Degree均值最高的10个靶点分别是前列腺素G/H合酶1(PTGS1)、前列腺素G/H合酶2(PTGS2)、过氧化物酶体增殖物激活受体(PPARG)、雄激素受体(AR)、一氧化氮合酶(NOS3)、二肽基肽IV(DPP4)、丝氨酸蛋白酶1(PRSS1)、凝血因子VII(F 7)、单胺氧化酶B(MAOB)、转录因子P65(RELA)。
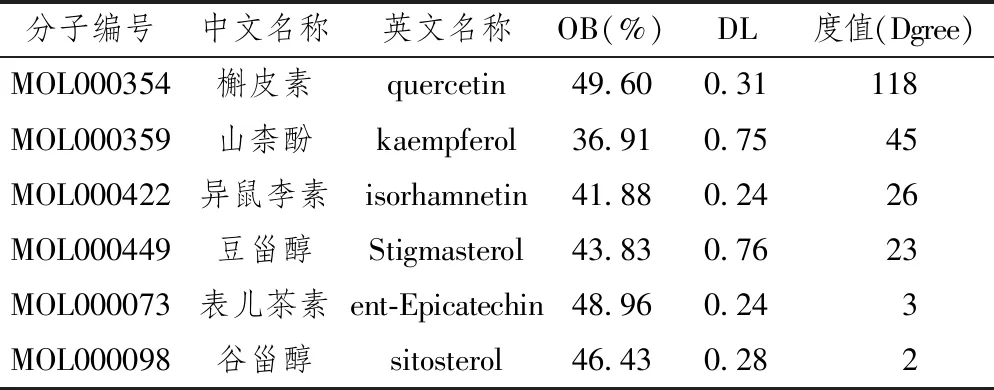
表1 活性成分-靶点网络中活性成分关键节点拓扑学性质

表2 在活性成分-靶点网络中高于靶点均值的基因比较

图1 药物靶点与HAG疾病靶点vnne分析图

图2 活性成分-靶点相互作用网络关系图(节点大小与Degree成正比)
2.3 GO功能注释及KEGG通路富集分析结果
利用DAVID平台的GO和PATHWAY富集分析功能对148个靶点进行研究,GO富集分析中根据FDR<0.01确定350条GO条目,涉及生物过程的有260条,如对药物反应、转录正调节、RNA聚合酶II启动子转录的正调节等。涉及分子功能的有60条,如酶结合、蛋白质结合、RNA聚合酶II转录因子活性等。涉及细胞组成的有30条,如细胞外空间、细胞质、膜筏等。同时根据FDR<0.01共找到97条作用通路,如癌症通路、TNF信号通路、HIF-1信号通路等(表3表4分别列举了FDR最小的前20条GO和KEGG通路分析结果)。

表3 潜在靶点的GO分析结果比较(FDR<0.01)

表4 潜在靶点的KEGG分析结果比较(FDR<0.01)
3 讨论
本研究共发现6种主要活性成分及148个作用靶点,其中Degree值最高的4种主要成分里,槲皮素能通过抑制炎症因子表达[18]、抗氧化应激反应[19]、改善胰岛素抵抗[20]及脂代谢紊乱[21]等诸多途径对NAFLD产生治疗作用。另一化合物山柰酚也有类似抗炎[22]和抗氧化[23]作用,异鼠李素可以抑制胶原蛋白的形成[24]、抗肝纤维化,并且可以抑制PPARγ的表达,防治肝脂肪变性[25]。豆甾醇可以提高过氧化氢酶、超氧化物歧化酶、谷胱甘肽的表达[26]以及降低过氧根离子的生成速率,清除肝内氧自由基,降低肝脂肪过氧化[27]
靶点方面,前10个靶点分别为PTGS1、PTGS2、PPARG、AR、NOS3、DPP4、PRSS1、F7、MAOB、RELA等。其中前列腺素G/H合酶1(PTGS1)和前列腺素G/H合酶2(PTGS2)又称环氧化酶(COX1/2)[28]是将花生四烯酸转化为前列腺素的关键性限速酶[29],COX1为结构型同工酶,COX2为诱导型同工酶[30]。COX1广泛分布于人体的组织脏器如胃、肾、血管等,对调节胃、肾的血流量、血管舒张、胃黏液分泌起重要作用,维持着机体的正常生理过程[31]。但COX1在NAFLD的疾病过程中扮演的角色目前鲜有报道,研究主要集中在另一种亚型COX2上。
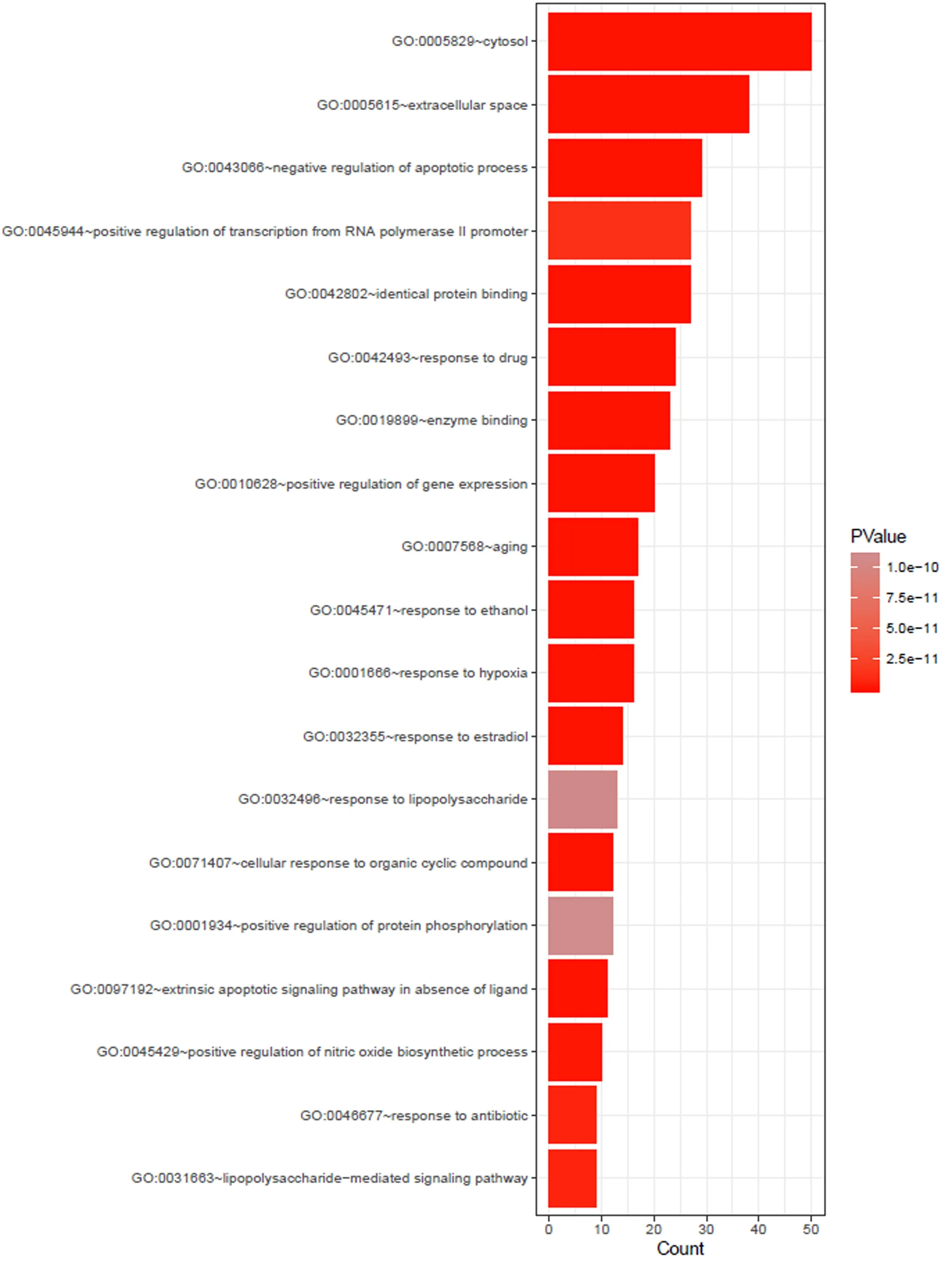
图3 潜在靶点的GO分析结果条形图(FDR<0.01)

图4 97条KEGG分析结果气泡图(FDR<0.01)
COX2在正常细胞中的表达水平很低,但在刺激因子如炎症介质、内毒素等作用下会急剧上调,通过调高前列腺素的合成参与机体的炎症反应[32]。有报道称[33],COX2的表达水平与肝功能损伤程度成比。在NAFLD早期由于肝细胞脂肪变性可诱导COX2的高表达[34],而COX2及其介导产生的白介素-6、肿瘤坏死因子-α、前列腺素等又会干扰正常的肝细胞脂质代谢过程[35],从而形成恶性循环。结合目前研究,山楂可能通过作用于环氧化酶靶点控制炎症反应,恢复肝脏正常脂质代谢。
过氧化物酶体增殖物激活受体(PPARG) 是一类由配体激活的转录因子,目前已发现有3种亚型PPARα、PPARβ、PPARγ等[36]。其中由PPARG编码的PPARγ如果过度表达,可抑制环磷酸腺苷反应元件与蛋白的结合,诱导肝脂肪细胞变性[37],进而演变为非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)。但值得注意的是,如果敲除小鼠PPARγ基因反而会促进NASH的形成[38]。更有研究显示[39],PPARγ可以调高脂联素的表达,控制炎症因子的分泌,延缓肝纤维化进程。并且PPARγ还可以增加肉毒碱脂酰转移酶以及乙酰辅酶A的表达减少肝脂肪沉积[40]。总的来说,PPARγ既可以加速NAFLD疾病演变,又可以缓解脂肪变性及肝纤维化,其机理暂不明晰,可能与PPARγ的其他亚型有关。
雄激素受体(AR)属于核受体超家族成员,分布于体内多个组织脏器。由其介导的雄激素在糖脂代谢过程中发挥着重要作用。AR可以提高雄激素的释放,从而加强对肝内硬脂酰辅酶A去饱和酶1、脂蛋白酯酶、脂肪酸合成酶、乙酰辅酶A羧化酶等多个脂代谢关键酶的调控,维持脂肪合成与分解的稳态[41]。另外,雄激素可以降低肿瘤坏死因子α、白介素6、白介素1β的表达水平[42],减轻炎症因子对肝细胞的损害。山楂作用于AR靶点,可从调控脂代谢及炎症反应途径产生治疗作用。
NOS3又称内皮型一氧化氮合酶(eNOS),是人体内合成一氧化氮(NO)的关键性合成酶之一[43],尤其合成的NO在肝脏损伤时脂质过氧化和氧化应激反应中占有重要地位,过量合成的NO会破坏NO与O2-的平衡,生成过氧化亚硝酸阴离子,继而造成不饱和脂肪酸、胆固醇、超氧化物歧化酶的氧化[44],加剧氧化应激程度,造成严重后果。故而山楂作用于eNOS靶点,可减轻NAFLD时的氧化应激反应。
二肽基肽IV(DPP4)既往研究多集中于治疗2型糖尿病的作用。但近年来研究发现[45],DPP4还参与多种慢性肝病的发生发展,其中就包括NAFLD。DPP4参与NAFLD的机制与其促进胰高血糖素样肽-1(GLP-1)降解有关[46],GLP-1可以提高机体对胰岛素的敏感性,减少肝脏脂肪沉积以及调节肝脏脂肪酸代谢[47]。而DPP4的高表达会导致GLP-1的大量失活,导致上述生物过程的失控,所以抑制DPP-4可以改善肝细胞脂肪变性,山楂作用于该靶点,可能也扮演着DPP-4抑制剂的角色。
PRSS1在受到炎症因子的刺激时会继发磷酸化[48],而磷酸化过程会阻碍胰岛素受体底物正常的酪氨酸磷酸化[49],继而使胰岛素受体底物与SH2结构域信号分子结合受阻[50],干扰胰岛素信号传导而诱发胰岛素抵抗。凝血因子VII(F7)在NAFLD导致的肝脏损伤时,肝星状细胞会在损伤部位募集,这一过程会诱导凝血因子的激活,将循环纤维蛋白原转化为纤维蛋白,并促进血小板聚集[51],参与肝纤维化的形成和肝内结构的重建。这也是抗凝血药或抗血小板药能够治疗肝纤维化的机制之一[52]。
MAOB属于黄素结合蛋白(MAO)的一种亚型[53]。MAO广泛分布于人体心、肺、肝、肾等器官,能够通过与氧离子结合催化细胞中的单胺氧化反应[54]在肝脏发生病变时,如NAFLD疾病过程中,在刺激因子的作用下MAO能够提高胶原与弹性蛋白结合率,形成大量胶原纤维,继而引发肝纤维化的发生。RELA又称转录因子P65,是NF-κB发挥作用的重要异源二聚体之一[55]。NF-κB通路在机体内会促进肝星状细胞的增殖,并释放炎症因子,从而加速肝纤维化的发展[56]。并且有研究表明,抑制NF-κB通路的信号传导,可以减轻肝脏的炎症反应,缓解肝脏损伤[57]。因此推测,山楂可以从调节胰岛素抵抗、抗炎、抗纤维化等多个层面对NAFLD形成治疗作用。
本研究还通过DAVID平台,根据FDR<0.01确定了97条相关通路,如HIF-1[58]和TNF[59]信号通路均可引起肝星状细胞的增殖,诱发肝纤维化。Toll样受体信号通路对病原相关分子模式和损伤相关分子模式的识别,会激活一系列炎症级联反应,所产生的炎症因子对肝细胞持续刺激,会导致胶原蛋白和基质蛋白在肝内的沉着,引起肝纤维化[60]。胰岛素信号通路与NAFLD关系密切,因脂质异常[61]、炎症反应[62]、转录因子X-Box结合蛋白1表达增加[63]等,导致胰岛素信号传导障碍,继而引发的胰岛素抵抗,不仅是“二次打击”假说的核心[64],而且也被“多重打击”学说认为是关键因素之一[65],所以对相关通路的调控也是山楂治疗NAFLD的关键步骤。
综上,本研究共发现6种主要活性成分和治疗过程中的148个关键靶点以及97条关键通路,结果与已有文献结论基本吻合,具有一定科学性,可为下一步的实验提供参考与借鉴。
