坎地沙坦酯对酒精性肝纤维化小鼠TGF-β1/Smads信号通路的影响
2020-03-13徐旭东段光琦刘洁杨辉钱叶本
徐旭东 段光琦 刘洁 杨辉 钱叶本
1安徽医科大学第一附属医院(合肥230022);2皖南医学院弋矶山医院(安徽芜湖241001)
酒精性肝纤维化(alcoholic liver fibrosis,ALF)是酒精性肝病(alcoholic liver diseases,ALD)的最常见形式,为肝硬化的前驱期[1]。研究[2]表明,死于肝硬化的患者约50%由ALF引起。然而,ALF病变隐匿且无有效的诊断方法,临床发现时多处于严重的肝纤维化期。目前临床认为ALF尚可逆转,但肝硬化和肝癌则不可逆转[3-4]。因此,预防肝纤维化进展为肝硬化是主要的治疗策略。但ALF进展的机制尚不完全清楚。研究[5-6]表明,转化生长因子-β(transforming growth factor-β,TGF-β)在脏器纤维化病理过程中发挥关键作用,并通过活化其下游Samd信号发挥生物学功能。研究[7]证实,坎地沙坦能在组织学上诱导肝纤维化改善,但其具体作用机制尚缺乏基础研究证实。本研究旨在用坎地沙坦酯干预ALF小鼠模型,检测小鼠肝脏病理组织学改变及TGF-β1/Smads信号通路关键分子表达水平的变化,探究坎地沙坦酯改善ALF的可能机制,为临床治疗ALF提供科学依据。
1 材料与方法
1.1 实验动物 健康雄性C57小鼠42只,体质量(20.5±2.25)g,10周龄。动物由南京医科大学南京生物医药研究院提供,许可证号:SCXK(苏)2015-0001,动物在皖南医学院附属弋矶山医院实验室饲养[温度:(22.0 ± 1)℃,湿度:(55.0 ± 1)%]。本实验小鼠有关所有操作经皖南医学院伦理委员会批准。
1.2 实验仪器 光学显微镜(德国,卡尔·蔡司),离心机(德国,艾本德),电泳仪,PCR扩增仪(加拿大,刘梅克斯),酶标仪(美国,赛默飞),切片机,包埋机。
1.3 实验试剂 乙醇、CCl4、AST、ALT和TG ELISA试剂盒(南京森贝伽生物科技有限公司),天狼星红染色试剂盒(上海信帆生物科技有限公司),橄榄油(南京道斯夫生物科技有限公司),兔抗小鼠TGF-β1,Smad3单克隆抗体(上海钰博生物科技有限公司),山羊抗兔二抗(北京百奥莱博科技有限公司)。
1.4 实验方法
1.4.1 动物分组、建模及干预 42只小鼠随机分为空白对照组(n=8)和ALF模型组(n=34),ALF小鼠模型按照文献[8]中的方法造模,模型组给予Lieber-Decarli酒精饮食(能量:30%酒精,35%脂肪,18%蛋白质,10%碳水化合物),从Lieber-Decarli饮食的第九周喂食5次,每周加1次25%CCl4注射[0.4 mL/(kg·d)],空白对照组接受非酒精性饮食(能量:35%脂肪,18%蛋白质,47%碳水化合物)和等量的生理盐水腹腔注射,小鼠单笼饲养以调整所有动物摄入能量相等,模型构建共91 d。成功构建ALF模型后,将ALF模型组中的24只小鼠(10只处死以确定ALF模型的建立)随机分为模型对照组、阳性对照组和实验组3组。模型对照组给予非酒精饮食和蒸馏水饲养,阳性对照组给予非酒精饮食和蒸馏水饲养,并给予水飞蓟素片干预[9-10](0.36 mg/g),实验组给予非酒精饮食和蒸馏水饲养,并给予坎地沙坦酯干预,剂量按照动物实验给药剂量换算表换算为小鼠剂量[11](0.021 mg/g),共干预30 d。
1.4.2 取材、切片和染色 过度麻醉处死小鼠,解剖分离小鼠肝脏,用预冷的生理盐水漂洗2~3次,切取部分置于-80℃保存,再切取约1 cm2肝组织投入40 g/L的多聚甲醛中4℃固定24 h以上。固定好的组织梯度酒精脱水,二甲苯透明,石蜡包埋,4 μm连续切片,并进行HE和天狼星染色,光镜下观察肝组织病理变化。
1.4.3 血浆中ALT、AST和TG水平的检测 干预完成后,麻醉小鼠,腹主动脉取血4 mL;并加入含有60 μL 10%EDTA和80 μL抑肽酶的无菌离心管中混匀,3 000 r/min离心15 min,分离血浆。取上清液于-80℃保存。ALT、AST和TG检测严格按照ELISA试剂盒说明书步骤操作。检测完成后,采用Origin 16.0软件进行标准曲线拟合,并确定曲线拟合方程,计算样本各指标浓度值进行统计分析。
1.4.4 肝脏指数 肝脏指数参照文献[8]中的计算方法:
1.4.5 Western blot检测蛋白水平 将收集的小鼠肝组织置于冰上,并剪碎。加入适量蛋白酶抑制剂和蛋白裂解液,裂解30 min,12 000 r/min 4℃离心15 min,取上清、分装。BCA法测定样品蛋白浓度,加入1/4蛋白体积的Buffer缓冲液混匀,加热变性,-20℃保存。每个泳道加入等量的蛋白样品进行SDS凝胶电泳,用PVDF膜转膜,5%脱脂奶粉室温封闭 2 h,分别加入相应一抗 anti-TGF-β1(1∶1 000),anti-Smad3(1∶1 000),4 ℃孵育过夜;TBST清洗 3次,加入相应二抗(1∶5 000)室温孵育1 h,ECL化学发光试剂盒显影。使用Amersham Imager 600采集图像,Image Lab V5.10软件分析,样品蛋白与β-actin灰度值比为样品待测蛋白相对表达量。
1.4.6 荧光定量PCR检测TGF-β1 mRNA和Smad3 mRNA表达情况 Trizol法提取肝组织中总RNA,测定RNA纯度和浓度。按照逆转录试剂盒说明逆转录cDNA,反应体系:纯水10 μL,1×Buffer缓冲液10 μL,dNTP Mix 1 mL,上游引物 50 pmol,下游引物 50 pmol(序列见表 1),25 mmol/L MgSO42 μL,AMV Reverse Transcriptase 1 μL,Tfl DNA Polymerase 1 μL。95℃ Tag酶活化2 min,95℃变性15 s,60 ℃退火,循环 40 次。2-△△Ct法计算 TGF-β1 mRNA和Smad3 mRNA的相对表达量。

表1 PCR引物序列Tab.1 PCR primer sequence
1.5 实验观察指标 (1)HE和天狼星红染色后,光镜下观察局部组织病理变化;(2)血清ALT、AST和TG水平;(3)肝脏指数;(4)Western blot检测局部组织中TGF-β1和Smad3 蛋白水平变化;(5)RT-PCR检测局部组织中TGF-β1mRNA和Smad3 mRNA表达水平。
1.6 统计学方法 用SPSS 24.0软件进行统计分析,所有数据均用()表示。空白对照组与模型对照组比较采用两独立样本t检验;采用levene法进行方差齐性检验,方差齐时,实验组、阳性对照组和模型组间比较采用单因素方差分析,若单因素方差分析有统计学意义,实验组和阳性对照组与模型对照组比较采用LSD法,组间两两比较采用SNK法(q检验)。方差不齐时,采用Welch法进行近似方差分析;P<0.05表示差异具有统计学意义。
2 结果
2.1 HE和天狼星红染色观察 HE染色可见,空白对照组肝细胞形状正常,静脉区可见少量炎性细胞。模型对照组肝组织正常结构破坏,肝细胞中存在大量炎性细胞浸润、出血和坏死,气泡样脂肪变性和排列紊乱的肝细胞;天狼星红染色可见静脉区较多的胶原沉积;阳性对照组和实验组可见明显减少的炎性细胞,少量出血和胶原沉积,肝细胞的排列明显改善(图1、2)。

图1 苏木精-伊红染色结果Fig.1 Hematoxylin&eosin staining results

图2 天狼星红染色结果Fig.2 Sirius red staining results
2.2 坎地沙坦酯对小鼠血清生化指标的影响ELISA检测结果表明,模型对照组小鼠血清ALT、AST和TG显著高于空白对照组、阳性对照组和实验组。统计分析表明,模型对照组血清ALT、AST和TG水平高于对照组,差异有统计学意义(P<0.01);阳性对照组和实验组血清ALT、AST和TG水平显著低于模型对照组,差异具有统计学意义(P<0.01);阳性对照组血清ALT、AST和TG水平与实验组差异无统计学意义(P>0.05,图3A、B)。
2.3 小鼠肝指数的变化 统计结果表明,模型对照组小鼠肝脏指数显著高于空白对照组,差异有统计学意义(P<0.01);阳性对照组和实验组肝脏指数显著低于模型对照组,差异有统计学意义(P<0.01);阳性对照组肝脏指数和实验组差异无统计学意义(P>0.05,图3C)。
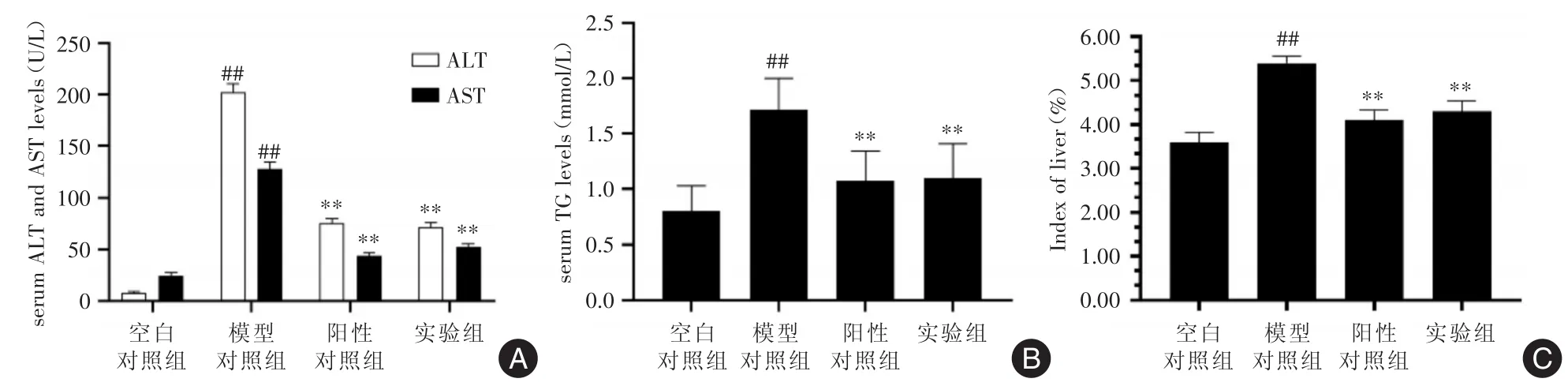
图3 坎地沙坦酯对小鼠血清ALT、AST和TG的影响和肝脏指数变化Fig.3 The effects of candesartan on serum ALT,AST and TG in mice and changes in liver index
2.4 肝组织中TGF-β1 mRNA和Smad3 mRNA水平的变化 RT-qPCR检测结果显示,模型对照组中TGF-β1 mRNA和Smad3 mRNA水平显著高于空白对照组,差异有统计学意义(P<0.01);阳性对照组中TGF-β1 mRNA和Smad3 mRNA水平明显低于模型对照组,差异有统计学意义(P<0.01);阳性对照组中TGF-β1 mRNA和Smad3 mRNA水平与实验组差异无统计学意义(P>0.05,图4 A、B)。
2.5 肝组织中TGF-β1和Smad3蛋白表达水平的变化 Western blot检测结果显示,模型对照组TGF-β1和Smad3蛋白表达水平显著高于空白对照组,差异有统计学(P< 0.01);阳性对照组TGF-β1和Smad3蛋白表达水平明显低于模型对照组,差异有统计学(P<0.05);阳性对照组 TGF-β1和Smad3蛋白表达水平与实验组差异无统计学意义(P> 0.05,图5A、B)。
3 讨论
ALD是一个极具挑战的全球性健康问题,常导致沉重的医疗负担,并对患者生命造成极大危害。ALF作为ALD病理进程的一个关键阶段,也是目前临床认为能够可逆转的关键阶段。因此,对ALF发病机制和潜在有效治疗药物的研究在本领域备受关注。最近,研究[12]表明,在慢性肝损伤中血管紧张素Ⅱ(angiotensinⅡ,ANGⅡ)产生过多从而刺激肝星状细胞活化有助于纤维化。此外,ANGⅡ阻断剂在丙肝患者中显示出抗纤维化的作用[13-15]。临床观察[7]表明,新型 ANGⅡ型受体阻断剂坎地沙坦对ALF有缓解作用,但这类药物缓解肝纤维化的具体作用机制尚无相关研究证实。本实验目的在于通过构建ALF小鼠模型,用坎地沙坦酯干预ALF小鼠,观察干预后小鼠肝组织病理变化特征、肝脏指数、血清相关生化指标及TGF-β1/Smads信号通路相关分子的变化,以探究坎地沙坦酯对ALF的可能作用机制,为其临床应用提供科学依据。
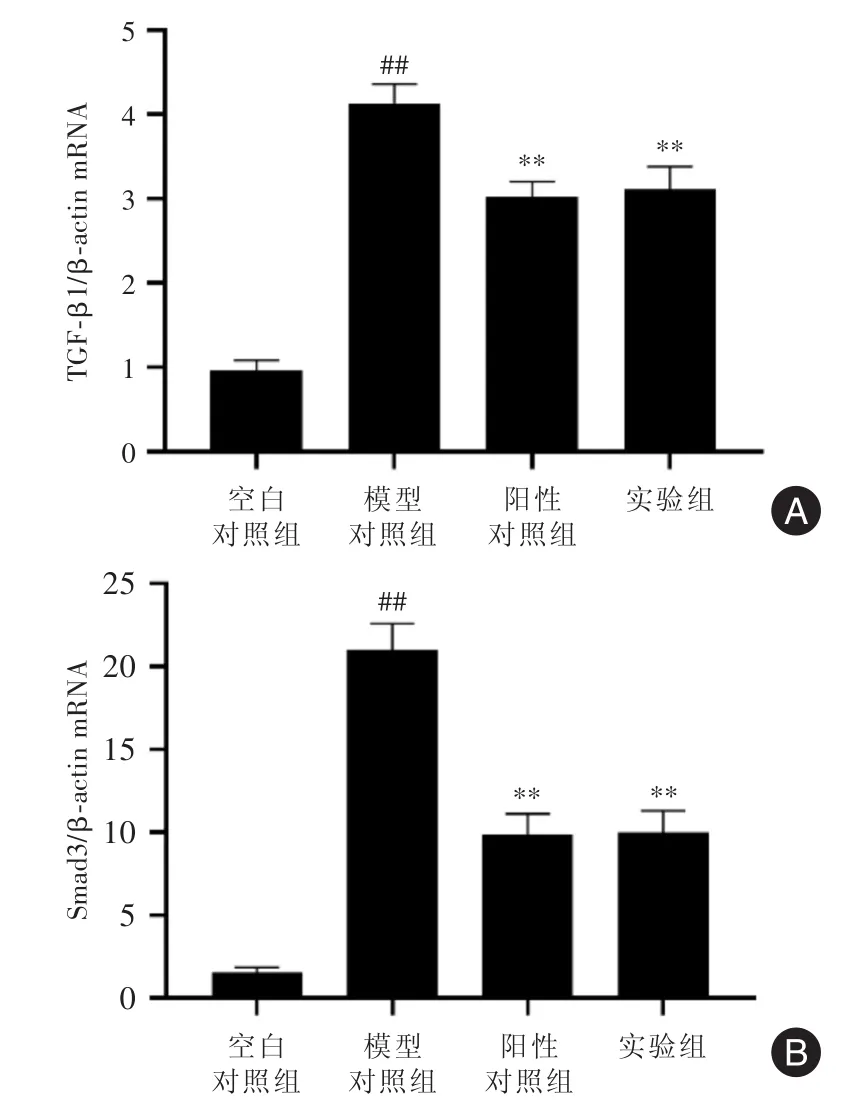
图4 肝组织中TGF-β1 mRNA和Smad3 mRNA水平的变化Fig.4 The changes of TGF-β1 mRNA and Smad3 mRNA levels in liver tissues

图5 肝组织中TGF-β1和Smad3蛋白表达水平的变化Fig.5 The changes of TGF-β1 and Smad3 protein expression levels in liver tissues
深入研究ALF的前提是构建理想的ALF动物模型,理想的病理模型应该与人类疾病有相似的病理生理学特征。自由觅食Lieber-Decarli酒精饮食模型已被广泛地用于ALF的动物模型构建[16],但单独使用酒精难以在实验条件下诱导动物肝纤维化[17]。因此,在本研究中,采用慢性酒精处理并伴随节点CCL4腹腔注射的“双击模型”[18]。实验结果表明,在实验中采用Lieber-Decarli酒精液体饮食联合在最后5周腹腔注射CLL4的方法,ALF模型成功构建。病理变化和人类ALF相似[19],包括脂肪变性、肝细胞损伤、细胞外周纤维化和胶原纤维的沉积。
TG主要在肝脏中合成、分泌和分解代谢,TG的积聚在慢性肝损伤中发挥重要作用[20-21]。因此,肝功能受损导致脂肪酸向肝脏转移,导致肝脏中TG含量增加[22]。结果表明,模型对照组TG水平高于空白对照组、阳性对照组和实验组,差异有统计学意义(P< 0.01)。TONG等[23]研究表明,酒精引起的肝脏脂肪变性包括细胞溶质脂滴内过多的脂肪积聚,主要是TG。这表明模型构建符合要求;实验组TG水平与阳性对照组差异无统计学意义(P>0.05),这表明坎地沙坦酯对酒精诱导的肝细胞损伤有保护作用。肝细胞膜结构和功能受损后,ALT和AST溢出,大量渗透到血液中,增加血清ALT和AST[24]。在一定程度上反映了肝细胞损伤的程度。因此,血清ALT和AST升高被认为是判断肝损伤严重程度的重要且敏感指标[25]。结果表明,模型对照组ALT和AST水平高于空白对照组、阳性对照组和实验组,差异具有统计学意义;实验组ALT和AST水平无明显差异。上述结果表明,坎地沙坦酯对酒精诱导的肝细胞损伤具有显著的保护作用。
TGF-β1是一种多功能细胞因子,在细胞生长分化、细胞外基质合成及损伤修复中发挥重要作用[26]。在哺乳动物体内,TGF-β分子主要含有TGF-β1、TGF-β2和 TGF-β3 3种分子亚型。其中TGF-β1是目前公认的最重要的促纤维化因子之一[27]。研究[28]证实,TGF-β1 参与所有肝纤维化病理过程的关键环节。实验结果表明,与空白对照组比较,模型对照组TGF-β1蛋白表达水平和TGF-β1 mRNA水平均显增高,差异具有统计学意义;此外,模型对照组TGF-β1蛋白表达水平和TGF-β1 mRNA水平显著高于阳性对照组和实验组,差异具有统计学意义;阳性对照组和实验组TGF-β1蛋白表达水平和TGF-β1 mRNA水平无明显差异。上述结果表明,坎地沙坦酯能够降低ALF小鼠模型肝脏中TGF-β1的表达,从而发挥抗肝纤维化作用。
Smad转录因子是TGF-β细胞因子家族的关键介质,Smad蛋白的可逆磷酸化在调节其功能过程中发挥关键作用[29]。参与TGF-β信号途径的受体激活型Smads(Smad2和Smad3)可直接丝氨酸化与TGF-β 结合的 TGF-β RI末端羟基集团[30],TGF-β RI介导的Smad3和Smad2的磷酸化诱导共有配体Smad4与它们结合,然后移位到细胞核内激活特定的基因转录而发挥调节作用[30]。结果表明,模型对照组Smad3蛋白表达水平和Smad3 mRNA水平显著高于空白对照组、阳性对照组和实验组,差异具有统计学意义;阳性对照组Smad3蛋白表达水平和Smad3 mRNA水平与实验组无明显差异。实验结果表明,坎地沙坦酯可以降低AFL小鼠肝组织Smad3的表达,从而改善肝纤维化。
综上所述,坎地沙坦酯能够改善ALF小鼠肝组织炎性浸润、出血、坏死和纤维化程度,降低ALF小鼠血清ALT、AST和TG水平,并降低TGF-β1和Smad3的表达。坎地沙坦酯改善ALF的作用机制可能与抑制TGF-β1/Smad3信号通路有关,明确坎地沙坦酯改善肝纤维化的具体机制需进一步研究。
