LncRNA FZD10-AS1通过调控miR-337-3p/GPD1分子轴抑制骨肉瘤细胞的增殖和迁移
2020-03-13李帅董震王晓晨丁涛
李帅 董震 王晓晨 丁涛
1青岛大学附属青岛妇女儿童医院儿童骨科(山东青岛266000);胜利油田中心医院2药学部,3脊柱外科(山东东营257000)
骨肉瘤是一种最常见的骨原发恶性肿瘤,好发于青年患者[1]。虽然骨肉瘤治疗已取得一定进展,但由于骨肉瘤恶性程度高且进展快,早期即易转移,复发率高,因此骨肉瘤患者的总体预后较差[2-3]。长链非编码RNA(long non-coding RNA,lncRNA)与细胞多种生命活动如分化、增殖、凋亡、衰老、迁移等行为密切相关[4]。越来越多研究[5-6]表明,lncRNA在多种类型的肿瘤中异常表达,通过多种分子机制参与肿瘤的进展和转移。近年来,lncRNA在骨肉瘤发生、发展中的作用逐渐引起关注[7]。FZD10-AS1是一种新发现的lncRNA,其在骨肉瘤中的表达情况及作用机制尚不清楚。本研究检测FZD10-AS1对骨肉瘤细胞增殖、迁移能力的影响,并研究骨肉瘤细胞中FZD10-AS1对下游靶基因表达的调控作用,为骨肉瘤的分子靶向治疗提供实验依据。
1 材料与方法
1.1 临床标本收集 收集青岛大学附属青岛妇女儿童医院儿童骨科2016年9月至2018年12月行骨肉瘤根治术切除47例骨肉瘤患者的癌组织及相应癌旁组织,术后立即于液氮中保存。男性和女性患者分别为28例和19例,平均(18.75±8.49)岁。所有患者术前未接受放疗、化疗、生物治疗等。所有组织均经病理切片证实。本研究经本院伦理委员会同意,患者均签署知情同意书。
1.2 细胞与主要试剂 正常成骨细胞hFOB1.19和骨肉瘤细胞MG-63、Saos2、143B、HOS 和U-2OS购自美国标准培养物保藏中心(American Type Culture Collection,ATCC)。qRT-PCR相关试剂盒购于日本TaKaRa公司。RPMI 1640培养基、DMEM/F12培养基、胎牛血清购自美国Amresco公司。CCK-8试剂盒购自美国Sigma公司。表达FZD10-AS1的质粒、阴性对照质粒和PCR引物(GAPDH、GPD1、FZD10-AS1、miR-337-3p、U6)购自上海吉玛生物制药有限公司。Lipofectamine 2000购自美国Invitrogen公司。一抗 GPD1、β-Tubulin、E-cadherin、ZEB-2、CDK7、Cyclin H及二抗均购自美国CST公司。
1.3 细胞培养及质粒转染 143B和HOS细胞培养于添加含10%胎牛血清、100 U/mL青霉素和100 mg/mL链霉素的RPMI 1640培养基中,Saos2、MG-63和U-2OS细胞培养于含10%胎牛血清、100 U/mL青霉素和100 mg/mL链霉素的DMEM/F12培养液中,于37℃、体积分数5%CO2孵箱中培养。hFOB1.19细胞培养在含10%胎牛血清、100 U/mL青霉素和100 mg/mL链霉素的DMEM/F12培养液中,于34°C、5%CO2孵箱中培养。转染前1 d将U-2OS细胞种于6孔板,使用表达FZD10-AS1的质粒或阴性对照质粒分别与Lipofectamine 2000脂质体混合转染U-2OS细胞,操作按照Lipofectamine 2000说明书进行,48 h后进行后续实验检测。
1.4 RNA提取和qRT-PCR 参照TRIzol试剂盒说明书提取骨肉瘤组织和细胞株中总RNA,逆转录后获得cDNA,参照qRT-PCR试剂盒说明书采用相对定量法对组织和细胞中FZD10-AS1、miR-337-3p和GPD1表达量进行检测,miR-337-3p采用U6作为内参,FZD10-AS1和GPD1采用GAPDH作为内参,qRT-PCR反应条件:95℃预变性10 min;95℃变性50 s,60℃退火25 s,72℃延伸15 s,设置40 次循环。采用 2-ΔΔCt方法计算 FZD10-AS1、miR-337-3p和GPD1 mRNA的表达量。FZD10-AS1上游引物为 5′-CAAGCCCTACAATTTTTACATCG-3′,下游 引 物 为 5′-CCTGCTTCACCTCCTTCTCATA-3′;GPD1上游引物为 5′-GCCATCTGAAGGCAAACGC-3′,下游引物为5′-GCCAATGGTTGTCTCACAGAAC-3′。U6上游引物为5′-CTCGCTTCGGCAGCACA-3′,下 游引物 为 5′-AACGCTTCACGAATTTGCGT-3′。GAPDH上游引物为5′-ACAACTTTGGTATCGTGGAAGG-3′,下游引物为 5′-GCCATCACGCCACAGTTTC-3′;miR-337-3p上游引物为 5′-GGGCTCCTATATGATGCCT-3′,下游引物为 5′-CAGTGCGTGTCGTGGAGT-3′。
1.5 CCK-8检测U-2OS细胞增殖能力 对照组和观察组处于对数生长期的U-2OS细胞接种于96孔板,每孔5×103个细胞,在37℃、5%CO2培养箱中连续培养5 d。在每天相同的时间点,每孔分别加入10 μL的CCK-8溶液,培养箱中培养4 h,酶标仪检测在450 nm波长下的每孔吸光度(OD)值,绘制U-2OS细胞生长曲线。实验重复3次。
1.6 细胞划痕实验检测U-2OS细胞迁移能力 对照组和观察组处于对数生长期的U-2OS细胞接种于6孔板,每孔3×105个细胞,培养至细胞汇合。采用无菌200 μL移液管尖端在每个孔底进行划痕。采用无菌PBS溶液洗涤3次,充分清除细胞碎片,加入不含血清的培养基培养。24 h后,拍摄记录每孔细胞的迁移状态,并计算迁移率。实验重复4次。
1.7 生物信息学预测FZD10-AS1的下游miRNA及基因 采用LncBase Predicted v.2软件预测FZD10-AS1可互补结合的miRNA,采用PITA和starBase V2.0软件预测miRNA的靶基因。
1.8 Western Blot实验检测GPD1蛋白的表达量采用RIPA裂解液提取各组细胞总蛋白,BCA试剂盒检测蛋白浓度,采用SDS-PAGE凝胶电泳分离蛋白,采用半干转移法将蛋白转至聚偏氟乙烯膜,5%脱脂奶粉室温封闭2 h,加入按一定比例稀释的一抗 GPD1(1∶1 000稀释)、β-Tubulin(1∶1 000稀释)、E-cadherin(1∶500 稀释)、ZEB-2(1∶500)、CDK7(1∶2 000)及Cyclin H(1∶2 000),4 ℃过夜孵育,TBST溶液清洗3次后,加入相应二抗在室温孵育2 h。TBST溶液清洗3次后,加入ECL化学发光液,迅速置于凝胶成像系统中采集图像并观察分析。
1.9 统计学方法 所有数据均使用SPSS 21.0软件分析,计量数据采用均数±标准差表示,组间比较采用t检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 FZD10-AS1在骨肉瘤组织和细胞株中表达下调 qRT-PCR检测结果显示,骨肉瘤组织FZD10-AS1表达量明显低于癌旁组织[(1.21±0.45)vs.(5.58± 0.88),P< 0.01,图1],FZD10-AS1在骨肉瘤细胞株中的表达量明显低于正常成骨细胞(P<0.01,图2),其中在U-2OS细胞中表达量最低。
2.2 转染FZD10-AS1质粒提高U-2OS细胞中FZD10-AS1表达的量 转染FZD10-AS1质粒后,观察组U-2OS细胞中FZD10-AS1表达的量明显高于对照组[(1.00 ± 0.04)vs.(10.55 ± 0.87),P< 0.01]。
2.3 过表达FZD10-AS1抑制U-2OS细胞的增殖能力 CCK-8法结果(图3)显示,在第3、4、5天,过表达FZD10-AS1的观察组U-2OS细胞D值明显低于对照组(P<0.05),表明过表达FZD10-AS1可抑制U-2OS细胞的增殖能力。

图1 FZD10-AS1在骨肉瘤组织和癌旁组织中的表达量Fig.1 Expression level of FZD10-AS1 in osteosarcoma and adjacent tissues

图2 FZD10-AS1在骨肉瘤细胞株和正常成骨细胞中的表达量Fig.2 Expression level of FZD10-AS1 in osteosarcoma cell lines and normal osteoblast cell

图3 过表达FZD10-AS1对U-2OS细胞增殖能力的影响Fig.3 Effect of overexpression FZD10-AS1 on the proliferation of U-2OS cells
2.4 过表达FZD10-AS1明显抑制U-2OS细胞的迁移能力 细胞划痕实验结果(图5)显示,观察组U-2OS细胞迁移率明显少于对照组[(24.52±3.96)%vs.(54.30± 6.06)%,P< 0.01],表明过表达FZD10-AS1可抑制U-2OS细胞的迁移能力。
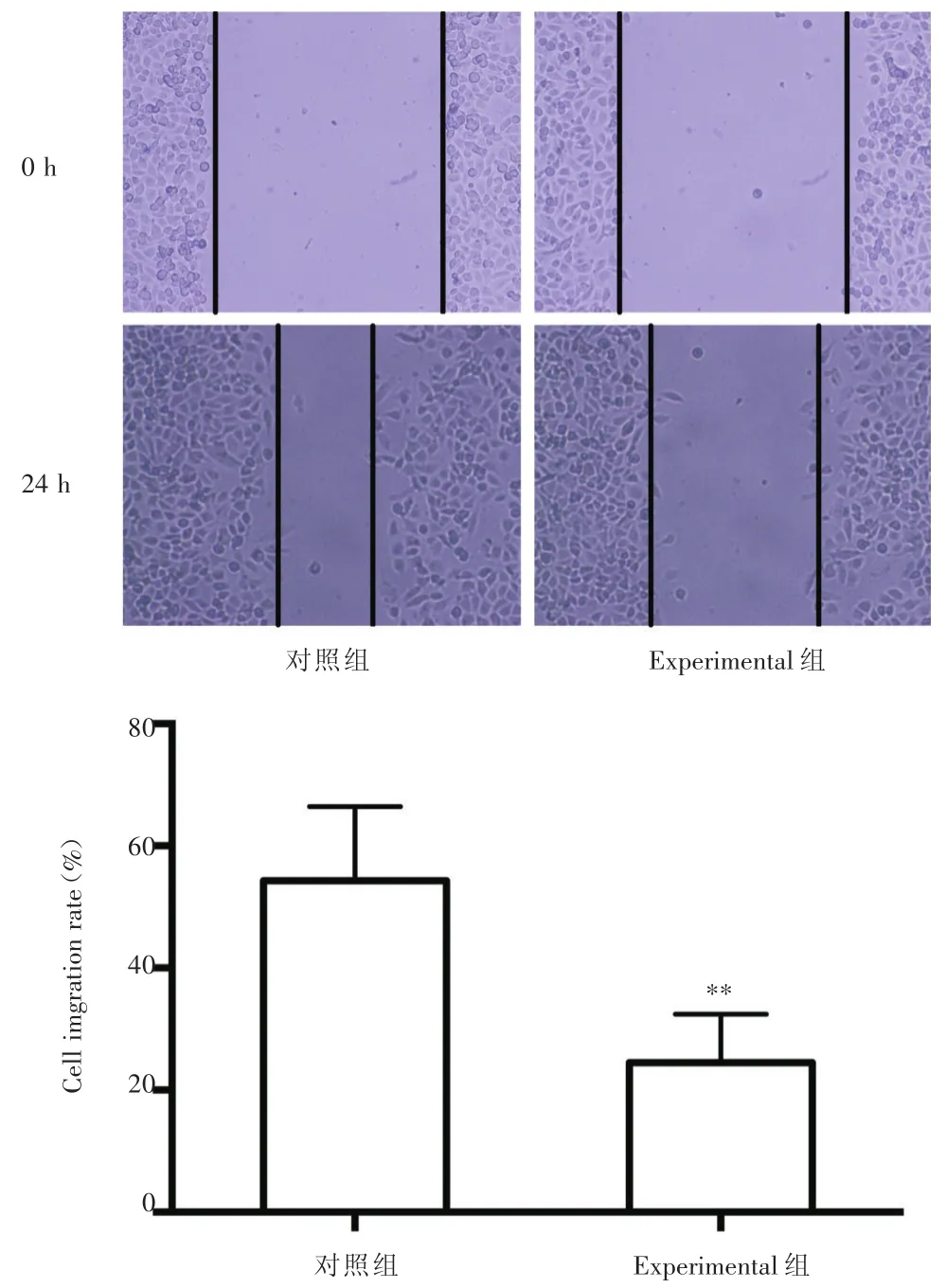
图4 过表达FZD10-AS1对U-2OS细胞迁移能力的影响Fig.4 Effect of overexpression FZD10-AS1 on the migration of U-2OS cells
2.5 生物信息学软件预测FZD10-AS1互补结合的下游miRNA及基因 采用LncBase Predicted v.2软件预测显示:FZD10-AS1可与miR-337-3p互补结合;PITA和starBase V2.0软件预测显示,miR-337-3p可与GPD1 mRNA互补结合。见图5。

图5 生物信息学软件预测FZD10-AS1互补结合情况Fig.5 Bioinformatics software predicts FZD10-AS1 complementarity
2.6 过表达FZD10-AS1降低或升高U-2OS细胞中miR-337-3p和GPD1 mRNA表达量 qRT-PCR检测结果显示,观察组U-2OS细胞中miR-337-3p mRNA表达量明显低于对照组[(1.02±0.11)vs.(0.22±0.06),P<0.01],GPD1 mRNA表达量明显高于对照组[(1.00 ± 0.13)vs.(5.90± 0.52),P< 0.01)],表明过表达FZD10-AS1可下调miR-337-3p mRNA的表达,进而促进GPD1 mRNA的表达。
2.7 过表达FZD10-AS1对GPD1蛋白表达的影响Western Blot检测结果(图6)显示,过表达FZD10-AS1后,GPD1蛋白表达量上调,上皮细胞表型E-cadherin表达升高,间质细胞表型ZEB-2表达降低,细胞周期调控蛋白CDK7、Cyclin H的表达降低。

图6 过表达FZD10-AS1对U-2OS细胞GPD1相关蛋白表达的影响Fig.6 Effect of high-expressed FZD10-AS1 on the expression of GPD1 protein and related proteins in U-2OS cells
3 讨论
可通过多种作用机制如染色质修饰、基因组印迹、转录水平、转录后水平调控基因的表达[8-10]。许多 lncRNA 如 EPIC1、LINC00152、XIST、FBXL19-AS1、MIAT、MIR100HG被发现在骨肉瘤组织中过表达或低表达,在骨肉瘤中发挥促癌作用或抑癌作用[11-17]。FZD10-AS1是一种新发现的lncRNA,本研究显示FZD10-AS1在骨肉瘤组织中的表达量较癌旁组织明显减少,在骨肉瘤中的表达量较正常成骨细胞明显较少,表明FZD10-AS1在骨肉瘤中低表达可能与骨肉瘤的发生有关。本研究通过上调骨肉瘤U-2OS细胞中FZD10-AS1的表达,FZD10-AS1可抑制骨肉瘤细胞的增殖和迁移能力。
LncRNA发挥作用的主要机制是lncRNA作为miRNA“海绵”,竞争性结合并抑制miRNA的活性,降低miRNA对下游基因mRNA的干扰作用,从而促进下游基因mRNA的翻译[18-19]。采用LncBase Predicted v.2软件预测显示,FZD10-AS1可与miR-337-3p互补结合;PITA和starBase V2.0软件预测显示,miR-337-3p可与甘油-3-磷酸脱氢酶1(Glycerol-3-Phosphate Dehydrogenase 1,GPD1)mRNA 互补结合。有研究表明,miR-337-3p在骨关节炎中具有促进细胞增殖和抑制细胞凋亡的作用[20]。miR-337-3p可能与细胞的增殖能力密切相关,可能具有促癌基因的作用。GPD1基因位于染色体12q13.12上,以往的研究认为GPD1蛋白是连接碳水化合物和脂质代谢的关键因素,其表达异常可引起三酰基甘油合成改变,在高三酰甘油血症、肝纤维化和脂肪性肝炎等疾病中发挥重要作用[21]。近年来,GPD1蛋白在肿瘤发生发展的研究成为热点。ZHOU等[22]报道,GPD1蛋白在乳腺癌组织和细胞株中呈低表达,GPD1蛋白的低表达与乳腺癌患者的不良预后明显相关,过表达GPD1可明显抑制乳腺癌细胞的增殖、迁移和侵袭能力。GPD1蛋白可发挥明显的抑癌基因作用。本研究发现,转染表达FZD10-AS1的质粒可明显下调骨肉瘤细胞中miR-337-3p的表达,而miR-337-3p的表达降低能明显促进GPD1基因的表达,表明FZD10-AS1可能通过“海绵作用”下调miR-337-3p,间接促进GPD1基因的表达的表达,从而抑制骨肉瘤的增殖和迁移。上皮间质转化过程是肿瘤细胞发生转移的关键机制,即细胞的上皮细胞表型经重新编程为间充质表型[10]。本研究发现,GPD1基因表达上调后,上皮细胞表型E-cadherin表达升高,间质细胞表型ZEB-2表达降低,表明U-2OS细胞的迁移能力降低;细胞周期调控蛋白CDK7、Cyclin H的表达降低,表明U-2OS细胞增殖能力降低。本研究的不足之处在于没有在体内验证FZD10-AS1对骨肉瘤增殖和迁移的影响,这是本研究下一步研究的重点。
综上,FZD10-AS1在骨肉瘤组织和骨肉瘤细胞株中表达降低。在U-2OS细胞中,过表达FZD10-AS1可通过降低miR-337-3p的表达间接促进GPD1基因的表达,抑制骨肉瘤U-2OS细胞的增殖和迁移能力,对FZD10-AS1的研究对发现骨肉瘤潜在治疗靶点可能具有重要临床意义。
