shRNA-SIVA1慢病毒载体的构建及其对胃癌细胞耐药性的影响
2020-03-13王晓通吴锟李雷麦威钟晓刚
王晓通 吴锟 李雷 麦威 钟晓刚
1广西壮族自治区人民医院胃肠外周血管外科(南宁530021),2广西壮族自治区民族医院胃肠肝胆外科(南宁 530001)
胃癌是我国最常见的消化道恶性肿瘤,其发病率和病死率在我国恶性肿瘤中分别居第二、三位[1]。化疗在中晚期胃癌和复发转移型胃癌的治疗中发挥重要的作用。然而有研究表明,增加化疗并不能延长胃癌患者的生存期[2]。其中一个重要的原因是肿瘤耐药性的产生。因此,寻找调节和对抗胃癌耐药性的方法、揭示胃癌耐药性的分子机制具有重要意义。
SIVA1基因作为促凋亡分子,能通过与CD27结合诱导T淋巴细胞凋亡[3]。研究表明SIVA1能够通过与多种受体结合,增加乳腺癌细胞和宫颈癌HeLa细胞对顺铂的敏感性,从而促进肿瘤细胞凋亡[4-5],但目前关于SIVA1在胃癌耐药中的作用尚未有报道。为了探讨SIVA1在胃癌耐药发生发展中的作用,本研究通过构建靶向人SIVA1基因的短发夹RNA(shRNA)重组慢病毒载体并转染胃癌耐药细胞株SGC-7901/DDP,探讨沉默SIVA1的表达对细胞耐药性以及细胞增殖的影响,并通过Western blot检测细胞Bcl-2、Bcl-xL的蛋白表达,探讨SIVA1影响胃癌耐药的可能机制,为后续实验研究奠定基础。
1 材料与方法
1.1 材料 人胃癌耐药细胞株SGC-7901/DDP由本实验室自行诱导构建并保存。目的质粒载体GV493、辅助载体 pHelper1.0、pHelper2.0、限制性内切酶(AgeI、EcoRI)购自上海吉凯基因科技有限公司。RNAi靶点设计、引物设计和合成、阳性克隆转化子测序、对GV493慢病毒载体的改造和病毒包装由上海吉凯基因科技有限公司完成。RPMI-1640培养基和胎牛血清购自Gibco公司;顺铂(DDP)购自山东齐鲁制药公司;逆转录试剂盒购于Thermo Fisher公司,qRT-PCR试剂盒SYBR Premix Ex Taq®Ⅱ购于Takara公司,PCR引物由Takara公司设计并合成;Western细胞裂解液、PMSF和BCA蛋白浓度测定试剂盒购于碧云天公司;TRIzol、PVDF膜购自Invitrogen公司;SIVA1、Bcl-2、Bcl-xL、GAPDH的兔抗人单克隆抗体购自CST公司;CCK-8购于日本同仁公司。
1.2 shRNA-SIVA1慢病毒表达载体的构建
1.2.1 shRNA-SIVA1质粒载体构建 从GenBank数据库查找SIVA1基因(NM_006427)序列,设计3条SIVA1靶点干扰序列并以通用阴性对照序列作为靶序列的阴性对照(negative control,NC)。相关序列见表1。
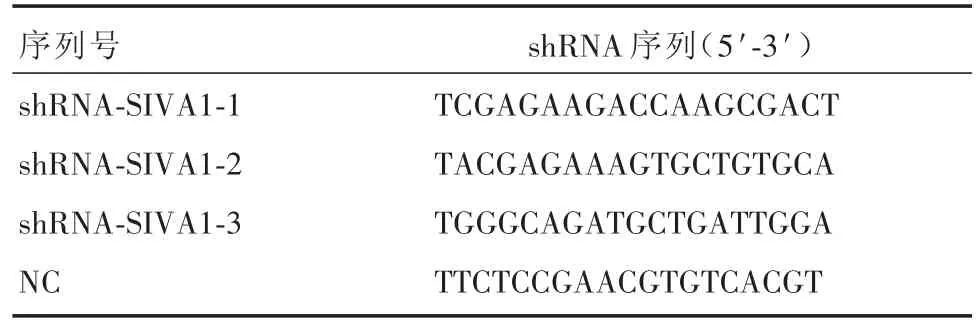
表1 靶向SIVA1基因的三条shRNA序列和阴性对照序列Tab.1 Three shRNA sequences and negative control sequences targeting siva1 gene
限制性内切酶AgeⅠ、EcoRI双酶切获得线性化的GV493载体,引物退火形成双链DNA,线性化的GV493载体与双链DNA连接并转化。
1.2.2 PCR鉴定阳性克隆转化子及测序鉴定 挑取单个菌落作为PCR扩增模板,设计引物序列如下:
F:5′-GGGTCAATATGTAATTTTCAGTG-3′,
R:5′-CCTTATAGTCCTTATCATCGTC-3′。
将阳性克隆转化子接种于含有相应抗生素的LB液体培养基中,37℃培养12~16 h后进行测序。
1.2.3 慢病毒的包装 将阳性克隆转接于含有相应抗生素的LB液体培养基中,37℃培养过夜后抽提质粒。293T细胞以5×106/15 mL的密度接种于10 cm培养皿,在37℃继续培养至细胞密度达70%~80%,将前述质粒载体shRNA-SIVA1和辅助载体pHelper1.0、pHelper2.0混匀并转染293T细胞,于37℃继续培养48 h。收集293T细胞上清液,于4℃、4 000 g离心10 min,0.45 μm滤器过滤上清液,以25 000 r/min,4℃超速离心2 h,弃上清,冰PBS重悬病毒沉淀,分装保存于-80℃冰箱。
1.2.4 慢病毒滴度测定 将病毒原液按10倍浓度梯度稀释并转染293T细胞3~4 d,荧光显微镜观察各孔GFP表达,计算病毒原液滴度:病毒滴度(TU/mL)=荧光细胞个数/病毒原液量。
1.3 RNA提取和实时荧光定量PCR(qRT-RCR)实验 将各组shRNA-SIVA1慢病毒载体及慢病毒阴性对照载体shRNA-NC分别转染胃癌细胞SGC-7901/DDP,72 h后收集各组细胞,采用TRIzol法提取细胞总RNA并逆转录为cDNA,加入PCR引物并置于ABI 7500 PCR仪进行扩增反应,以GAPDH为内参。PCR的引物设计如下:
SIVA1 Forward:5′-TGTACCCTGTGTGGCCTCGT-3′,Reverse:5′-AGCCAGCCTCAGGTCTCGAA-3′;GAPDH Forward:5′-CAAATTCCATGGCACCGTCA-3′,Reverse:5′-GACTCCACGACGTACTCAGC-3′。反应条件为:95℃预变性2 min,1个循环;95℃变性30 s,58℃复性30 s,72℃延伸30 s,40个循环,72 ℃延伸 10 min。采用 2-ΔΔCt法计算 SIVA1的相对表达量。
1.4 Western blot实验 根据qRT-PCR结果,选择干扰效率最佳的shRNA-SIVA1序列进行Western blot实验。收集转染后各组细胞,Western及IP裂解液提取细胞总蛋白并采用BCA法测定蛋白浓度,取20 μg总蛋白进行10%SDS-PAGE电泳并转移至PVDF膜,5%脱脂牛奶室温封闭2 h,分别用SIVA1(1∶500)、Bcl-2(1∶500)、Bcl-xL(1∶500)和GAPDH抗体(1∶2 000)于4℃摇床孵育过夜,带荧光标记的羊抗兔第二抗体(1∶5 000)室温避光孵育2 h,TBST洗膜3次,应用Odyssey 3.0仪器扫描显影并分析蛋白条带,以目的蛋白条带与GAPDH条带积分光密度比值表示目的蛋白的相对表达水平。
1.5 细胞对DDP的药物敏感实验 为探索沉默SIVA1后对胃癌细胞耐药性的影响,采用CCK-8法检测转染慢病毒载体后的细胞对DDP敏感性的变化。取各组细胞以5×103/孔铺入96孔板,每组5个重复,37℃培养24 h,根据预实验结果,设置6个DDP浓度梯度(0.5、1、5、10、20、50 μg/mL)并加入相应各孔。继续培养48 h,每孔加入10 μL CCK-8,37℃孵育2 h后,酶标仪检测各孔在450 nm波长处的吸光值。各组的吸光值为A处理,未经药物处理的吸光值为A对照,只含完全培养液的吸光值为A空白,计算各药物浓度下的细胞存活率:(A处理-A空白)/(A对照-A空白)×100%。应用Nosa软件计算DDP对各组细胞的半数抑制浓度(IC50)。
1.6 细胞增殖实验 采用CCK-8法检测沉默SIVA1后对胃癌细胞增殖的影响。取各组细胞以5× 103/孔铺入96孔板,分别于各时间点(0、24、48、72、96 h)每孔加入10 μL CCK-8试剂,37 ℃孵育2 h后,酶标仪检测并记录各孔在450 nm波长处吸光值,绘制各组细胞的增殖曲线。
1.7 统计学方法 应用GraphPad Prism V 7.0软件进行统计学分析并绘制柱状图和折线图。计量资料以均数±标准差表示,多组间均数比较采用单因素方差分析(one way-ANOVA),以P<0.05表示差异具有统计学意义。
2 结果
2.1 shRNA-SIVA1重组质粒的测序鉴定 将构建成功的表达载体的阳性克隆进行DNA测序,结果如图1所示,与设计的shRNA寡核苷酸序列相符,提示SIVA1 shRNA寡核苷酸链序列正确插入GV493质粒载体。

图1 shRNA-SIVA1重组质粒的测序结果Fig.1 Sequencing results of shRNA-SIVA1 recombinant plasmid
2.2 重组慢病毒载体包装和滴度测定 将shRNASIVA1重组载体与辅助载体共同转染293T细胞并从细胞上清液收获慢病毒载体。采用梯度稀释法测得各组shRNA-SIVA1的病毒原液滴度均为2×109TU/mL,符合后续实验要求。
2.3 慢病毒载体对胃癌SGC-7901/DDP细胞的转染效果 将慢病毒载体转染胃癌SGC-7901/DDP细胞(MOI=20)并观察细胞GFP表达情况,结果如图2所示,各组shRNA-SIVA1慢病毒载体对SGC-7901/DDP细胞均有良好的转染效果。
2.4 转染shRNA-SIVA1对SIVA1 mRNA表达的影响 qRT-PCR实验结果如图3所示,与Control组和 shRNA-NC 组相比,shRNA-SIVA1-1、2、3组的SIVA1 mRNA表达均有不同程度降低(P<0.05),各实验组的SIVA1 mRNA相对表达量分别为(0.27± 0.04)、(0.57 ± 0.09)和(0.61 ± 0.06),以 shRNASIVA1-1的抑制效果最显著。
2.4 转染shRNA-SIVA1对SIVA1蛋白表达的影响 Western blot实验结果显示,与Control组和shRNA-NC组相比,转染shRNA-SIVA1的SIVA1蛋白表达(0.44±0.04)显著降低(图4,P<0.005),这一结果与qRT-PCR结果一致。
2.5 沉默SIVA1能降低细胞对DDP的敏感性CCK-8药物敏感实验结果显示,与Control组细胞[IC50=(13.80± 0.62)μg/mL]和shRNA-NC[IC50=(14.27±0.93)μg/mL]相比,shRNA-SIVA1能显著降低细胞对DDP的敏感性[IC50=(20.97±0.91)μg/mL](P<0.005,图5)。

图2 慢病毒载体对SGC-7901/DDP细胞的转染效果Fig.2 The transfection effects of lentivirus vector on SGC-7901/DDP cells

图3 shRNA-SIVA1对SGC-7901/DDP细胞SIVA1 mRNA表达的影响Fig.3 Effects of shRNA-SIVA1 on the expression of SIVA1 in SGC-7901/DDP cells
2.6 沉默SIVA1能提升细胞增殖活性 CCK-8增殖实验结果显示,与Control组和shRNA-NC组相比,shRNA-SIVA1细胞在接种2 d后增殖活性显著提升(P<0.05,图6)。
2.7 沉默SIVA1能促进Bcl-2和Bcl-xL的表达Western blot实验结果如图7所示,与Control组和shRNA-NC组相比,SIVA1沉默后Bcl-2(0.83± 0.03)和Bcl-xL的蛋白表达(0.61±0.06)显著提高(P<0.005)。
3 讨论
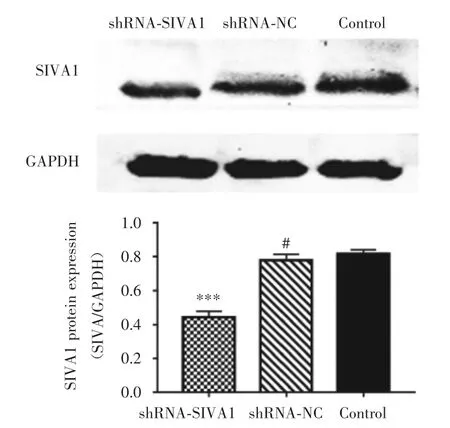
图4 shRNA-SIVA1对SGC-7901/DDP细胞SIVA1蛋白表达的影响Fig.4 Effects of shRNA-SIVA1 on the expression of SIVA1 protein in SGC-7901/DDP cells

图5 沉默SIVA1对SGC-7901/DDP细胞IC50的影响Fig.5 Effects of SIVA1 interfering on IC50of SGC-7901/DDP cells to DDP

图6 沉默SIVA1对SGC-7901/DDP细胞增殖的影响Fig.6 Effects of SIVA1interfering on the proliferation of SGC-7901/DDP cells
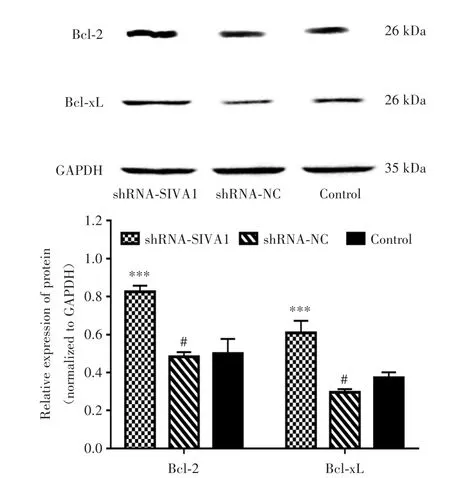
图7 shRNA-SIVA1对SGC-7901/DDP细胞Bcl-2和Bcl-xL蛋白表达的影响Fig.7 Effects of shRNA-SIVA1 on the protein expression of Bcl-2和Bcl-xL in SGC-7901/DDP cells
随着对肿瘤耐药现象的深入研究,目前已认识到肿瘤耐药的发生主要涉及药物外排增加、对药物解毒作用的增强、DNA损伤修复增强、促进凋亡抵抗以及促进生存的增加等机制[6]。而化疗药物杀伤肿瘤的一个重要作用方式即是通过损伤细胞DNA进而诱导细胞凋亡增多。凋亡信号通路受损或功能异常则可导致肿瘤细胞对化疗药物产生耐药性。大量研究表明,p53、Akt和NF-κB等凋亡相关分子和信号通路均参与了胃癌耐药的发生发展过程[7-8]。因此,对凋亡相关分子进行深入研究能更好地理解胃癌耐药的产生机制。
研究发现,SIVA1作为凋亡影响因子参与了p53引起的细胞凋亡[9],此外,SIVA1还可通过抑制NF-κB的活性并诱导细胞发生凋亡[10]。然而随着对SIVA1基因研究的深入,学者们发现SIVA1在不同类型肿瘤细胞中对凋亡的影响却不尽相同。RAY等[11]发现,在p53缺失的结直肠癌细胞中,低表达的SIVA1是DDP发挥诱导细胞凋亡作用的主要障碍之一。在卵巢癌中,SIVA1可抑制细胞增殖,促进细胞凋亡,并促使Stathmin蛋白发生磷酸化进而抑制细胞的侵袭转移能力[12]。LI等[13]在乳腺癌的研究中也发现,SIVA1可以通过直接或间接作用的方式抑制Stathmin蛋白的微管解聚活性,促进微管的生成和稳定,阻止细胞迁移以及上皮-间质转化的发生,此外在小鼠动物模型中,干扰SIVA1的表达可以促进肿瘤转移。以上研究结果提示SIVA1可通过影响细胞凋亡并发挥抑癌基因的作用。然而在KRASG12D来源的非小细胞肺癌中,SIVA1表达升高并通过调节肿瘤代谢和自噬促进肿瘤的发生发展[14]。在骨肉瘤中,SIVA1可影响p53稳定性并促进P53降解,从而抑制P53介导的凋亡,敲减SIVA1能抑制骨肉瘤细胞的恶性生物学行为[15]。综上所述,SIVA1参与肿瘤细胞的凋亡过程并扮演重要的角色,但其发挥的具体功能可能依赖于不同的肿瘤类型。
慢病毒载体是在人类免疫缺陷型病毒的基础上改造而成,相比于传统的脂质体法转染,慢病毒载体对动物和人的原代细胞或细胞系具有更好的转染性,具有转染效率高、安全性高等优点,能持续、稳定表达基因,现已作为转移目的基因的理想载体被广泛应用[16]。本研究为了明确SIVA1在胃癌耐药中所发挥的功能,首先构建靶向SIVA1基因的慢病毒载体并将其转染至胃癌耐药细胞系中。结果显示,本研究所构建的慢病毒载体对胃癌耐药细胞具有良好的感染性,且能有效抑制细胞中SIVA1基因mRNA和蛋白表达水平,可用于后续的实验研究。
在随后的细胞功能实验中,笔者发现抑制胃癌耐药细胞的SIVA1表达后,不仅降低了细胞对DDP的敏感性,并且促进了细胞的增殖,提示SIVA1在胃癌耐药细胞中可能发挥促凋亡作用进而扮演抑癌基因的角色。
Bcl-2/Bcl-xL作为Bcl-2蛋白家族中的成员,在肿瘤的发生发展过程中发挥重要作用,其作用方式是通过线粒体途径调控细胞凋亡[17],从而影响肿瘤细胞的存活。研究表明,雷公藤甲素可通过下调Bcl-2的表达进而抑制乳腺癌细胞增殖并诱导凋亡[18]。此外,沉默Bcl-2表达后,成骨肉瘤MG-63细胞凋亡显著增多,细胞存活减少[19]。上述结果提示,Bcl-2能发挥抑制细胞凋亡、促进细胞存活的作用。
为了进一步探究SIVA1在胃癌耐药细胞中的作用机制,笔者采用Western blot检测了细胞Bcl-2和Bcl-xL的表达,结果显示,沉默SIVA1后可引起凋亡抑制因子Bcl-2和Bcl-xL的表达升高。这一结果与CHU等[20]的研究结论相一致。提示SIVA1基因可能通过Bcl-2和Bcl-xL参与了细胞凋亡,进而影响胃癌细胞药物敏感性和增殖活性。
综上所述,本研究成功构建了靶向干扰SIVA1的慢病毒载体,初步探讨了SIVA1在胃癌耐药细胞中的生物学功能及其可能的机制,为进一步研究SIVA1对胃癌耐药的影响奠定了实验基础。然而,本研究仍存在一些不足,仅在SGC-7901/DDP一株细胞上进行体外实验,SIVA1在其他胃癌耐药细胞上是否也具有相同的效应,以及如上述文献所提示的p53、NF-κB分子,是否也参与了SIVA1对胃癌耐药性的调控,这些问题仍需进一步证实,也是我们下一步的研究思路。
