含血小板反应蛋白18型基序的解聚素样金属蛋白酶在肝细胞癌中的表达及其生物学功能
2020-03-13姜业臻陈双江
姜业臻, 陈双江
(1.陕西省西安市北环医院 外一科, 陕西 西安, 710032;2.陕西省安康市人民医院 普通外科, 陕西 安康, 725000;3.西安交通大学第一附属医院 肝胆外科, 陕西 西安, 710061)
肝细胞癌(HCC)是最常见的肝脏原发性恶性肿瘤[1], 具有恶性程度高、进展速度快等特点,目前治疗效果欠佳[2]。含血小板反应蛋白的解聚素样金属蛋白酶(ADAMTS)是一类具有锌离子依赖性的分泌型基质金属蛋白酶[3], 研究[4-5]发现ADAMTS18在食管癌、骨肉瘤中具有潜在的抑癌作用。本研究采用临床数据分析及体外细胞学实验等方法,探讨ADAMTS18在HCC中的临床价值及其对HCC细胞迁移和侵袭能力的影响,现报告如下。
1 材料与方法
1.1 材料
收集2015年1月—2016年1月西安交通大学第一附属医院肝胆外科行手术切除的HCC组织及对应癌旁组织标本50例,包括男35例,女15例,年龄55~72岁,中位年龄为58岁。兔抗人SP免疫组化试剂盒购自北京中杉金桥生物科技有限公司。LO2、Hep3B、SMMC-7721、MHCC97-H及Huh-7细胞均由肝胆外科实验室保存。ADAMTS18一抗(ab135728)购自美国Abcam公司;AKT一抗(#4685)、磷酸化AKT一抗(p-AKT, #13038)、 E-cadherin一抗(#14472)及GAPDH一抗(#5174)均购自美国CST公司。RNA提取试剂Trizol(#15596026)、转染试剂LipofectamineTM3000(#L3000015)及RT-PCR试剂盒(#10928042)均购自美国Invitrogen公司。SYBR Green实时荧光定量PCR试剂盒(#1725120)购自美国BIO-RAD公司。Transwell小室(#3458)购自美国CORNING公司。人工基质胶(#354230)购自美国B&D公司。ADAMTS18引物(上游5′-ACCTTGACCAGAACACCATCGAG-3′; 下游5′-CAGGGTCCAGGTCAGGTGTGTA-3′), GAPDH引物(上游5′-CCAGGGCTGCTTTTAACTCT-3′; 下游5′-GGACTCCACGACGTACTCA-3′)由上海生工生物工程公司合成。ADAMTS18过表达质粒及阴性对照质粒购自广州复能基因有限公司。
1.2 方法
1.2.1 免疫组化检测组织中ADAMTS18表达: 福尔马林固定、石蜡包埋的组织切片常规脱蜡、水化及微波抗原修复,分别用3%过氧化氢及10%山羊血清封闭切片。用PBS溶液按1∶100比例配制ADAMTS18一抗工作液,覆盖组织切片, 4 ℃摇晃、孵育过夜。PBS溶液洗净未结合一抗后,使用辣根过氧化物酶标记的山羊抗兔二抗结合相应一抗, DAB法显示阳性蛋白。计算切片染色得分[6]: 无阳性染色细胞为0分, <25%为1分, 25%~<50%为2分, 50%~<75%为3分, ≥75%为4分。
1.2.2 逆转录实时荧光定量PCR(qRT-PCR)检测ADAMTS18表达: 使用Trizol试剂按操作指南提取LO2、Hep3B、SMMC-7721、MHCC97-H及Huh-7细胞总RNA。定量后,每种细胞取等量RNA配制20 μL的逆转录反应体系合成cDNA。cDNA稀释10倍后,取5 μL配制实时荧光定量PCR体系,按以下条件进行PCR反应: 95 ℃预变性30 s, 1循环; 95 ℃变性5 s, 60 ℃退火延伸30 s, 40循环。以GAPDH作为内参,采用2-△△Ct法计算ADAMTS18 mRNA的相对表达量。
1.2.3 质粒瞬时转染: Huh-7细胞过夜培养达50%~70%密度后接种于6孔板中。ADAMTS18质粒转染分组: 阴性对照组(Vec-ctrl)每孔加入4 μg的阴性对照质粒及10 μL转染试剂, ADAMTS18组(Vec-ADAMTS18)每孔加入4 μg的ADAMTS18质粒及10 μL转染试剂; 以无血清DMEM培养基调整终体积为2 mL/孔。转染48 h后进行下一步试验。
1.2.4 Transwell小室模型检测Huh-7细胞迁移和侵袭: 取转染48 h后的Huh-7细胞,用无血清DMEM培养基重悬,以2×105/mL的密度每孔加入100 μL的细胞悬液。24孔细胞培养板内每孔加入750 μL含10%胎牛血清的DMEM培养基。将小室放于24孔板中继续培养24 h用于检测细胞迁移能力。用无血清DMEM培养基按1∶8比例稀释50 mg/L的基质胶100 μL/孔覆盖Transwell小室上室面,于37 ℃细胞培养箱内风干1 h制成侵袭小室模型,重复上述细胞种植操作,建立细胞侵袭检测模型。培养完成后, PBS清洗小室、4%多聚甲醛固定,并用0.1%的结晶紫染色10 min。擦除上室面未成功穿过小室膜的细胞,显微镜下观察并计数下室面细胞数目。
1.2.5 蛋白免疫印迹: 提取转染48 h后的Huh-7细胞总蛋白并调齐所有样品的蛋白浓度。采用垂直电泳法,利用4%~10% SDS-PAGE凝胶按分子量大小分离总蛋白。采用湿转法,按100V转印2 h的条件将分离后的蛋白转移至NC膜上, 5% BSA室温封闭NC膜1 h。裁取目的蛋白所在的位置条带,按1∶1 000比例配制ADAMTS18、蛋白激酶B(AKT)、AKT磷酸化(p-AKT)、E-cadherin及GAPDH一抗, 4 ℃孵育过夜。PBS洗去未结合一抗后采用1∶5 000稀释的HRP标记山羊抗兔(鼠)二抗室温孵育NC膜1 h。于暗室内,ECL法曝光目的蛋白,计算蛋白相对表达量。
1.3 统计学分析
采用SPSS 22.0统计软件进行分析,非连续性统计结果采用Pearson卡方检验,连续性统计结果以均数±标准差表示,两组间比较采用配对或两独立样本student-t检验。P<0.05表示差异有统计学意义。
2 结 果
2.1 ADAMTS18在HCC组织中表达及临床意义
ADAMTS18亚细胞表达定位主要在细胞质当中。对HCC及癌旁组织的ADAMTS18表达进行分析发现, HCC组织中的ADAMTS18的平均表达水平为(1.96±0.58), 对应癌旁组织为(3.61±0.39), 差异有统计学意义(t=6.876,P=0.003)。以HCC组织中ADAMTS18平均表达值为截断点,将50例HCC患者分为ADAMTS18高表达组(n=32)与ADAMTS18低表达组(n=18)。分析2组临床资料发现, ADAMTS18低表达与HCC血管侵犯(P=0.018)及TNM分期(P=0.038)密切相关。见表1。
2.2 ADAMTS18在HCC细胞中的表达
与正常肝细胞LO2中ADAMTS18 mRNA的表达水平相比, 4种HCC细胞中ADAMTS18 mRNA的表达水平均显著降低(P<0.05)。见图1、2。通过瞬时转染技术,作者在内源性ADAMTS18表达量最低的Huh-7细胞中转入ADAMTS18过表达质粒。蛋白免疫印迹检测结果证实,转染vec-ctrl质粒组Huh-7细胞内ADAMTS18表达水平为(0.21±0.11), 转染vec-ADAMTS18质粒组为(0.86±0.24), 差异有统计学意义(t=4.551,P=0.013)。
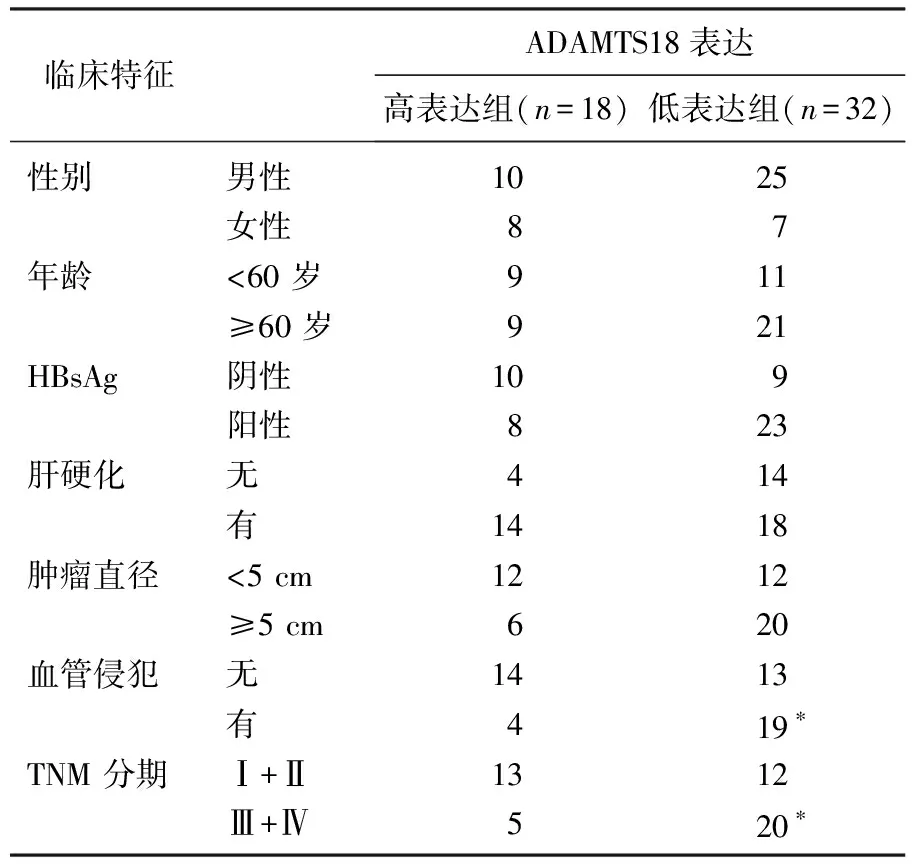
表1 ADAMTS18异常表达在HCC中的临床意义
HBsAg: 乙肝表面抗原。与高表达组比较, *P<0.05。
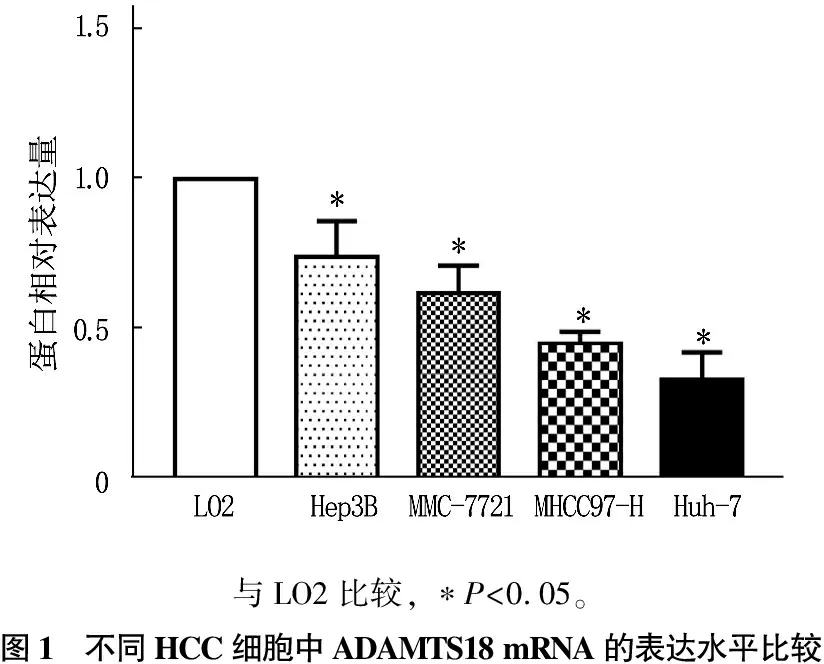
与LO2比较, ∗P<0.05。图1 不同HCC细胞中ADAMTS18 mRNA的表达水平比较
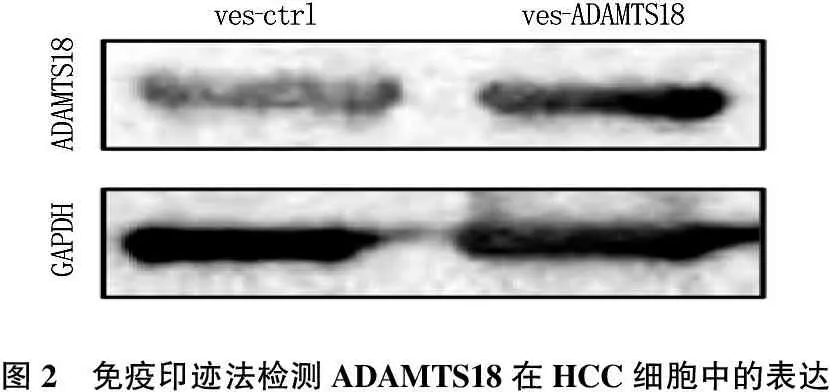
图2 免疫印迹法检测ADAMTS18在HCC细胞中的表达
2.3 过表达ADAMTS18抑制Huh-7细胞迁移及侵袭
转染vec-ctrl质粒组细胞迁移数量为(48.29±6.48)个,而转染vec-ADAMTS18质粒组细胞迁移数量为(27.45±8.02)个,差异有统计学意义(t=2.536,P=0.038)。转染Vec-ctrl质粒组细胞侵袭数量为(32.15±4.95)个,而转染vec-ADAMTS18质粒组细胞侵袭数量为(13.86±6.03)个,差异有统计学意义(t=2.684,P=0.027)。过表达ADAMTS18抑制了Huh-7细胞的迁移和侵袭。
2.4 过表达ADAMTS18抑制AKT的磷酸化并促进E-cadherin表达
AKT的活化状态是影响HCC细胞迁移侵袭的重要分子机制之一。本研究显示,转染vec-ADAMTS18质粒组细胞内AKT的磷酸化水平为(0.12±0.05), 低于转染vec-ctrl质粒组细胞(0.31±0.08), 差异有统计学意义(t=2.416,P=0.047)。2组细胞AKT的总表达量无显著差异(P>0.05)。同时,过表达ADAMTS18的Huh-7细胞内上皮标志物E-cadherin的表达水平为(0.33±0.06), 而vec-ctrl组细胞为(0.10±0.03), 差异有统计学意义(t=2.581,P=0.032)。见图3、4。
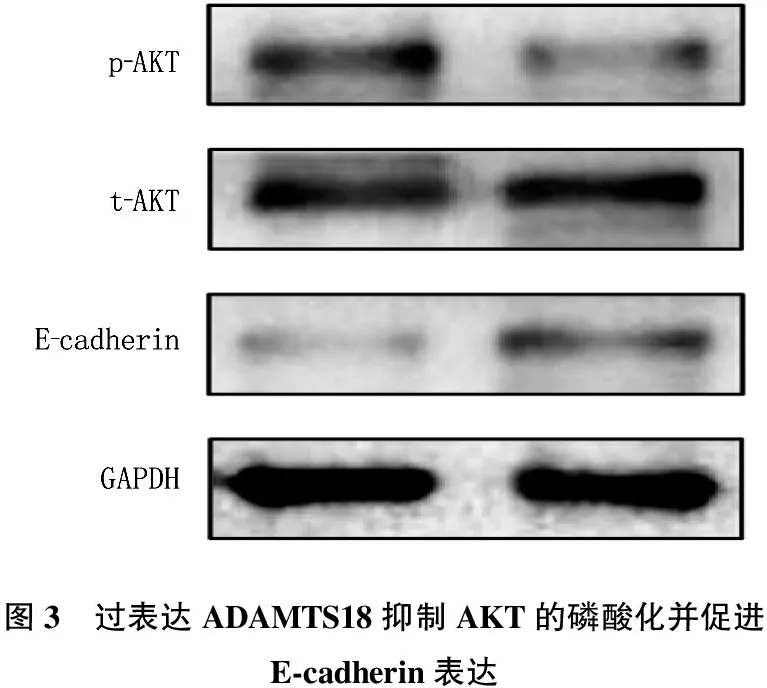
图3 过表达ADAMTS18抑制AKT的磷酸化并促进E-cadherin表达
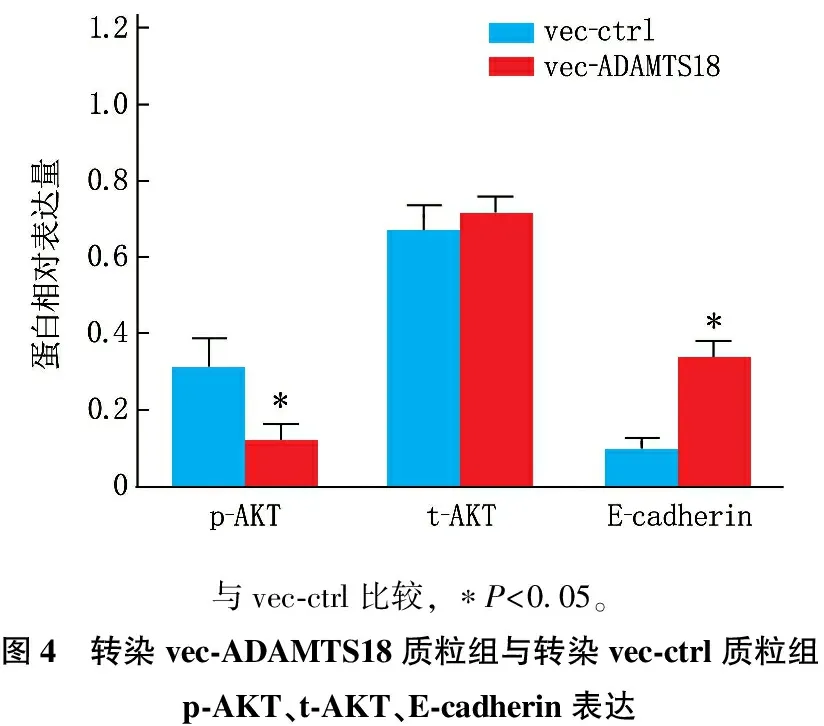
与vec-ctrl比较, ∗P<0.05。图4 转染vec-ADAMTS18质粒组与转染vec-ctrl质粒组p-AKT、t-AKT、E-cadherin表达
3 讨 论
发育生物学研究[7]证实, ADAMTS18在骨骼、视觉系统及中枢神经系统等正常组织发育过程中具有重要作用,其基因的突变、异常甲基化修饰及表达缺失均会导致畸形及先天性疾病的发生。本研究通过50例HCC及其对应癌旁组织样本的检测结果证实, ADAMTS18在HCC组织中的表达水平显著下调, ADAMTS18低表达与肿瘤存在血管侵犯和较晚的TNM分期密切相关。最新研究[8]也显示, ADAMTS18低表达的宫颈癌患者临床分期更晚、淋巴结转移率更高、5年生存率更低,在胃癌[9]和结肠癌[10]中也有相似的研究结果。这提示ADAMTS18低表达是存在于多种人类恶性肿瘤中的高频率分子事件, ADAMTS18可能是一种有潜在临床价值的肿瘤标志物。
临床分析结果表明, ADAMTS18可能与肿瘤转移特征关系密切,在本研究的体外细胞学实验部分,作者通过Transwell小室模型证实过表达ADAMTS18可以显著抑制HCC细胞在体外的迁移和侵袭能力。研究[11]还显示, ADAMTS18在动物体内还具有抑制肺转移癌形成的能力。AKT信号通路的异常活化是HCC细胞获得侵袭、转移能力的重要分子机制之一[12], 磷酸化激活的AKT能通过NF-KB、SNAIL及HIF-1等多种途径[13-15]下调上皮细胞标志物E-cadherin的表达,诱导肿瘤细胞发生上皮间质化转变(EMT)而导致肿瘤转移。本研究发现,过表达ADAMTS18能够削弱AKT的磷酸化,同时提高Huh-7细胞中上皮标志物E-cadherin的表达水平,这提示ADAMTS18的抗HCC迁移侵袭功能与AKT通路和EMT现象有关。
综上所述, ADAMTS18表达下调与HCC恶性临床特征密切相关,其作为一种抑癌基因,在抗HCC细胞迁移侵袭的过程中发挥重要作用。
