利用间歇浸没式植物生物反应器培养金钗石斛种苗
2020-03-13张杰胡燕花张本厚陈集双
张杰, 胡燕花, 张本厚*, 陈集双
(1.杭州职业技术学院, 杭州 310018; 2.南京工业大学大丰海洋产业研究院, 江苏 盐城 224145;3.南京工业大学生物与制药工程学院, 南京 211800)
金钗石斛(DendrobiumnobideLindl.)为兰科石斛属植物,是珍稀濒危的名贵中药材[1],被列为“九大仙草”之一。金钗石斛以茎入药,其主要化学成分有生物碱、多糖、倍半萜类、菲类、联苄类等[2],具有抗肿瘤、抗老年痴呆等活性[3]。金钗石斛除药用价值外,其花型独特、色彩艳丽,因此还极具观赏价值。然而,由于金钗石斛的种子细小、无胚乳,在自然条件下繁殖能力极低,再加上自然生长缓慢、长期过度采掘,导致野生资源日趋枯竭[4],目前已被列为国家珍稀濒危二级保护植物,亟需开展资源保护和育种开发研究。
应用植物组培快繁方法能够有效解决金钗石斛种苗短缺的问题[5],目前有关金钗石斛的快速繁殖技术已多有报道[6-7]。金钗石斛组织培养多采用固体培养,此方式是一个劳动密集型技术,人工成本占到生产总成本的60%以上,人工的大量投入又增加污染,进一步增加了生产成本[8];另外由于培养过程是在一个相对密闭的空间,无法有效地进行气体交换,组培苗的生长受到影响,培养周期延长,种苗质量不高,移栽成活率降低[9]。
间歇浸没式培养系统是近年来发展起来的一种植物组织培养系统,结合了固体培养最大气体转换和液体培养营养物质充分吸收利用的优点[10],具有培养周期短、增殖率高、自动化程度高、培养通量大等特点[11-12]。本文以贵州赤水金钗石斛为试验材料,对金钗石斛组培苗进行间歇浸没式培养研究,以期建立一种新的金钗石斛种苗生产模式。
1 材料与方法
1.1 试验材料
实验材料为金钗石斛原球茎,取自贵州赤水地区人工种植的果荚,经固体培养30 d后获得,所用固体培养基为1/2MS+土豆50 g·L-1+蔗糖30 g·L-1,调节pH至 6.0。
BIOF-IV型植物生物反应器购自南京博方生物科技有限公司,工作原理为液体间歇浸没式培养,即液体培养基间歇的与组培苗接触,提供其生长所需营养,该设备分为上下结构,上部分为组培苗生长室,下部分为液体培养基储存室;采用气压作为培养基流动的动力、时间控制器控制流动频率。
固体培养所使用的容器为500 mL的兰花瓶,购自济南普朗特生物科技有限公司。
1.2 金钗石斛的植物生物反应器培养
将一定重量的金钗石斛原球茎接种到100 mL无菌的液体培养基中,适应性培养3~5 d,观察无污染后同液体培养基一同倒入无菌的反应器罐体,并补充900 mL液体培养基,完成接种,将反应器罐体连接到反应器的动力和控制系统中,设定浸没频率后进行培养。基本液体培养基为1/2MS+土豆50 g·L-1+NAA 0.5 mg·L-1,pH 6.0;培养环境为光照强度1 800~2 000 lx,光照周期14 h·d-1,温度(25±1)℃;培养周期为90 d。
1.3 金钗石斛的固体培养
固体培养使用500 mL的兰花瓶作为容器,每瓶中放入100 mL固体培养基,并接种1 g原球茎。固体培养基配方为1/2MS+土豆50 g·L-1+NAA 0.5 mg·L-1+蔗糖30 g·L-1+琼脂6.5 g·L-1,pH 6.0。培养环境与反应器培养实验组相同。
1.4 培养条件优化
采用单因素分析对浸没频率、接种量和培养基蔗糖浓度进行优化,每个因素设置4个水平。
1.4.1浸没频率优化 浸没频率为生物反应器培养的重要参数之一,直接影响植株生长情况。固定接种量为10 g、蔗糖浓度为30 g·L-1,设定浸没时间为5 min,间隔时间为1、4、8、12 h,实验组分别命名为A1、A2、A3、A4。
1.4.2接种量优化 反应器罐体中的接种量决定着罐体空间的利用率。固定蔗糖浓度为30 g·L-1、浸没频率为5 min/8 h,设定每个罐体原球茎的接种量为1、5、10、15 g·L-1,实验组分别命名为B1、B2、B3、B4。
1.4.3蔗糖浓度优化 培养基中的糖成分为植物的生长提供了碳源,培养基中蔗糖的浓度直接影响植株的增殖和生长情况。固定接种量为10 g、浸没频率为5 min/8 h,设定培养基中糖浓度为0、10 、20、30 g·L-1,实验组分别命名为C1、C2、C3、C4。
1.5 生长状态及增殖倍数检测
培养90 d后,取出金钗石斛组培苗,分别测量株高、根长和茎粗。将组培苗用清水洗净,吸水纸吸干的表面水分,精确称量鲜重m2,接种原球茎的重量为m1,计算增殖倍数。
增殖倍数=m2/m1
1.6 多糖含量测定
采用硫酸-蒽酮法[13]测定多糖含量。
1.6.1标准曲线制备 取分析纯蔗糖,置于垫有称量纸的平皿中,60 ℃烘干,准确称取0.100 g,用少量蒸馏水溶解后转移到100 mL容量瓶中,再加入0.5 mL浓硫酸,用蒸馏水定容至刻度,使用时再稀释10倍作为标准溶液。分别取蔗糖标准溶液0、0.2、0.4、0.6、0.8、1.0 mL,用蒸馏水补足到2.0 mL,依次分别加入蒽酮试剂0.5 mL、浓硫酸溶液5 mL,混匀,在沸水浴中10 min,冷却后620 nm处测量OD值。标准曲线制作时以浓度为横坐标,OD值为纵坐标绘制标准曲线。
1.6.2金钗石斛组培苗多糖提取与检测 将金钗石斛组培苗烘干,用粉碎仪粉碎后,将粉末过60目筛,称取0.1 g样品粉末于三角烧瓶,加入25 mL煮沸的蒸馏水,混匀后放入沸中水浴30 min,取出三角瓶冷却后过滤,滤液在容量瓶中定容至50 mL,获得多糖提取液,将提取液稀释10倍作为样品液。显色和检测步骤同标准曲线制备过程,根据标准曲线的方程式和样品液的OD值计算样品液中多糖浓度和多糖含量。
1.7 生物总碱测定
1.7.1标准曲线制作 称取干燥至恒重的石斛碱对照品1 mg,置于100 mL容量瓶中,用三氯甲烷定容至100 mL,作为标准溶液。取标准溶液1.0、2.0、3.0、4.0、5.0 mL 分别置于60 mL的分液漏斗中,用三氯甲烷稀释至10 mL,加入pH 4.5的缓冲液 5.0 mL和0.04%溴甲酚绿溶液2.0 mL,振摇混匀5 min,静置30 min。取滤液5 mL,加入0.01 mol·L-1氢氧化钠乙醇溶液 1.0 mL,摇匀,于620 nm处测OD值,标准曲线制作时以浓度为横坐标,OD值为纵坐标绘制标准曲线。
1.7.2生物总碱提取与检测 样品烘干后粉碎,取粉末0.5 g,用适量氨水湿润,密封放置30 min,精确加入三氯甲烷10 mL,置于80 ℃水浴加热回流2 h,冷却后称重,补足失重,过滤。取滤液1 mL于100 mL容量瓶中,补足三氯甲烷至刻度,混匀,作为样品液。显色和检测步骤如同标准曲线,根据标准曲线的方程式和OD值计算样品液中生物总碱浓度,再计算样品中生物碱含量。
2 结果与分析
2.1 不同培养条件对组培苗生长状态的影响
不同培养条件下金钗石斛组培苗的形态如表1所示。
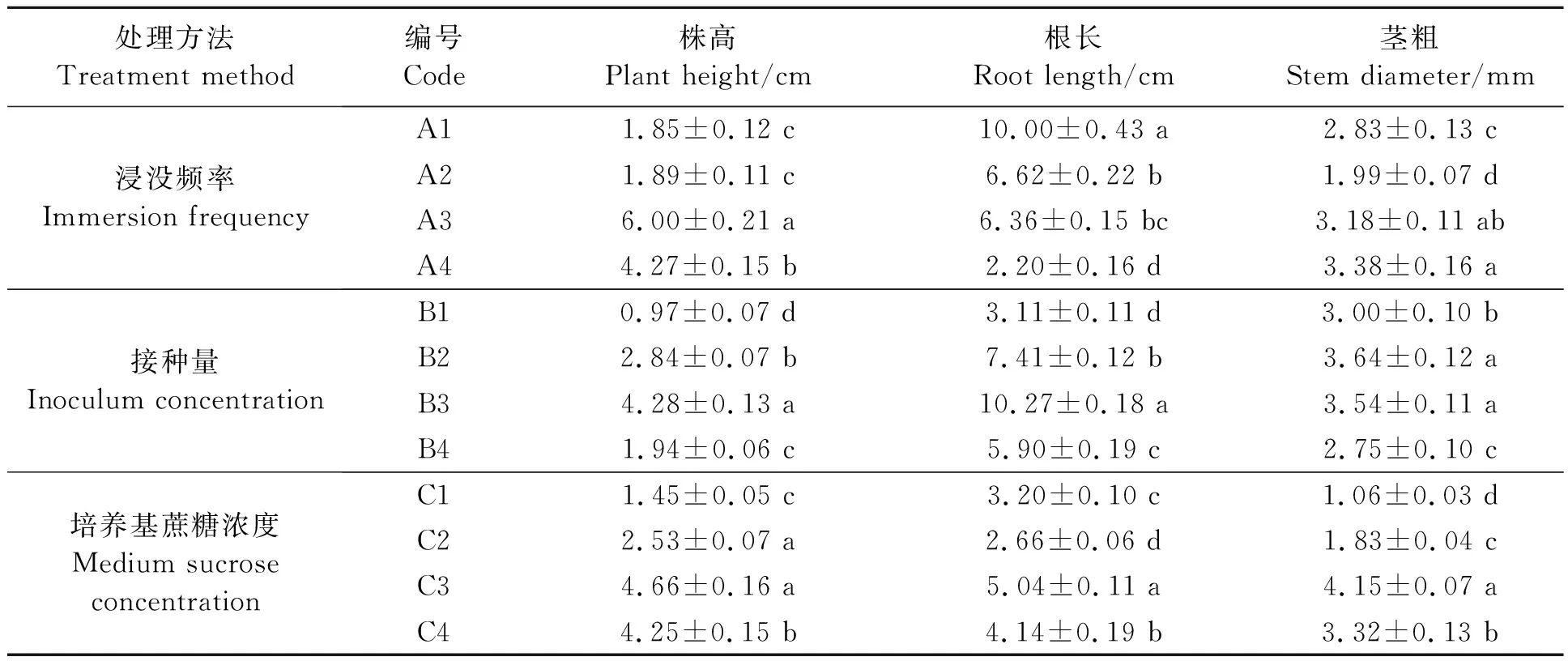
表1 不同反应器培养条件对金钗石斛组培苗形态特征的影响Table 1 Effect of different culture conditions on morphological characters of D. nobile plantlets
2.1.1浸没频率对组培苗生长状态的影响 浸没频率不同组培苗形态出现明显差异,间隔时间长植株茎的生长状态较好,间隔时间短根的生长状态较好,即实验组A3和A4植株茎的高度和茎粗优于其他两组,且差异显著;而实验组A1和A2根长优于其他两组,但A2和A3差异不显著,根据种苗移栽经验根不宜太长,因此最佳的反应器培养种苗的浸没频率为实验组A3。
2.1.2接种量对组培苗生长状态的影响 接种量对组培苗生长状态具有显著影响,组培苗生长状态最好的为实验组B3,优于接种量较低的实验组B1和B2,说明金钗石斛种苗的生长具有一定的群体效应,但当接种量过高,由于空间不足组培苗相互“挤压”而生长受到影响[14],组培苗细弱。
2.1.3蔗糖浓度对组培苗生长状态的影响 间歇浸没培养是一个半开放式的培养,在培养的过程中进行了有效的气体交换[15],为组培苗的生长提供充足的CO2,因此对液体培养基中蔗糖(碳源)需求量减少。从表1可看出,当蔗糖浓度为C3(20 g·L-1)时,组培苗的生长状态最佳,而固体培养一般使用的蔗糖浓度为30 g·L-1,因此,间歇浸没反应器培养可以节省部分糖源;当培养基中不含蔗糖时,组培苗也有一定的生长,说明间歇浸没生物反应器具有无糖培养的潜力。
2.2 不同培养条件对增殖的影响
增殖倍数是培养能力的重要表现形式之一,在不同的浸没频率、接种量、蔗糖浓度条件下培养金钗石斛组培苗90 d后测定增殖倍数,结果如图1所示,浸没频率为A3、接种量为B3、蔗糖浓度为C3时,所获得的增殖倍数最高;通过浸没频率实验组与其他实验组增殖情况相比较发现,前者均高于后两者,也可以说明浸没频率是影响金钗石斛组培苗间歇浸没培养增殖倍数的关键因素。
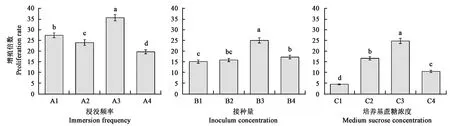
注: 图中不同小写字母表示差异在P<0.05 水平具有统计学意义。Note: Different small letters in the figure indicate significant difference at P<0.05 level.图1 不同培养条件对金钗石斛组培苗增殖倍数的影响Fig.1 Effect of different culture conditions on proliferation rate of D. nobile plantlets
2.3 不同培养条件对组培苗中多糖含量的影响
利用反应器培养金钗石斛组培苗,90 d后检测不同培养条件下组培苗中多糖含量情况,结果如图2所示:浸没时间5 min,间隔时间为8 h(A3)有利于组培苗中多糖的积累,并与其他实验组差异显著;接种量为10 g·L-1(B3)时,检测的组培苗中多糖含量最高;随着培养基中蔗糖浓度的提高,组培苗中多糖含量也逐渐提高,C4时为最高。
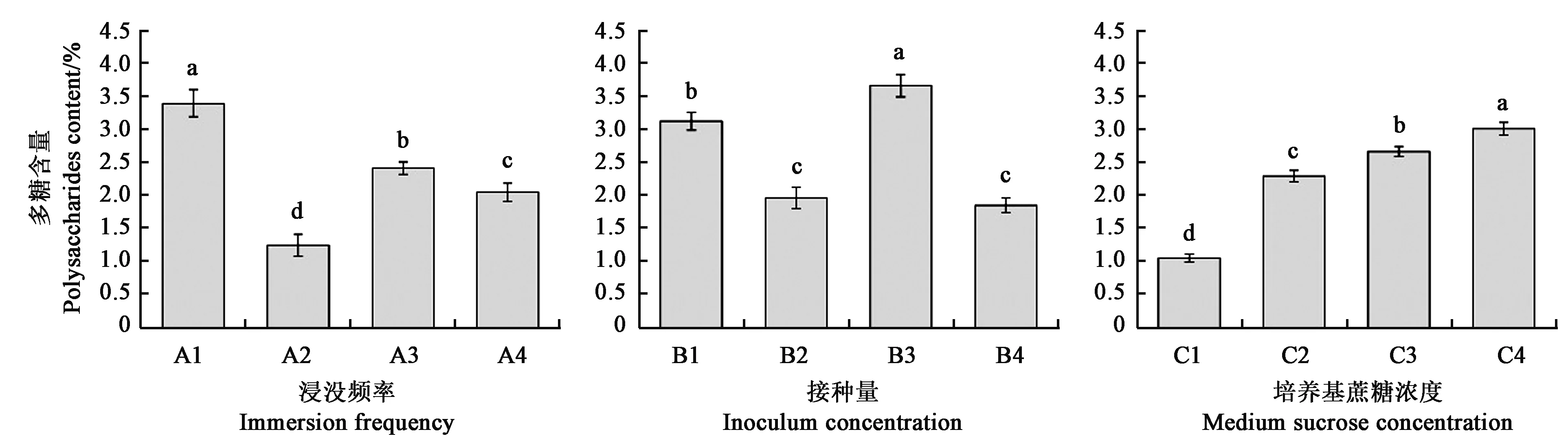
注: 图中不同小写字母表示差异在P<0.05 水平具有统计学意义。Note: Different small letters in the figure indicate significant difference at P<0.05 level.图2 不同反应器培养条件对金钗石斛组培苗多糖含量的影响Fig.2 Effect of different culture conditions on polysaccharides content of D. nobile plantlets
2.4 不同培养条件对组培苗中生物总碱含量的影响
生物碱是金钗石斛中重要的药效成分,其含量直接影响药材的质量。利用间歇浸没式植物生物反应器培养金钗石斛组培苗,不同培养条件下组培苗中生物总碱的含量检测结果如图3所示。结果显示:浸没时间为5 min,随着间隔时间的增加,生物总碱的含量先升高后降低,在A3(间隔时间8 h)时含量最高,各实验组之间差异显著;接种量方面,在接种量为B1(1 g·L-1)到B3(10 g·L-1)时,生物总碱含量没有明显变化,接种量继续增加到B4(15 g)生物总碱含量明显降低;培养基中蔗糖浓度不同,生物总碱含量出现明显差异,在蔗糖浓度为C3(20 g·L-1)时含量最高。

注: 图中不同小写字母表示差异在P<0.05 水平具有统计学意义。Note: Different small letters in the figure indicate significant difference at P<0.05 level.图3 不同反应器培养条件对金钗石斛组培苗生物总碱含量的影响Fig.3 Effect of different culture conditions on total alkaloids content of D. nobile plantlets
2.5 不同培养方式幼苗生长状态比较
传统的植物组织培养依靠以琼脂为支撑物的固体培养基,由于该技术使用相对密闭的小容器,培养过程中无法进行有效的气体交换,种苗生长受到一定的影响。对相同培养条件下金钗石斛的固体培养和间歇浸没式植物生物反应器培养进行比较,结果如图4所示,反应器获得植株生长状态明显优于固体培养,前者的株高3~5 cm、茎粗2~3 mm、根长2~3cm,后者的株高1.5~3 cm、茎粗1~2.5 mm、根长0.5~1 cm。通过组培苗中多糖和生物总碱含量比较也发现反应器培养的组培苗两种成分含量均显著高于固体培养,前者的数值为3.82%和0.32 mg·g-1,后者的数值是2.41%和0.22 mg·g-1。采用树皮为基质,相同的水肥管理,种植30 d后两种培养方式下的种苗炼苗成活率反应器高达100%,而固体培养的为95%,并且发现反应器培养的种苗更早长出新芽,生长状态优于固体培养。

A:反应器培养90 d;B:反应器中培养90 d的组培苗;C:固体培养90 d;D:固体培养90 d的组培苗。A: Plant bioreactor culture for 90 d; B: Plantlets in plant bioreactor for 90 d; C: semi-solid culture for 90 d; D: Plantlets in semi-solid medium for 90 d.图4 不同培养方式对金钗石斛组培苗的比较(bar=2 cm)Fig.4 Comparison of different culture methods for tissue culture of D. nobile(bar=2 cm)
3 讨论
金钗石斛是石斛中的名贵品种,目前野生金钗石斛已越来越少,人工种植已经有较大规模,因此优质种苗的生产成本关键。
目前,金钗石斛种苗的生产方式有两种:一是茎节扦插的方式,该方法简单、成活率高,但也导致致病微生物的富集,种苗质量逐年降低的问题[16];二是利用植物组织培养方法进行种苗的生产,但目前大多采用的是一种以玻璃或塑料瓶为容器、琼脂为支撑物的固体培养,容器的密闭性导致无法进行有效的气体交换,组培苗生长受到抑制[17],为了便于操作和避免污染容器一般较小,所能提供的营养物质有限,在培养的过程中需要将组培苗不断的转接到新的培养基中来保证其正常生长,因此,需要大量的人工、物料等投入,导致生产成本较高[18]。
间歇浸没式植物生物反应器是在传统的植物固体和液体组织培养的基础上,采用机械动力、程序控制等实现了半自动培养的一种方法[19]。该方法采用液体培养实现了培养容器的增大和营养物质的高效利用[20],采用无菌空气压缩产生的气压驱动液体培养基流动并实现容器内外气体的有效交换[21],从而实现了培养周期的缩短和组培苗的更健康生长,提高了生产效率、降低了生产成本,并且由于培养容器的增大和容器的串并联,实现了高通量的培养。
间歇浸没式植物生物反应器的重要培养参数是浸没频率、接种量和培养基蔗糖溶度。其中,浸没频率决定了营养物质的吸收是否充分,组培苗的玻璃化与否,相关报道表明,较高的浸没频率(≥1 h/6 h)适宜块根块茎的形成,较低的浸没时间(≤1 min/12 h)能够促进体细胞胚体的形成,而两者之间的浸没频率适宜种苗的生长[22-23],本文筛选的金钗石斛种苗培养的最适浸没频率为5 min/8 h,符合这一规律。接种量决定了培养容器的空间利用率和组培苗的生长状态,接种量过低,成苗后的容器空间没有完全利用造成浪费,接种量过高,组培苗相互拥挤,不能正常生长,如白芨种苗的培养[24],本文以金钗石斛原球茎为外植体,优选到最适的接种量为10 g·L-1,接种量过高或过低不不利于种苗的培养。培养基蔗糖浓度决定了组培苗是否能够健康生长,一般情况下蔗糖浓度偏低组培苗弱小,容易出现褐化,蔗糖浓度过高,组培苗徒长,加重玻璃化情况[25],本文筛选的最适培养基蔗糖浓度为20 g·L-1,在此浓度下金钗石斛种苗生长健康。通过培养条件的优化,间歇浸没式植物生物反应器已成功应用于多种植物的培养中,但不同的植物的生活习性不同,培养条件各不相同,需对每一种植物的培养参数进行优化。
本文进行了间歇浸没式植物生物反应器培养金钗石斛种苗的重要的培养参数的优化,建立了金钗石斛间歇浸没液体培养体系,为金钗石斛优质种苗的生产提供一种高效率、低成本的方法。
