植物MAPK级联途径应答的非生物胁迫研究进展
2020-03-13周秒依任雯赵冰兵李韩帅刘亚
周秒依, 任雯, 赵冰兵, 李韩帅, 刘亚
(北京市农林科学院玉米研究中心, 玉米DNA指纹及分子育种北京重点实验室, 北京 100097)
植物在生长发育过程中不断受到各种来自外界环境的逆境胁迫,包括生物胁迫和非生物胁迫,其中非生物因素又包括物理和化学因素。为保证正常的生长发育,植物在长期的进化过程中演变出多种多样的抗逆机制,其中关键的是对胁迫信号的感受、识别、传递、放大及转导,从而激活响应信号抵御自身在逆境中受到的伤害,如干旱、涝害、盐碱、阴雨寡照、高温、冷害等[1]。研究植物抗逆反应的信号传导机制及筛选抗逆基因对于提高植物逆境胁迫抵御能力具有重要意义。
蛋白质的可逆磷酸化过程包括磷酸化和去磷酸化,是生物体内普遍存在的一种调节机制,是传递和放大信号的必要途径,在细胞转导过程中起重要作用。磷酸化反应中的蛋白激酶和去磷酸化反应中的蛋白磷酸酶是调控这一过程的两类关键性酶。蛋白激酶是一类在胞内信使依赖的,在蛋白质磷酸化过程中起中介和放大作用并帮助完成信号传递过程的酶,利用ATP或GTP作为磷酸基团供体,将磷酸基团转移到特定底物蛋白上。根据磷酸化底物蛋白氨基酸残基的不同,可将蛋白激酶分为丝氨酸/苏氨酸蛋白激酶、酪氨酸蛋白激酶、组氨酸蛋白激酶等,目前研究较多的为丝氨酸/苏氨酸蛋白激酶的促分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和Ca2+依赖型蛋白激酶(calcium-dependent protein kinase,CDPK)等。本文综述了植物中MAPK级联途径调控网络、组成、分类以及对非生物胁迫的应答等方面的研究进展,以期为系统的理解植物MAPK级联途径及其在非生物逆境胁迫下的表达调控等提供帮助。
1 MAPK级联途径调控网络
促分裂原活化蛋白激酶是一种高度保守的蛋白激酶,广泛存在于包括动物、植物、微生物等真核生物中。MAPK级联途径是一种重要的细胞信号传导模式,特异性感受上游信号分子的刺激从而被激活,通过磷酸化与去磷酸化逐级活化[2],从而将胁迫信号放大,传递到终端接收的靶蛋白,引起细胞内一系列生理生化反应,实现细胞的抗逆功能[3]。
MAPK级联途径由三种丝氨酸/苏氨酸磷酸蛋白激酶组成,即MAPKKK(MAP3K/MEKK/MKKK)、MAPKK(MKK/MEK)以及MAPK(MPK),它们通过磷酸化顺序被激活(图1)[4-5]。MAPKKK为MAPK级联途径最上游的蛋白激酶,通过感受外界刺激信号,从而被磷酸化激活。MAPKKK通过磷酸化MAPKK中保守区域中S/T-x3-5-S/T基序(S表示丝氨酸,T表示苏氨酸,x表示任意氨基酸,3-5表示氨基酸个数),从而完成对MAPKK的激活。MAPKK是一类双特异性蛋白激酶,通过磷酸化MAPK第7和第8亚结构域之间的丝氨酸/苏氨酸和酪氨酸残基激活MAPK[6]。MAPK作为整个级联途径的最下游,被激活后进入细胞核,通过激活特定转录因子引起功能基因表达,或停留在细胞质中调节其他特定靶蛋白的活性,例如蛋白激酶、蛋白磷酸酶、细胞骨架蛋白、微管蛋白等,最终引起植物细胞对内外刺激的一系列生理生化反应。不同信号刺激可以通过相同MAPK级联途径传递,而同一种信号也可以通过激活不同MAPK信号通路共同传递。
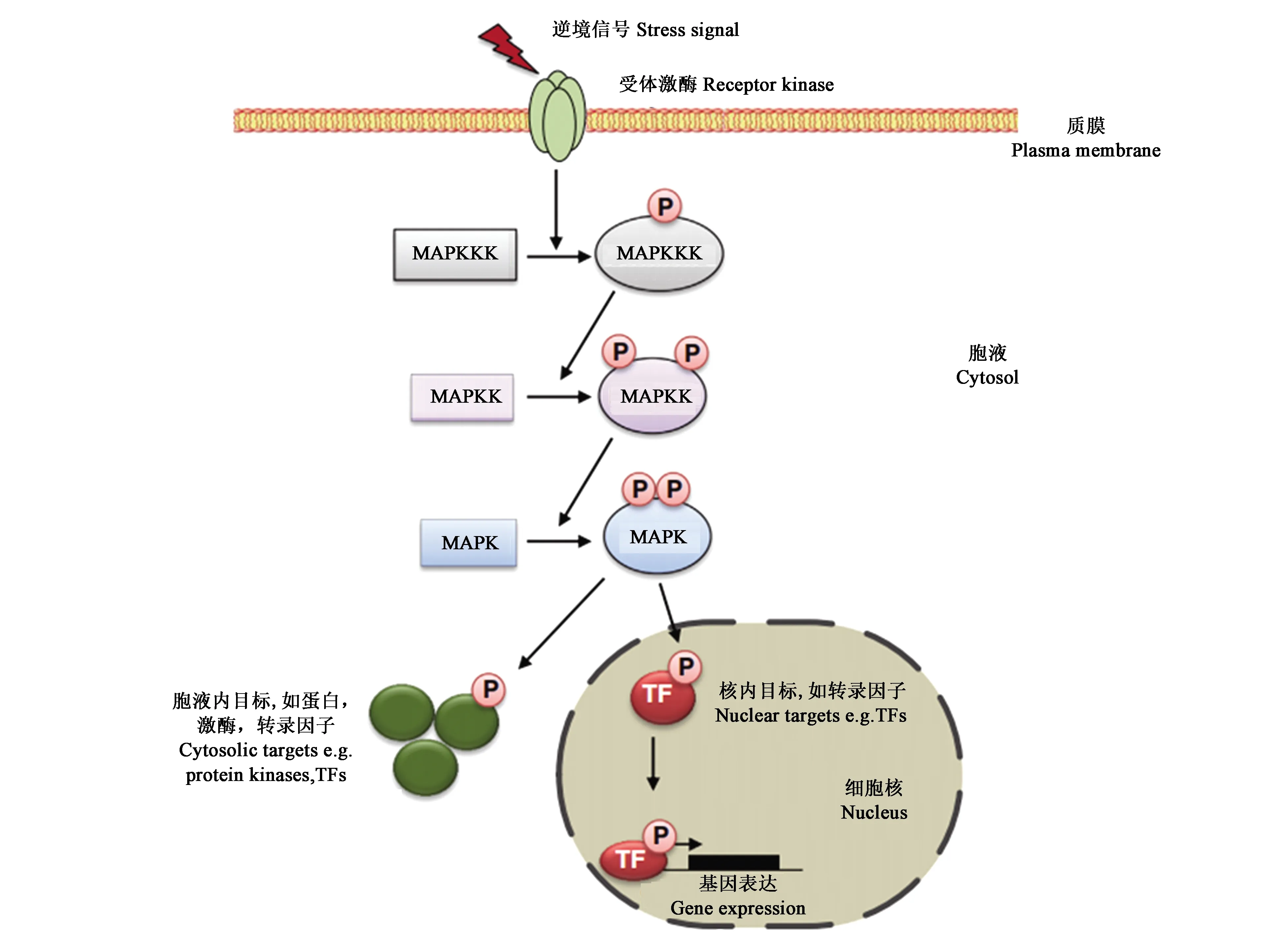
图1 MAPK级联途径模式[5]
2 植物MAPK级联的组成与分类
目前,一些研究利用生物信息学软件对各激酶的氨基酸序列以及结构进行分析,根据其蛋白催化区域氨基酸序列及结构的不同,各激酶成员被分为几种亚型。
2.1 MAPKKK
MAPKKK位于MAPK级联途径的最上游,被分为三种亚型:Raf、MEKK、ZIK。Raf亚型含有GTxx(W/Y)MAPE保守结构域,MEKK亚型具有G(T/S)Px(W/F/Y)MAPEV保守结构域,ZIK亚型具有GTPEFMAPE(L/V/M)(Y/F/L)结构域。
植物MAPKKK是MAPK家族中成员最多的一类,拟南芥中有80个MAPKKK基因,其中48个属于Raf亚型,21个属于MEKK亚型,11个属于ZIK亚型[2]。水稻中存在75个,其中这三种亚基类型分别有43个、22个和10个成员[7]。小麦中含有155个MAPKKK成员,这三种亚基类型分别有115个、29个和11个成员[8]。二穗短柄草中有75个MAPKKK基因,分别有45个属于Raf亚型,24个属于MEKK亚型,6个属于ZIK亚型[9]。玉米中MAPKKK有71个成员,37个为Raf亚型,26个为MEKK亚型,8个为ZIK亚型。染色体定位分析表明,玉米10条染色体上都有MAPKKK基因的分布,亚细胞定位预测分析显示多数MAPKKK基因定位于细胞核、叶绿体或细胞质中[9]。另外,研究发现高粱中共有49个MAPKKK成员,Raf亚型有32个,MEKK亚型有11个,ZIK亚型有6个,染色体定位分析表明,高粱10条染色体上都有MAPKKK基因的分布,亚细胞定位预测分析显示多数MAPKKK基因定位于细胞核或细胞质中(未发表数据)。
2.2 MAPKK
MAPKK是一种具有双重磷酸化功能的特异性蛋白激酶,在被MAPKKK磷酸化激活后,再通过磷酸化下游MAPK中保守T-x-Y序列的Thr残基和Tyr残基将其激活,进行信号传递。MAPKK具有11个保守的亚结构域,根据其蛋白催化区的氨基酸序列以及结构被分为了A、B、C、D4个亚型,除D亚型外,其余3个亚型在第7和第8个亚结构域中间均含有一段保守的S/TxxxxxS/T基序。
目前,已经发现的MAPKK数量较少,拟南芥中仅有10个MAPKK成员,其中3个为A亚型,1个为B亚型,2个为C亚型,4个为D亚型[3]。水稻中有8个成员,A和C亚型各有2个成员,B亚型1个成员,D亚型3个成员[10]。玉米中共9个MAPKK成员,其中A、C和D亚型各含有2个MAPKK成员,B亚型含有3个[11]。小麦共有18个MAPKK成员,其中4个亚型数量分别为3个、2个、1个和12个[12]。二穗短柄草中有12个MAPKK成员,A和D亚型各有2个成员,B亚型含有3个成员,C亚型有5个成员[13]。目前,研究发现高粱中含有8个MAPKK成员,B和C亚型分别仅有一个MAPKK,2个为A亚型,4个为D亚型(未发表数据)。酵母双杂交技术和体外激酶试验研究已经证明,MAPKK在信号传导途径中具有兼容性及高效性,通常一种MAPKK可以被多种上游MAPKKK激活,同时能够磷酸化多种下游的MAPK[14],这可能正是MAPKK作为MAPK信号转导途径的中间激酶却反而数量最少的主要原因之一。
2.3 MAPK
MAPK位于整个级联系统的下游,是磷酸化底物种类繁多的一类Ser/Thr蛋白激酶。当MAPK被激活后有可能通过进入细胞核调控特定转录因子,从而引发功能基因的表达;也可能通过停留在细胞质中,进一步激活其他的靶蛋白,从而引起植物细胞产生应激反应。MAPK蛋白含有TDY基序、TEY基序或MEY基序。MAPK成员也分为A~D共4个亚型,其中D亚型成员数量均较多。
植物中MAPK的数量介于MAPKKK和MAPKK之间,拟南芥中含有20个MAPK基因,其中8个为D亚型[3]。水稻中含有15个MAPK,有10个为D亚型[10]。玉米的19个MAPK中,D亚型有11个[15]。高粱中共含有16个MAPK成员,其中10个为D亚型MAPK[16]。小麦中共有54个MAPK,36个为D亚型[12]。二穗短柄草的16个MAPK中,有9个为D亚型[13]。
3 植物MAPK级联途径参与调控的非生物胁迫
在高等植物中,MAPK级联途径是一条在进化中高度保守的途径,不光参与了细胞的分裂、凋亡以及植物分化发育等植物生长过程,还参与了激素调节、生物胁迫以及非生物胁迫的应答。MAPK级联途径在不同植物以及其生长发育的不同时期中,针对多种逆境都发挥了极其重要的作用。研究显示,该级联途径在干旱、极端温度、高盐碱、重金属及损伤胁迫等极端环境胁迫应答方面具有突出作用。
3.1 植物MAPK级联途径参与干旱胁迫的调控应答
干旱是严重影响植物生长的非生物胁迫因素之一。研究证实,MAPK通路可对干旱胁迫作出防御反应。在干旱条件下,过表达AtMKK1植株较突变型及野生型植株提高了存活率[17]。拟南芥MAPKKK基因raf43-1突变体会增加植株对干旱的敏感[18]。Kovtun等[19]利用表位标注及原生质体瞬时表达实验表明,拟南芥中介导干旱胁迫耐受的MAPKKK基因ANP1可被H2O2激活,从而激活下游AtMPK3和AtMPK6的表达。研究表明,拟南芥MAPKKK18-MKK3-MPK1/2通路介导植株ABA诱导依赖的抗旱性调控[20]。水稻中的OsMAPKKK8、OsMAPKKK28、OsMKK1、OsMSRMK2和OsMAPK5在干旱条件下表达水平均显著增强[6,21-22]。过表达MAPKKK基因DSM1可以显著增强水稻转基因株系苗期的抗旱性,调节活性氧的清除[23]。干旱诱导下,玉米中ZmMAPKKK18、ZmMAPKKK19、ZmMAPKKK20、ZmMAPKKK21、ZmMAPKKK22、ZmMAPKKK26、ZmMAPKKK56、ZmMAPKKK73以及ZmMEK1和ZmMPK3的转录水平迅速提高[9,24-25]。过表达ZmMKK1、ZmMKK4或ZmMAPK1可增强拟南芥转基因植株对干旱胁迫的耐受性[26-28]。在烟草中,过表达玉米MAPK家族基因ZmMKK3、ZmMKK4、ZmMPK5、ZmMPK7或ZmMPK17可减少H2O2的积累,减轻ROS介导的DNA损伤,提高转基因烟草的耐氧化胁迫能力,对植株干旱胁迫应答起到正向调控作用,转基因烟草植株表现出较强的抗旱能力[29-33]。转烟草MAPKKK基因NPK1的玉米转基因植株表现出明显强于野生型的抗旱能力,在干旱条件下具有较高的光合效率[34]。木薯中MeMAPKKK16、MeMAPKKK18、MeMAPKKK19、MeMAPKKK20、MeMAPKKK30、MeMAPKKK23、MeMAPKKK40均在干旱处理2 h到14 d时上调表达[35]。近期研究发现,高粱MAPK家族基因SbMAPKKK39及SbMAPKKK47在干旱胁迫时显著上调表达,SbMAPKKK28-SbMKK10-2-SbMPK14通路可能参与SbPP2C介导的ROS清除,对干旱起到正调控作用。
3.2 植物MAPK级联途径参与极端温度刺激的调控应答
温度变化是植物在整个生命周期中最常见的胁迫之一,植物的生长发育调控依赖于对低温和高温的感知。低温胁迫不利于植物的正常代谢,严重时造成植株冻害。近年研究发现,MAPK参与调控植物低温胁迫。拟南芥中通过酵母双杂交实验证明,低温刺激下通过激活AtMEKK1基因的表达,从而磷酸化下游的AtMEK1和AtMKK2,进一步激活下游激酶AtMPK4和AtMPK6以抵御低温胁迫[36],实验表明,在低温4 ℃处理10 min后,AtMPK4/6可被AtMKK2磷酸化激活[37]。在水稻中OsMAPKKK63、OsMAPKKK64、OsMKK4、OsMKK10-2、OsMAPK2、OsMAPK4可被低温胁迫诱导表达[6,21,38-39]。在低温诱导下,OsMKK6可以通过激活下游OsMPK3蛋白从而抵抗低温带来的伤害[40]。过表达水稻OsMAPK5基因可增加转基因植株的耐冷性,抑制该基因表达可增加植株对低温的敏感性[41]。Berberich通过免疫印迹法研究发现,低温胁迫下玉米叶片中ZmMPK5表达显著提高[42]。ZmMPK3的mRNA表达水平在低温30 min处理后立刻上升,4 h后开始下降[25]。过表达ZmMKK4可增强拟南芥转基因植株对低温胁迫的耐受性[26]。在烟草中,对玉米ZmMPK4或ZmMPK17基因进行过表达,可减少烟草转基因植株体内活性氧的积累,增加脯氨酸含量,增强植株低温耐受性[31,43]。将玉米苗期进行低温胁迫处理7 d后,幼苗根系中的ZmMEK1基因表达量达到较高水平[44]。棉花中MAPKKK基因GhRaf19正向调控低温胁迫,低温处理1 h后该基因表达水平开始上调,处理4 h时基因表达水平达到最高值,随后下降[45]。过表达GhRaf19增加植株耐低温能力。在低温刺激下,香蕉中的两组基因MaMKK2-MaMEKK1及MaMKS1-MaWRKY33共表达调控,上调应答低温胁迫[46]。
在高温环境下,植物正常生理机能会受到影响,加速成熟老化速度。在农业中,高温会对作物产量造成重大损失。MAPK信号通路除了参与低温胁迫应答外,也参与植物对高温胁迫的调控,拟南芥AtRaf8、AtRaf25和AtZIK4在高温刺激下表达上升[47]。37 ℃高温处理30 min使水稻OsMSRMK2转录水平下降,恢复25 ℃环境30 min后表达水平回升,而在低温12 ℃处理60 min内该基因的表达量开始积累[22]。沉默棉花中的MAPKKK基因GhMAP3K65可以诱导植株对高温胁迫的应激反应,提高植株对高温刺激的抗性[48]。黄瓜MAPK基因CsMPK4-1及CsMPK9-1在高温刺激1~4 h处理下表达水平提高,在8 h处理下表达水平达到高峰[49]。
3.3 植物MAPK级联途径参与高盐碱胁迫的调控应答
植物盐胁迫通常伴随着生理干旱和盐离子毒害作用,全球很多地区的农业严重受盐分胁迫影响。研究发现,部分MAPK成员参与调控植物高盐碱应答过程,AtMEKK1通过磷酸化AtMKK2和AtMEK1,进而激活下游激酶AtMPK4和AtMPK6以抵抗高盐碱胁迫的刺激[37]。水稻OsMAPK44基因被高盐胁迫诱导表达,同时对该基因过表达研究显示,过表达转基因植株在高盐碱刺激下损伤更小[50]。过表达水稻OsMAPK5基因可增加转基因植株的耐盐性,而抑制该基因的表达可增加植株对盐碱浓度的敏感性[41]。玉米中ZmMKK1与拟南芥AtMEKK1基因高度同源,在高盐碱环境下,ZmMKK1作为高盐碱胁迫诱导的正向调控蛋白,可提高植株的耐盐碱性,通过酵母双杂交实验发现ZmMKK1与ZmMEKK1为互作蛋白[27]。盐胁迫下玉米ZmMPK3的mRNA水平在处理30 min后积累,4 h后开始下降[25]。烟草中过表达玉米ZmMPK5的转基因植株通过清除活性氧减轻高盐碱胁迫,从而增强转基因烟草对病毒病原体的抗性和抗氧化应激能力[30]。在高盐碱刺激下,香蕉中的MaMKS1-MaWRKY33基因共表达调控应答高盐碱胁迫[46]。此外研究显示,过表达玉米ZmMKK4、棉花GhMAP3K40、GhMPK2等基因可以增强转基因植株对高浓度盐碱的抗性[26,51-52]。
3.4 植物MAPK级联途径参与其他非生物胁迫的调控应答
MAPK信号通路也参与响应重金属、损伤、UV等胁迫信号。尽管许多重金属离子在植物生长发育过程中是必不可少的,但是高剂量的重金属离子对植物存在着不利的影响。紫花苜蓿幼苗暴露于过量的铜或镉离子下,可以激活四种MAPK激酶,SIMK、MKK2、MKK3 及SAMK,以应对重金属对植株的毒害作用[53]。在过量砷离子处理下,水稻OsMPK3、OsMPK4、OsMKK4基因被诱导表达[54]。此外研究显示,水稻OsMSRMK2参与镉胁迫的应答[22]。
另外,一些研究表明,MAPK信号途径也参与了臭氧及UV胁迫的应答反应。烟草中发现沉默NtMPK4的植株对臭氧刺激更加敏感,而对NtMPK4上游基因SIPKK的过表达植株可增强转基因植株对臭氧刺激的响应[55]。叶片在臭氧处理后,拟南芥AtMPK3和AtMPK6、烟草NaSIPK被诱导表达[56,57]。水稻中OsMSRMK2基因和玉米中ZmSIMK基因的表达被UV胁迫诱导,然而水稻OsMSRMK3、OsWJUMK1基因和玉米ZmMPK5基因在UV处理下表达水平出现下调情况[22,58-59]。拟南芥的AtMPKKK14和AtMKK9在创伤刺激及UV-B处理早期表达上调,AtMPK7在创伤及UV-B刺激后期表达上调[47]。利用实时荧光定量PCR研究表明,玉米MAPK基因ZmMPK3在重金属、损伤、UV等胁迫下的表达水平均表现出显著升高。镉胁迫处理0.5~1 h,ZmMPK3基因的mRNA水平显著升高,随后下降;在创伤刺激和UV胁迫下该基因的mRNA水平在30 min处理后开始积累,4 h后下降[25]。
4 结语
MAPK级联途径在植物非生物胁迫应答中具有重要的作用,在积累了大量宝贵的经验和取得了许多重要的科研成果的基础上仍有必要对这一家族进行深入研究,以便能够找到更多的抗逆基因资源。目前,在植物中MAPK级联途径对非生物胁迫应答的研究成果大部分局限于MAPKK及MAPK基因,然而MAPK级联途径上游MAPKKK基因成员数量庞大,而对MAPKKK基因的研究相对较少,需要克隆更多的MAPKKK基因并研究其表达特性及生物学功能,挖掘它们在抗逆方面的价值。此外,很多研究成果只是初步了解了植物中某些MAPK家族基因的功能,并没有在植物中形成MAPK家族基因应答各种胁迫的表达调控网络,通过酵母单杂交等多种手段挖掘上游调控因子,系统分析逆境响应信号途径,构建和完善MAPK的调控网络非常有必要。许多MAPK家族成员存在功能冗余,一个基因的改变可能不会对植株抗逆性造成明显的影响,需要将更多基因联系起来,以便更好地了解它们在信号转导途径中的功能和调控机制。总之,随着更多MAPK家族成员被鉴定和MAPK调控网络研究的不断完善,将会有更多的研究成果应用到植物抗逆育种上,为生产服务。
