基于蛋白激酶的喉癌预后预测模型的构建与评估
2022-05-30杨莉娜崔昊晶胡文良
孙 娟,杨莉娜,崔昊晶,胡文良,苏 琳,2
(1.内蒙古医科大学附属医院耳鼻咽喉头颈外科,内蒙古 呼和浩特 010000;2.内蒙古医科大学研究生学院,内蒙古 呼和浩特 010050)
喉癌是头颈部最常见的恶性肿瘤之一,发病率呈逐年上升趋势[1]。喉癌发病隐匿,确诊时多为晚期,预后不佳[2]。以手术为核心的综合治疗仍是喉癌的主要治疗方式,但声音嘶哑、吞咽困难等并发症较为常见[3],患者在承受手术创伤的同时,还要承受失声等并发症带来的心理打击。有研究发现,蛋白激酶在调控肿瘤生长转移等方面发挥重要作用[4]。近年来,针对蛋白激酶进行的分子靶向治疗逐渐成为临床肿瘤治疗的热点,并取得了良好效果[5],但蛋白激酶在喉癌中作为诊疗靶点的潜力仍有待进一步挖掘。本研究利用生物信息学方法筛选与喉癌预后相关的蛋白激酶,并建立喉癌预后预测模型,通过功能分析明确预后相关蛋白激酶的作用,以期为喉癌的诊疗和预后评估提供新的靶点。
1 材料与方法
1.1 喉癌样本获取
从美国癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库获取96例喉鳞状细胞癌患者的样本转录组测序RNAseq数据及对应的临床数据。96例喉癌患者中,男82例,女14例;年龄<65岁者65例,>65岁者31例;原发肿瘤浸润T1~T2者17例,T3~T4者79例;淋巴结转移N0者41例,N1~N3者55例;60例仍存活,36例已死亡。
1.2 喉癌预后相关蛋白激酶的筛选
利用R语言(版本4.0.3)limma包提取TCGA数据库喉癌样本的生存时间及生存状态数据,再利用R语言survival包对蛋白激酶基因与喉癌预后生存时间的关系进行Cox单因素回归分析,从而筛选与预后相关的基因。将蛋白激酶库中的512个蛋白激酶基因和预后相关基因取交集后,获得与喉癌预后相关的蛋白激酶基因。同时绘制森林图,风险比(hazardratio,HR)>1代表高风险基因,HR<1代表保护基因。高风险基因表示蛋白激酶基因表达量与喉癌预后存在负相关,保护基因表示蛋白激酶基因表达量与喉癌预后存在正相关。
1.3 蛋白激酶基因相关喉癌预后预测模型的构建
利用最小绝对收缩与选择算子(least absolute shrinkage and selection operator,LASSO)回归分析对TCGA数据库中的喉癌样本进行风险评分,并构建预后预测模型。LASSO模型通过惩罚机制筛选出与患者生存相关的关键基因。根据风险评分的中位值将总样本分成高危组(高风险评分)和低危组(低风险评分)。基于R语言survival包比较2组患者生存差异。
1.4 喉癌预后相关蛋白激酶的GO功能分析
利用注释、可视化和集成发现数据库(The Database for Annotation,Visualization and Integrated Disco-very,DAVID)v6.8分析喉癌中与预后相关的蛋白激酶基因,分别在生物学过程(biological process,BP)、分子功能(molecular function,MF)和细胞成分(cellular component,CC)层面分析预后相关蛋白激酶在喉癌中的作用。
1.5 统计学分析
采用R语言及其相应程序包进行生物信息学分析。采用limma包进行数据标准化和差异表达分析。使用survival包、glment包、survminer包构建Cox回归模型,P<0.05为基因与预后具有显著相关性。利用R语言pROC包绘制受试者工作特征(receiveropera-tingcharacteristic,ROC)曲线,获得该模型预测喉癌患者预后的敏感度和特异度。利用riskScore、PCA、survStat和t-SNE的R包验证模型预测的准确度。利用DAVID数据库对基因进行功能分析,经Fisher精确检验,P<0.05为差异有统计学意义。
2 结果
2.1 喉癌预后相关蛋白激酶的筛选
基于TCGA数据库喉癌数据及Cox单因素回归分析结果显示,共有25个蛋白激酶基因与喉癌患者的预后生存时间显著相关(P<0.05)。其中MAP3K5、IL20RA、NPM1、PLAU、LAMB3、LAMC2、IL1RAP、CDK1和CDH3等9个蛋白激酶基因是喉癌预后的高风险基因(HR>1,P<0.05)。GNG7、PRLR、ELMO1、XPA、MAP3K14、OAZ1、CD36、RGMB、NOTCH1、THEM4、MAVS、TNF、LAMP1、MSRB2、ENTPD1和GMIP等16个蛋白激酶基因是喉癌预后的保护基因(HR<1,P<0.05),见图1。

图1 与喉癌预后相关的蛋白激酶基因
2.2 喉癌预后预测模型的生存分析
基于蛋白激酶基因构建的喉癌预后预测模型显示,通过计算MAP3K5、PRLR、OAZ1、CD36、RGMB、NOTCH1、THEM4、MAVS、IL20RA、NPM1、PLAU、MSRB2、ENTPD1、LAMC2、CDK1和GMIP等16个蛋白激酶基因的表达量所得出的风险评分能够将喉癌样本分成高危组和低危组。生存分析显示,高危组的生存率显著低于低危组(P<0.05),见图2。

图2 喉癌预后预测模型的生存率分析
2.3 喉癌预后预测模型的ROC曲线分析
ROC曲线分析结果显示,风险评分的曲线下面积(areaunderthecurve,AUC)在生存曲线的第1~3年分别为0.778、0.782和0.815。随着生存时间的延长,风险评分的AUC逐渐增大,提示该模型具有较高的预测喉癌预后的能力(图3)。
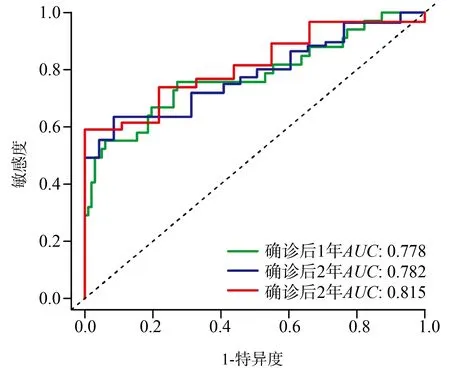
图3 喉癌预后预测模型的ROC曲线
2.4 喉癌预后预测模型评分与患者生存验证
基于蛋白激酶构建的喉癌预后预测模型的riskScore和survStat分析结果显示,随着患者风险评分的增加,高危组的病死率明显高于低危组(P<0.05);PCA和t-SNE分析结果显示,高危组和低危组的喉癌样本分布差异显著(P<0.05),见图4。证实该模型预测喉癌预后的准确度较高。

a:riskScore分析;b:PCA分析;c:survStat分析;d:t-SNE分析
2.5 喉癌预后相关蛋白激酶的GO功能分析
喉癌预后相关蛋白激酶的主要BP功能包括细胞黏附、细胞迁移正性调控、NF-kappaB及JUNK等信号通路的调控等(P<0.05);MF功能为蛋白激酶结合(P<0.05);CC功能提示这些蛋白激酶主要通过细胞膜发挥作用(P<0.05),见图5。

图5 喉癌预后相关蛋白激酶的GO功能分析
3 讨论
作为信号传导途径中的重要分子,蛋白激酶可通过磷酸化目标蛋白使信号逐级传递并放大,从而调节细胞的多种生物学行为,如细胞增殖、细胞凋亡、细胞周期、细胞移行等[6]。因此,蛋白激酶已成为抗癌治疗的重要靶点,但蛋白激酶在癌症预后预测方面的潜力还有待挖掘[7]。
本研究结果显示,25个蛋白激酶基因与喉癌的预后密切相关,基于其中16个蛋白激酶基因表达量而算出的风险评分能够将喉癌样本分成高危组与低危组,且高危组生存率显著低于低危组。提示由多种蛋白激酶所组成的基因集能够识别喉癌患者的预后风险,可能是预测喉癌预后的重要标志物。这个基因集中的多个基因对肿瘤的发生发展具有重要的调控作用。如Takada等[8]通过RT-PCR发现MAP3K5在喉癌中高表达,但其在喉癌中的作用还不清楚;Pressinotti等[9]研究发现,MAP3K5在前列腺癌中高表达并能将患者分成高危组和低危组,是前列腺癌的潜在治疗靶点。本研究结果显示,MAP3K5是喉癌预后的高危因素之一,与上述研究一致,提示MAP3K5是喉癌诊疗的重要潜在靶点。Bednarek等[10]发现CDK1在喉癌中高表达;Lian等[11]发现CDK1能够促进喉癌细胞发生淋巴转移。本研究结果显示,CDK1是喉癌预后的高危因素,CDK1的表达量与喉癌患者生存时间呈反比,与上述研究结果一致,提示CDK1是预测喉癌预后的重要靶点。Dasgupta等[12]发现CDH3在头颈部鳞癌中高表达,但作用尚不清楚。Zhou等[13]发现在敲减CDH3后甲状腺癌细胞增殖、侵袭被显著抑制。Wang等[14]发现NPM1在喉癌中高表达,敲减NPM1后喉癌细胞的凋亡率显著增加。有研究表明,LAMB3在多种癌细胞中高表达并可促进癌症进展,如胰腺癌、结肠癌等[15-16],但在喉癌中的表达情况尚不清楚。GMIP是一个肿瘤抑制因子,在肺癌和膀胱癌中发挥重要抑癌作用[17-18];OAZ1是一个新型抑癌因子,过表达后能够抑制非小细胞肺癌、口腔鳞癌等恶性肿瘤细胞增殖转移[19-20]。本研究结果显示,以上蛋白激酶在喉癌中低表达,并与喉癌患者的预后呈正相关,提示这些蛋白激酶具有作为喉癌诊疗新靶点的潜力。
有研究发现,细胞黏附与肿瘤转移密切相关,黏附分子能提高癌细胞间的黏附性,使癌细胞之间保持密切接触,不易脱离原发癌灶而发生远处转移[21]。此外,癌细胞可与血管内皮细胞黏附,使内皮基底膜充分暴露,进而促使更多癌细胞与基底膜黏附[22]。蛋白激酶在这一过程中发挥重要作用,如CDK1能够通过调节细胞周期使细胞黏着斑发生变化,进而促进细胞发生远处转移[23]。蛋白激酶与细胞迁移也密切相关,如Yang等[24]研究发现NPM1能够促进白血病细胞侵袭迁移。本研究功能分析结果显示,喉癌预后相关蛋白激酶主要参与细胞黏附及细胞迁移正性调控等细胞生物学行为,提示喉癌预后相关蛋白激酶可能通过调控细胞黏附及迁移能力影响喉癌患者的预后。
目前,TNM分期是临床上预测喉癌患者预后最主要的方法,但仍存在较大预测差异[25]。本研究基于预后相关蛋白激酶,利用LASSO回归等方法建立了喉癌预后预测模型,其ROC曲线在确诊后3年的预后预测能力持续升高,在第3年的预后预测AUC超过0.8,提示这一模型具有很强的预后预测特异度和敏感度,未来可为喉癌的临床诊疗及预后预测提供新的切入点。
