拟南芥SWEET1/2/3基因突变体构建及功能鉴定
2020-03-13辛红佳李鹏程滕守振李圣彦汪海郎志宏
辛红佳, 李鹏程, 滕守振, 李圣彦, 汪海, 郎志宏
(中国农业科学院生物技术研究所, 北京 100081)
植物SWEET蛋白通过细胞内和细胞间的糖运输来参与植物的不同生理过程,包括源库糖运输、花蜜分泌、种子发育、病原体营养、植物衰老和光合作用等[1-7]。SWEET蛋白由7个跨膜α-螺旋组成,其中,3个相邻跨膜α-螺旋组成一个TM(transmembrane domain),即SWEET蛋白由两个TMs和跨膜螺旋组成,其结构类似于3-1-3形式,位于中间的α-螺旋主要起连接两个TMs的作用[8]。基于断裂泛素重组(split-ubiquitin)的酵母双杂交分析表明,7-TM SWEETs需要寡聚化来形成足够大的孔满足蔗糖分子通过,这表明同源二聚化对于SWEETs的功能是必需的[9]。
在拟南芥中有17个SWEET基因,通过系统发育分析将这些成员分为四个进化枝(Clade)[10],其中SWEET1~SWEET3属于进化枝Ⅰ(CladeⅠ),SWEET4~SWEET8属于进化枝Ⅱ(Clade Ⅱ),SWEET9~SWEET15属于进化枝Ⅲ(Clade Ⅲ),SWEET16~SWEET17属于进化枝Ⅳ(Clade Ⅳ)。尽管每个进化枝的成员都具有相似的底物偏好,例如,进化枝Ⅰ和Ⅱ的成员更偏好己糖,而进化枝Ⅲ SWEET蛋白在运输蔗糖中起着重要作用,但是,一个进化枝中的SWEET通常具有不同的生物学功能。拟南芥SWEET1是一种对pH不敏感的葡萄糖单向转运蛋白,定位于质膜上,并在花中高表达,其可能为配子体、蜜腺或生长中的花粉管提供营养[11-12]。SWEET2转运葡萄糖通过液泡膜,并在拟南芥根中高表达,它可以限制根中的碳固定和阻止病原菌的侵染[10]。目前尚不清楚SWEET3的生理功能。
在拟南芥中,通常使用T-DNA插入突变体对SWEET基因进行遗传分析,这种方式有时无法产生真正意义上的基因敲除突变体。为了解决这个问题,本研究通过CRISPR/Cas9基因组编辑技术,分别获得了sweet1、sweet1/2、sweet3、sweet1/2/3敲除突变体。通过表型观察发现,各种突变体的角果长度明显短于野生型(wild type, WT),但突变体之间的差异并不明显,表明SWEET1/2/3之间存在遗传/生化相互作用。并且,这些突变体对6%的葡萄糖敏感,但对果糖不敏感。进一步研究发现,参与葡萄糖信号通路的重要基因HXK1、KIN10和KIN11的表达水平在不同的突变体和野生型中没有明显的变化。实验分析表明,SWEET1/2/3对果实的形成起重要的作用,利用基因编辑技术研究家族基因功能是一种有效的手段。
1 材料和方法
1.1 植物材料和生长条件
使用拟南芥哥伦比亚生态型Col-0(由本实验室保存)创建突变体,生长环境为22 ℃,16 h光照/8 h黑暗,光照强度12 000 lx,空气湿度40%~60%。拟南芥hxk1突变体购自ABRC(https://abrc.osu.edu/)拟南芥种质资源库。
1.2 不同物种SWEET基因的系统发生分析
所有SWEET蛋白序列均从NCBI(www.ncbi.nlm.nih.gov)或UniProt数据库(http://www.uniprot.org/)下载。Clustal W使用默认参数进行多序列比对[13]。系统发育分析使用MEGA 7.0软件,采用邻接法,bootstrap设定为1 000。使用Vector NTI advance 11.5软件计算氨基酸序列相似性。
1.3 拟南芥SWEET基因家族CladeⅠ基因表达分析
从拟南芥eFP浏览器(http://bar.utoronto.ca/efp/cgi-bin/efpWeb.cgi)下载了SWEET1(At1g21460)、SWEET2(At3g14770)、SWEET3(At5g53190)、HXK1(At4g29130)、KIN10(At3g01090)、KIN11(At3g29160)的表达数据[14],使用R(3.5.1版)软件包的heatmap绘制热图。
1.4 质粒构建
参照Shan等[15]方法,利用CRISPR/Cas9系统构建用于敲除SWEET1、SWEET2、SWEET3基因的质粒载体:ATCRI A和ATCRI B分别靶向SWEET1第3外显子和第4外显子保守区内的一个位点,ATCRI C靶向SWEET1的第3个外显子和SWEET2的第1个外显子,ATCRI D靶向SWEET1第4个外显子和SWEET3第4个外显子。使用聚合酶链反应(PCR)克隆AtU6启动子和gRNA,通过重叠PCR(overlap PCR)的方法将它们融合在一起[16],载体构建所用引物见表1。

表1 用于构建拟南芥转化载体的引物
1.5 农杆菌介导的拟南芥转化
采用浸花法侵染拟南芥,以获得转基因植物。在此步骤之前,将ATCRI A、ATCRI B、ATCRI C和ATCRI D分别转化到根癌农杆菌GV3101中。拟南芥抽薹后准备侵染,根癌农杆菌生长过夜至OD6001.0~2.0,8 000 r·min-1离心8 min,将沉淀重悬于侵染培养基(1×MS盐、5%蔗糖、pH 5.7、1 mol·L-1KOH)至OD6000.5左右,添加200 μL·L-1Silwet L-77(GE 公司,美国),充分混合。然后将花浸泡在上述溶液中10 min,避光处理12 h,4周后收获种子。
1.6 突变体的鉴定
当转化幼苗开始长出第一对真叶时,通过喷洒0.1% Basta进行筛选,阳性植株可以正常生长,这样就得到了T0代植物。通常CRISPR/Cas9系统可以诱导靶序列中产生小片段的插入或缺失突变。采用PCR检测和测序鉴定CRISPR诱导的T1代植物的突变情况。通过CTAB方法提取拟南芥的叶片基因组DNA,并使用基因分型引物ABCD-SW1-LF/LR、C-SW2-LFnew/LR和D-SW3-LF/LR(表2)扩增包含sgRNA靶标序列,PCR反应条件为94 ℃ 20 s,54 ℃ 30 s,72 ℃ 30 s,30个循环。对扩增片段进行测序并与Col-0序列比对,选择符合要求的突变体。

表2 用于鉴定突变体的引物
将sweet1/2与sweet3杂交得到sweet1/2/3,即获得三个位点的突变体,靶向SWEET1第3外显子,SWEET2第1个外显子和SWEET3第4外显子。通过PCR扩增和测序选择纯合的sweet1/2/3突变体。
1.7 拟南芥突变体角果长度测定实验
在种植之前,将T3代种子浸入水中,并在4 ℃下春化3 d。拟南芥生长2个月后,取23~28 cm高度的拟南芥角果并拍照,然后使用Image J测量拟南芥突变体和野生型角果的长度,使用SAS统计分析系统(第9.2版)进行差异分析。
1.8 转基因拟南芥在不同糖浓度平板上生长实验
由于SWEET为糖转运蛋白,所以在葡萄糖和果糖浓度分别为5%、6%、7%,蔗糖浓度为3%的1/2 MS固体培养基上培养Col-0、sweet1、sweet1/2、sweet3和sweet1/2/3,以鉴定高浓度的糖是否对突变体的生长产生影响。将种子种植于上述平板,4 ℃下春化3 d,垂直放置于培养架上培养。
1.9 突变体中不同糖转运相关基因表达分析
拟南芥在土壤中生长30 d,或在3%蔗糖和6%葡萄糖培养基中生长20 d,分别收取叶片或幼苗保存于-80 ℃。KIN10、KIN11、HXK1基因表达分析设计三个生物学重复,每个重复包括20个小植株,TRIzol方法提取总RNA(Transgen Code#ET111-01),用无RNase的DNase处理RNA,然后使用RevertAid First Strand cDNA Synthesis Kit(Thermo Scientific,美国)进行逆转录,使用ABI PRISM 7500仪器(Applied Biosystems)和ChamQ Universal SYBR qPCR Master Mix(Vazyme,Q711-02)进行实时定量PCR。反应体积为20 μL,其中含10 μL SYBR qPCR Master Mix,0.8 μL 10 mmol·L-1引物,6.2 μL dH2O和3 μL cDNA模板(RT反应的10:1稀释液)。使用2-ΔΔCt[17]方法计算了三个生物学重复中的基因表达水平。
1.10 拟南芥叶片总蛋白提取和蛋白质印迹
将500 mg拟南芥组织在液氮中研磨成粉末,转移至离心管中,加入500 μL SDS蛋白提取液,涡旋并在95 ℃混合5 min,离心取上清液。蛋白质通过SDS-PAGE分离并转移到PVDF膜上进行免疫分析。HXK1、KIN10和KIN11抗体购自PhytoAB(USA),抗体使用比例为1∶2 000,使用辣根过氧化物酶标记的二抗(PhytoAB,USA)以及eECL-A和eECL-B显色底物(购自康为试剂)观察目的蛋白。
2 结果与分析
2.1 不同植物SWEET基因家族系统发育分析和基因表达分析
为了探究SWEET基因家族在植物中的进化关系,从UniProt(http://www.uniprot.org/)下载了拟南芥、水稻、玉米和衣藻的蛋白序列进行多序列比对,构建系统发育树,SWEET基因家族分为五个进化枝(图1)。在拟南芥中,SWEET的CladeⅠ子家族包含三个成员:SWEET1、SWEET2和SWEET3。
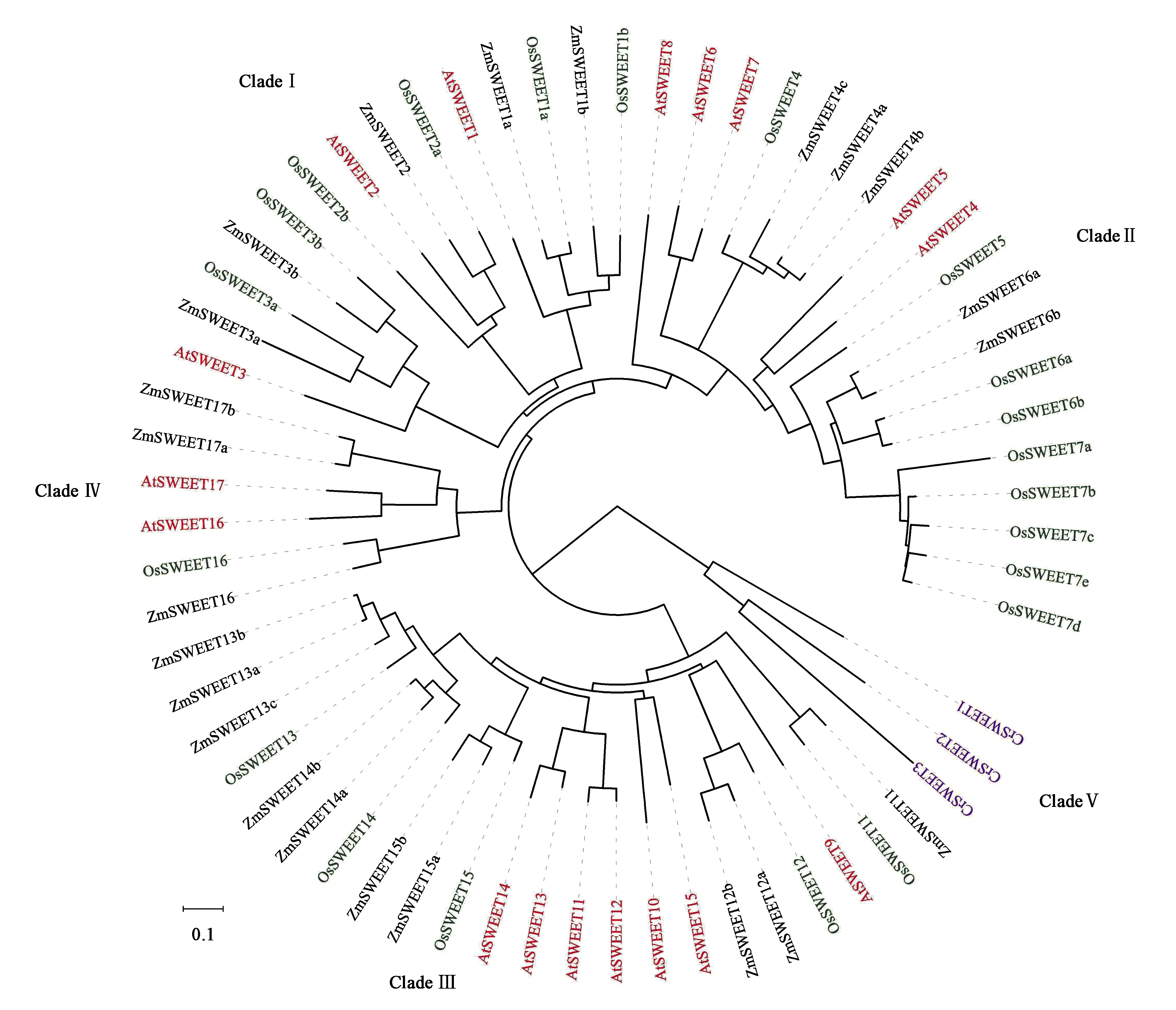
注:各物种的基因用不同颜色表示,拟南芥(红色)、水稻(绿色)、玉米(黑色)、衣藻(紫色),17个AtSWEET分为4个进化枝(Clade),拟南芥只有SWEET1/2/3属于Clade Ⅰ。
为了分析SWEET1、SWEET2和SWEET3的表达模式,从拟南芥eFP网站(http://bar.utoronto.ca/efp/cgi-bin/efpWeb.cgi)下载了三个基因的表达数据[14],使用R(3.5.1版)程序包绘制热图。将葡萄糖信号通路中的关键基因KIN10、KIN11和HXK1的表达数据进行了下载和同步分析。结果显示,SWEET1在花器官发生和发育中优先表达,SWEET2在营养和生殖器官中都有表达,而SWEET3仅在花期表达;HXK1、KIN10和KIN11基因在拟南芥的整个生长发育期均有表达,HXK1基因在花发育时期表达水平更高(图2)。

注:蓝色表示表达量低;红色表示高表量高。
2.2 转基因拟南芥的检测及获得
为了研究拟南芥SWEET基因家族CladeⅠ基因的生物学功能,利用CRISPR/Cas9系统构建了ATCRI A、ATCRI B、ATCRI C、ATCRI D四个敲除载体,如图3所示。

注:在ATCRI A和ATCRI B中设计的sgRNA序列分别靶向同源的SWEET1外显子3和外显子4保守区内的位点,ATCRI C靶向SWEET1外显子3和SWEET2外显子1,ATCRI D靶向SWEET1外显子4和SWEET3外显子4。
浸花法转化获得了转基因拟南芥,通过PCR检测和Sanger测序在靶位点检测SWEET1、SWEET2和SWEET3基因突变情况:SWEET1基因靶位点缺失了一个碱基G,使SWEET1蛋白在第69位氨基酸处翻译提前终止,导致基因功能丧失;SWEET2基因在第56位核苷酸增加一个碱基T,移码造成翻译提前终止;SWEET3基因在380位缺失一个碱基G,在390位出现了终止密码子,翻译提前终止,基因功能丧失,获得了sweet1、sweet1/2和sweet3突变体。此外,将sweet1/2与sweet3杂交并自交获得了三个位点突变的纯合突变体sweet1/2/3。
2.3 拟南芥突变体角果长度分析
将上述CRISPR/Cas9产生的敲除突变体用于进一步的表型分析。与三个SWEET基因在生殖生长阶段的优先表达相吻合,sweet1、sweet1/2和sweet3突变体在营养生长阶段没有表现出明显的表型(图4)。然而,研究发现在生殖生长阶段突变体角果的长度明显比野生型的短(图5)。SWEET1/2/3基因突变仅影响角果的长度,不影响结实和种子的繁殖力。三突变体sweet1/2/3的果实长度与单突变体或双突变体相比较短,但是没有统计学上的差异,说明SWEET1、SWEET2和SWEET3基因在相同的遗传/生化途径中起作用。这些结果表明,CladeⅠSWEET基因是角果长度的正调控因子。

图4 营养生长阶段纯合突变体的表型

注:A:角果(标尺为1 cm);B:角果长度显著性分析。在t检验中,***、**、*分别表示P <0.001、P <0.01、P <0.05水平具有统计学意义(n=21)。
2.4 拟南芥突变体对葡萄糖敏感性分析
为了解由SWEET基因家族调控的糖信号通路,在含有3%蔗糖、6%葡萄糖和6%果糖的1/2 MS培养基上培养sweet1、sweet1/2、sweet3和sweet1/2/3纯合突变体和Col-0,一个月后生长状态如图6所示,虽然在3%蔗糖和6%果糖下未观察到表型差异,但在6%葡萄糖的培养基中,与Col-0相比,sweet1、sweet1/2和sweet1/2/3突变体幼苗的生长速率和总生物量显著降低,表现为叶小、早衰和根长较短,但sweet3突变体没有表现出更敏感。与长角型表型一致,双突变体sweet1/2和三突变体sweet1/2/3的葡萄糖敏感性表型与单突变体相似,这表明sweet1和sweet2基因在相同的遗传/生化途径中起作用,具有协同作用,但没有叠加功能。与sweet1突变体对6%葡萄糖的敏感性相比,sweet1/2和sweet1/2/3突变体没有表现出更敏感的表型,说明sweet1可能在葡萄糖信号传导中起着更重要的作用。

图6 突变体sweet1、sweet1/2、sweet3、sweet1/2/3在幼苗期表型
2.5 葡萄糖信号关键基因的表达分析
为了进一步了解突变体中糖信号调节机制,我们比较了突变体和野生型三种主要糖信号通路基因己糖激酶1基因HXK1、葡萄糖传感器和葡萄糖能量传感器激酶基因KIN10和KIN11的表达水平。在补充有3%蔗糖的1/2 MS培养基上,HXK1、KIN10、KIN11基因的转录表达水平在所有突变体和WT植物之间没有显著差异(图7)。与野生型相比,仅在6%葡萄糖培养基上,sweet1/2和sweet3突变体的HXK1转录水平略低。蛋白质印迹法结果显示HXK1、KIN10、KIN11基因在突变体和野生型中正常表达,尽管其表达水平略有不同(图8),但CladeⅠSWEET基因的敲除并没有严重影响葡萄糖信号通路中的基因的表达。因此,作为糖转运蛋白,CladeⅠSWEET基因有助于糖的装载和转运,但对葡萄糖信号基因没有调节作用。

注:在t检验中,***、**、*分别表示P<0.001、P<0.01、P<0.05水平具有统计学意义(n=21)。

图8 不同突变体中HXK1、KIN10和KIN11蛋白Western分析
3 讨论
拟南芥SWEET1/2/3基因的研究较多,但生物学功能尚不明确,CRISPR/Cas9技术可以打破以往由于T-DNA插入UTR或内含子区域而无法产生真正意义上的功能丧失突变体的限制,利用多基因突变体研究基因功能。本研究构建了四个载体,分别为ATCRI A、ATCRI B、ATCRI C和ATCRI D,载体中的5′-NGG PAM(protospacer adjacent motif)之前是20 nt的引导序列,这对于CRISPR/Cas9系统与靶DNA的结合特别重要,脱靶将影响敲除效率。BLAST搜索(http://blast.ncbi.nlm.nih.gov/)可确保5′-N(20)-NGG-3′或5′-CCN-N(20)-3′是唯一的。四个载体同时转化农杆菌,但是没有获得由ATCRI B和ATCRI D 载体的靶向位点针对SWEET1的第4外显子的突变体,可能是染色质结构和靶区域的修饰影响了CRISPR/Cas9系统的靶向突变。最后得到了sweet1、sweet1/2、sweet3和sweet1/2/3突变体,并作进一步研究。
SWEETs已在动物、植物和细菌中得到鉴定,它们在整个生物界的糖转运中起着重要作用。本课题组克隆并鉴定了玉米CladeⅠSWEET基因,命名为CST1,该基因定位于副卫细胞膜中,并促进气孔导度和光合作用。CST1编码葡萄糖转运蛋白,cst1突变体叶片的气孔开放减少,并且具有碳饥饿和早衰的表型[5]。玉米CST1基因和拟南芥SWEET1/2/3在系统发生树上都位于CladeⅠ,但它们没有相同的生理功能和时空表达模式。sweet1、sweet1/2和sweet1/2/3突变体表现出角果长度变短,在整个生长阶段看不到叶片衰老的表型,进一步说明SWEETs基因在不同物种通过基因复制产生了新的生物学功能[5]。
糖作为碳源,为植物的生长和发育提供能量。拟南芥中有三个主要的葡萄糖信号调节因子:葡萄糖传感器己糖激酶HXK1、葡萄糖能量传感器激酶KIN10 和KIN11[18]。HXK1作为第一个葡萄糖传感器,在信号传导、调节各种基因表达和促进植物生长方面起着主要控制作用,但这些功能与其代谢功能无关[19]。Hexokinase-like 1-1(hkl1-1)突变体和葡萄糖不敏感2-1(gin2-1)突变体在6%葡萄糖中表现出不同的表型,hkl1-1和WT敏感,gin2-1不敏感,因此意味着它们参与了不同的葡萄糖信号通路[20]。在幼苗的早期发育过程中,糖信号传导与胁迫、防御激素信号传导途径相互作用,例如gin1被确定为ABA途径中aba2的等位基因,gin4是乙烯途径中ctr1的新等位基因。gin1和ctr1突变体幼苗均对高浓度葡萄糖不敏感[21],但是突变体sweet1、sweet1/2和sweet1/2/3均对6%葡萄糖敏感,这意味着拟南芥中sweet1/2/3基因存在于不同的葡萄糖信号通路。在sweet1、sweet1/2、sweet1/2/3和野生型中,HXK1、KIN10、KIN11基因的表达相似,表明CladeⅠSWEET基因参与了与HXK1、KIN10、KIN11不同的信号通路或为其下游基因调控的葡萄糖信号转导。对于两个表型,短角果和对葡萄糖的敏感性,没有发现这三个基因的功能叠加作用。
拟南芥CladeⅠSWEET基因参与种子发育和影响角果的长度。利用CRISPR/Cas9技术创建的一系列突变体,是深入研究拟南芥CladeⅠSWEET基因的葡萄糖信号转导的生理功能和分子机制的理想材料。
