SnO2/GDE阴极的制备及电催化还原CO2产甲酸性能
2020-03-12卓孟宁陈倩文王立章
卓孟宁,李 飞,蒋 浩,陈倩文,李 鹏,王立章
(1. 中国矿业大学环境与测绘学院,徐州 221116; 2. 苏州市宏宇环境科技股份有限公司,苏州 215000;3. 东华理工大学水资源与环境工程学院,南昌 330013)
电催化还原CO2因具有反应条件温和、产物可控等优势而成为近年来CO2资源化利用的重要手段[1,2]. 电催化还原CO2可产生多种有价值的产物,其中甲酸作为重要的工业化工原料被广泛研究[3~5]. 目前用于电催化还原CO2产甲酸的催化剂主要有Hg,Pb,In和Sn[6,7],其中Sn作为电催化还原CO2产甲酸的高效催化剂备受青睐[8~11],研究发现,Sn对甲酸的高选择性主要源于其表面氧化层SnO2,尤其当SnO2处于纳米形态时其还原CO2产甲酸潜力最大[12,13]. 制备SnO2纳米粉体的常用方法有液相沉淀法、微乳液法、化学气相沉积法和水热合成法[14~16]. 相比其它合成方法,水热合成法所合成的粉体结晶度高,晶态完整且形貌易于控制[17]. 但SnO2催化剂通常在160 ℃以上的高温条件下制备[18,19],存在操作复杂且能耗高等缺陷,因此研究在低温条件下制备SnO2催化剂具有重要价值.
本文采用低温水热合成法制备了SnO2气体扩散电极(SnO2/GDE),利用扫描电子显微镜(SEM)、X射线衍射(XRD)、X射线光电子能谱(XPS)、循环伏安(CV)、线性扫描伏安(LSV)和电化学交流阻抗(EIS)等手段研究了电极的物化性质,并利用制备的SnO2/GDE进行CO2还原实验,考察了所制备SnO2的催化性能.
1 实验部分
1.1 试剂与仪器
SnCl2(分析纯)、KHCO3(分析纯)、乙醇(质量分数75%)、Na2SO4(分析纯)和NaOH(分析纯)均购于国药集团化学试剂有限公司; Nafion溶液(质量分数5%)和Nafion117质子交换膜购于美国杜邦公司; N2和CO2(纯度99.99%)购于徐州路友有限公司; 碳纸(TGP-060)购于日本东丽公司.
CS310型电化学工作站(武汉科思特仪器有限公司); Quanta400FEG型扫描电子显微镜(美国FEI公司); D8 Advance型X射线衍射仪(德国Bruker公司,2θ=10°~80°,扫描速率1.20°/min); ESCALAB型X射线光电子能谱仪(美国赛默飞公司,激发光源为A1Kα); ICS 900型离子色谱仪(美国戴安公司).
1.2 电极的制备
取0.02 mol/L SnCl2和0.1 mol/L NaOH各100 mL置于烧杯中,室温下持续搅拌30 min,形成均匀的悬浮液(前驱体); 将前驱体转移至内衬为聚四氟乙烯的反应釜中,分别在60,75,100 ℃下反应10 h后,依次用乙醇和去离子水清洗3次,然后置于干燥箱中在50 ℃下干燥8 h,即得到纳米SnO2,并标记为SnO2-T,其中T代表合成温度. SnO2-T/GDE电极由碳纸和纳米SnO2-T催化层组成,首先将纳米SnO2-T和Nafion溶液超声混合30 min形成催化剂浆液,然后多次喷涂于清洗后的碳纸(2 cm×2 cm)上,依次用乙醇和去离子水超声清洗2次后,在40 ℃下烘干,直至催化剂负载量为5 mg/cm2,即制得SnO2-T/GDE电极.
1.3 电化学测试
采用三电极体系在CS310电化学工作站上对电极进行CV,LSV和EIS测试,分别以Pt片为对电极,饱和甘汞电极(SCE)为参比电极,SnO2-T/GDE为工作电极. 在进行电化学测试前,向0.1 mol/L KHCO3溶液中分别通入N2和CO230 min,以使其在溶液中达到饱和[20,21]. CV测试电势范围-0.3~-1.8 V(vs. SCE),扫描速率分别设定为30,50,80,100,120 mV/s; LSV测试电势范围0~-1.8 V(vs. SCE),扫描速率为50 mV/s; EIS测试条件: 偏压-1.5 V(vs. SCE),频率范围1.0 Hz~10 MHz,振幅10 mV.
1.4 电催化学还原CO2实验
采用三电极体系在CS310电化学工作站上进行恒电位电解实验,阴极室和阳极室以Nafion 117质子交换膜隔开. 以55 mL 0.1 mol/L CO2饱和的KHCO3溶液为阴极电解液,在电解过程中以100 mL/min的流速持续通入CO2; 阳极液为0.3 mol/L Na2SO4溶液,电解可设置为基于电量或时间停止,电解结束后,电解液中的产物采用ICS900离子色谱仪进行分析,仪器使用IonPac AS 11-HC阴离子分析柱以及IonPac AS 11-HC阴离子保护柱,配置有ASRS 300电化学自动再生阴离子抑制器,流动相为NaCO3(4.5 mmol/L)和NaHCO3(0.8 mmol/L)的混合液,流速为1 mL/min,以H2SO4(20 mmol/L)溶液作为再生液.
法拉第效率(FE,%)计算公式[22]如下:
FE=zn×(F/Q)×100%
(1)
式中:n(mol)为产甲酸的摩尔数;z(z=2)为CO2电还原产甲酸的电子转移数;F为法拉第常数(F=96485 C/mol);Q(C)为电荷量.
通过下式计算产甲酸电流密度(I,mA/cm2):

(2)
式中:t(h)为电解时间;S(cm2)为电极面积.
甲酸产率(V,μmol·h-1·cm-2)计算公式如下:
V=(n×106)/tS
(3)
2 结果与讨论
2.1 形貌、结构与组成分析
图1示出了60,75和100 ℃下制备的 SnO2-T/GDE电极的表面形貌. 由图1可以看出,SnO2-T/GDE电极表面负载的催化剂分散性较好,其形貌与高温下采用水热合成法制备的电极相似[21,23].
当合成温度为60 ℃时,电极表面团聚物呈大块球状[图1(A)]; 合成温度为75 ℃时,电极表面颗粒呈分散良好的完整球状[图1(B)]; 温度升高至100 ℃时,电极表面颗粒呈不规则且分散性较差的堆积状态[图1(C)]. 有研究表明,分散良好的纳米球具有较大的比表面积,将有助于催化剂与电解质溶液充分接触,并促进电还原反应的进行[20,24]

Fig.1 SEM images of SnO2-60/GDE(A), SnO2-75/GDE(B) and SnO2-100/GDE(C)

Fig.2 XRD patterns of SnO2-T/GDE

Fig.3 XPS survey(A,C,E) and high resolution spectra of Sn3d(B,D,F) of SnO2-T/GDE(A),(B) SnO2-60/GDE; (C),(D) SnO2-75/GDE; (E),(F) SnO2-100/GDE.
由图2所示的XRD谱图可见,3个温度下制备的SnO2均在26.6°,33.89°,37.91°,51.8°,54.8°,61.86°,65.99°和78.6°处出现衍射峰,依次对应四方相结构SnO2(PDF No.72-1147)的(110),(101),(200),(211),(220),(310),(310)和(321)晶面. 结果表明,在低温下采用水热合成法可合成出SnO2晶体. 由Scherrer公式计算垂直于(110)晶面的平均晶粒尺寸(D,nm)[25]:
D=Kλ/(Bcosθ)
(4)
式中:K为Scherrer常数(取值为0.89);B为衍射峰半高宽度;θ为衍射角;λ为X射线波长. 求得SnO2-60,SnO2-75和SnO2-100的平均晶粒尺寸分别为7.9,11.8和12.9 nm. 随着温度的升高,各个衍射峰的强度逐渐增强,SnO2粉体的结晶度逐渐提高[20,26,27],粒径逐渐变大.
所制备SnO2-T/GDE电极的XPS谱图见图3. 从宽谱图[图3(A),(C)和(E)]可知,SnO2-T/GDE电极均只有Sn,O,C的特征峰,其中碳元素来源于SnO2-T/GDE电极的碳纸基底. 图3(B),(D)和(F)给出的高分辨XPS谱图在494.9和486.7 eV附近均出现了两个特征峰,分别归属于Sn3d5/2和Sn3d3/2[28],进一步说明Sn以+4价态存在且与O原子结合为SnO2. XRD和XPS结果均证实在60,75,100 ℃下制备的催化剂均为纯度良好的纳米级SnO2.
2.2 电化学分析
图4给出了SnO2-T/GDE在饱和N2和CO2环境下电流密度随电势的变化趋势. 在起始电势之后,SnO2-60/GDE和SnO2-100/GDE电极在N2环境下的还原峰电流与CO2环境下的还原峰电流基本持平且电流数值很小,并且图4(A)和(C)中没有出现明显的CO2还原峰,说明SnO2-60/GDE和SnO2-100/GDE电催化还原CO2的反馈电流小,催化活性较弱,并且不能抑制析氢[29]; 由图4(B)可见CO2还原峰,并且在起始电势之后,SnO2-75/GDE电极在CO2环境下的还原峰电流密度要高于N2环境下的电流密度,这说明在CO2环境下发生了CO2还原反应,并在一定程度下抑制了析氢反应. 由图4(D)可知,在相同的CO2氛围下,SnO2-75/GDE电极所获得的电流密度最大,说明其催化活性最强.
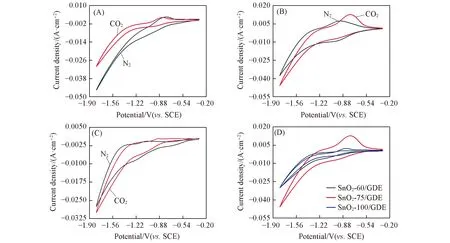
Fig.4 Cyclic voltammetric scan of SnO2-T/GDE in N2 and CO2 environmentsScanning rate: 50 mV/s; potential window: -0.3—1.8 V(vs. SCE); electrolyte: 0.1 mol/L KHCO3 solution. (A) SnO2-60/GDE; (B) SnO2-75/GDE; (C) SnO2-100/GDE; (D) SnO2-T/GDE in the CO2 environment.

Fig.5 Linear sweep voltammetry of SnO2-T/GDE in N2 and CO2 environmentsScanning rate: 50 mV/s; Potential window: -0.3—1.8 V vs. SCE; electrolyte: 0.1 mol/L KHCO3 solution. (A) SnO2-60/GDE; (B) SnO2-75/GDE; (C) SnO2-100/GDE; (D) SnO2-T/GDE in the CO2 environment.
LSV测试结果(图5)表明,SnO2-60/GDE电极在N2和CO2环境下的反应电流密度相似,而SnO2-75/GDE和SnO2-100/GDE电极在CO2环境下的电流密度明显高于N2环境下的结果,并且 SnO2-75/GDE电极在两种环境下电流密差距最大,说明SnO2-75/GDE电极在CO2环境下发生了CO2还原反应,并且反应电流密度远高于其它两个电极,证明SnO2-75/GDE电极具有优异的电催化性能,这与CV测试结论一致. 通过测试SnO2-T/GDE在饱和N2环境下于0.1 mol/L KHCO3溶液中不同扫描速率(30,50,80,100,120 mV/s)下的CV曲线计算电极材料相应的电化学活性表面积(ECSA,cm2)[30~32]:
ECSA=RfS
(5)
式中:S为光滑金属电极的面积,测试用Cu箔与碳纸尺寸一致,均为4 cm2;Rf为粗糙度因子,其值等于电极双电层电容(Cdl)和光滑电极的双电层电容(理论值20 μF/cm2)比,即Rf=Cdl/20. 通过微电容法计算Cdl,本文选定在-0.4 V(vs. SCE)电位条件下的电流密度差与扫描速率建立线性关系获得Cdl,结果如图6所示.
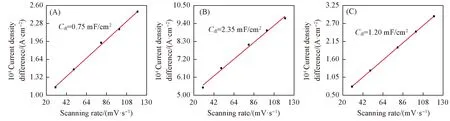
Fig.6 Linear relationship between current density difference and scan rate of SnO2-T/GDE at -0.4 V(vs. SCE) Potential window: -0.3—-0.5 V(vs. SCE); electrolyte: N2 satarated 0.1 mol/L KHCO3 solution. (A) SnO2-60/GDE; (B) SnO2-75/GDE; (C) SnO2-100/GDE.
SnO2-60/GDE,SnO2-75/GDE,SnO2-100/GDE的Cdl分别为0.75,2.35,1.20 mF/cm2,其ECSA分别为150,470,240 cm2,其中 SnO2-75/GDE电极的ECSA最大,催化活性位点最多,SnO2-100/GDE电极次之,SnO2-60/GDE电极的最少. CV及LSV测试分析得出的结果同样反映了这一趋势.
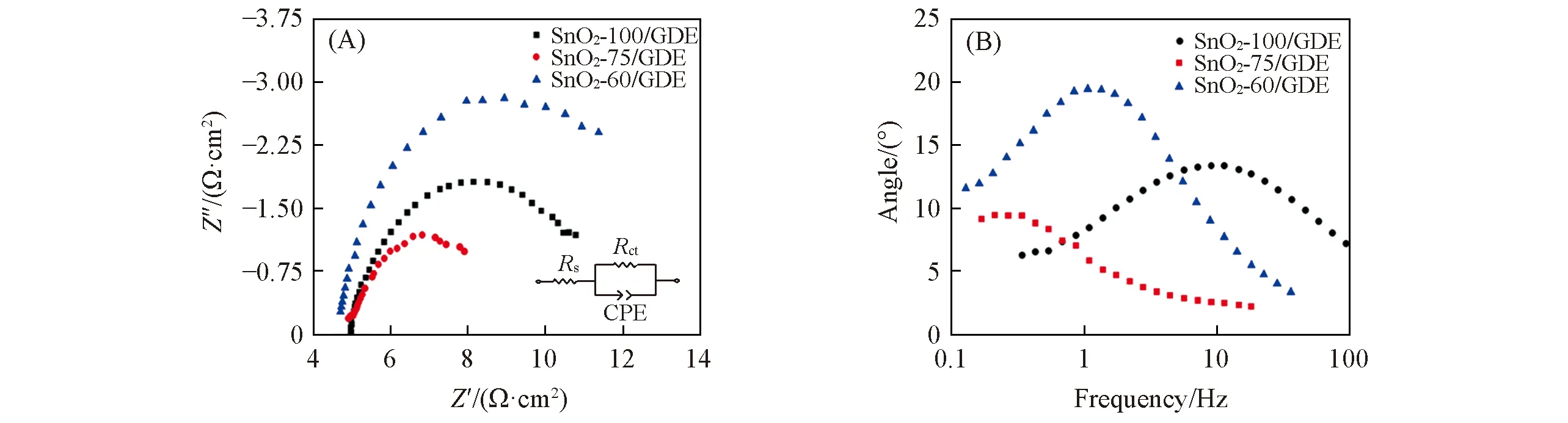
Fig.7 Nyquist plots(A) and bode plots(B) of SnO2-T/GDE in 0.1 mol/L KHCO3solution with saturated CO2 at -1.5 V(vs. SCE)
由EIS测试结果[图7(A)]可见,SnO2-T/GDE对应的Nyquist 图均呈半圆形,且具有不同的半径,说明SnO2-T/GDE的反应电阻不同; 而由Bode图[图7(B)]可知,SnO2-T/GDE电极均只存在一个时间常数,即只发生了一个电子转移过程. 采用Rs(RctQ)等效电路拟合EIS数据[见图7(A)内插图. 其中,Rs和Rct分别代表溶液和电极表面电子转移电阻,CPE为常相位角],拟合结果如表1所示,其中,Rct是反应体系电阻的关键,SnO2-60/GDE电极的Rct最大,SnO2-100/GDE电极次之,而SnO2-75/GDE电极最小,表明在SnO2-75/GDE电极表面的电子转移速率最快,即电催化还原CO2反应的速率最快,这与上述CV,LSV及ECSA的分析结果一致.

Table 1 EIS equivalent circuit fitting of SnO2-T/GDE under -1.5 V(vs. SCE)
2.3 产甲酸效能分析
在CO2饱和的0.1 mol/L KHCO3溶液中,向SnO2-T/GDE电极上施加-1.8 V(vs. SCE)的电势进行电解实验,结果见图8. 当通入的电量为500 C时,SnO2-T/GDE(T=60,75,100)电极的产甲酸法拉第效率依次为46.5%,93.5%,62.1%,产甲酸的电流密度依次为11.4,22.8,12.8 mA/cm2,产甲酸的速率依次为212.8,424.6,239.6 μmol/h,其中SnO2-75/GDE电极产甲酸的法拉第效率最高,并且产甲酸的电流密度和甲酸产率均是其它两个电极的1.6倍以上. 文献报道的水热合成法制得的催化剂在相近电解条件下得出的产甲酸效能与本文结果的对比见表2,本文方法更加简易高效,成本低廉并且安全系数高.

Fig.8 Faradic efficiency(A),current density(B) and production yield(C) of formic acid in CO2 saturared 0.1 mol/L KHCO3 solution over SnO2-T/GDE at -1.8 V(vs. SCE)a. SnO2-60/GDE; b. SnO2-75/GDE; c. SnO2-100/GDE.

Table 2 Comparison of the electrode performances between the reported results and thiswork with SnO2 as catalyst
a. SHE refers to the standard hydrogen potential;b. the values of the electrolysis time are calculated byQ/(IS).
2.4 电极稳定性
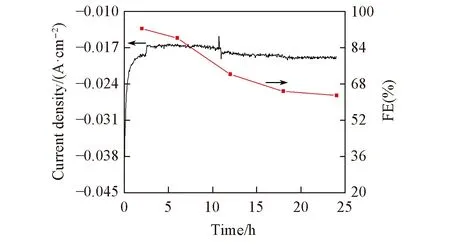
Fig.9 SnO2-75/GDE electrode reaction reduction CO2 current density and formic acid Faraday efficiency change with electrolysis time

综上所述,本文采用低温水热合成法制备了SnO2-75纳米粒子. SEM表明该催化剂为分散良好的球状,通过XRD及XPS证实了所制备的催化剂为纯度良好的SnO2; 在CV,LSV及EIS电化学测试中,SnO2-75/GDE电极表现出较高的电化学催化活性,在-1.8 V(vs. SCE)电解条件下,通入500 C电量时产甲酸电流密度为22.8 mA/cm2,产甲酸法拉第效率高达93.5%; 电极能维持6 h的长时间稳定高效电解,经过20 h电解,产甲酸电流密度维持在12.8 mA/cm2,产甲酸法拉第效率稳定在65%左右. 说明采用低温水热合成法制备的SnO2具有良好的催化性能.
