理化预处理协同MTGase交联处理对大豆7S球蛋白功能特性及结构的影响
2020-03-11范丽丽窦博鑫徐晨冉芦志凤梁佳文
范丽丽,窦博鑫,徐晨冉,芦志凤,梁佳文,刘 颖
(哈尔滨商业大学食品工程学院,黑龙江省食品科学与工程重点实验室,黑龙江哈尔滨 150076)
大豆7S球蛋白作为大豆蛋白中的主要贮藏蛋白之一,具有极高的研究价值。大豆蛋白的乳化性、持油性等与食品品质相关的多种功能特性,被广泛应用于饮料、焙烤食品、乳品等食品工业领域,有研究显示大豆7S球蛋白对大豆蛋白乳化性及其稳定性影响较大,二者呈正相关[1-2];对肉类、熏酱类产品发挥吸油性功能,大大减少了其营养价值的流失,同时对产品的外形也起到了很好的维稳作用[3-4]。但由于大豆7S球蛋白易受处理时间、pH值、温度等条件的影响,在食品加工应用中受到了很大的限制,因而有必要对大豆7S球蛋白进行改性,而单一改性方法效率低且改性效果不佳,如果组合采用2种或多种不同的改性方法,可起到同时改善蛋白质多种功能的目的[5-7]。
转谷氨酰胺酶(TGase),按来源可分为来自动物肝脏组织的TGase和微生物产生的MTGase。其中,微生物法生产的MTGase具有周期短、成本低、制得的酶制剂价格低廉等优点,在食品工业中被广泛使用,从作用机理上来说,TGase易于分离纯化,催化交联的程度高[8],能使蛋白质分子间或蛋白质分子内发生交联作用,也可以使蛋白质与氨基酸之间发生交联作用,使蛋白质的结构发生变化,从而改善蛋白质功能特性,且不会改变蛋白营养成分的含量[9]。
蛋白质主要是通过氢键、离子键、二硫键和疏水相互作用等作用力来维持其结构的稳定[10]。二硫键存在于分子内或分子间,它的作用是可以使蛋白质的折叠结构稳定[11]。Na2SO3作为一种还原剂,可以还原蛋白分子间和分子内的二硫键,使蛋白分子中的二硫键部分断裂形成游离巯基,引起蛋白质结构的改变[12]。
超声技术在超声提取、食物无损检测、超声杀菌等领域具有不可或缺作用[13-14],其原理是超声振荡作用于介质,使媒介发生周期性紧缩和扩张作用产生空穴效应,从而引起超声波效应,改善蛋白的理化特性[15-16]。
试验测定经Na2SO3预处理和超声波预处理的大豆7S球蛋白与MTGase交联后的持油性、乳化性及乳化稳定性、游离巯基含量,探究不同预处理方法协同MTGase改性大豆7S球蛋白,比较作用前后大豆7S球蛋白的功能特性是否得到改善,并对7S球蛋白功能特性的机理进行探讨[17],对复合改性大豆7S球蛋白及其在食品加工行业中的广泛应用具有重要意义。
1 材料与方法
1.1 材料与试剂
低温脱脂大豆粕,山东禹王有限公司提供;转谷氨酰胺酶(MTGase),江苏瑞欣食品生物科技有限公司提供;Na2SO3、NaHSO3、KH2PO4、K2HPO4、Na-Cl,哈尔滨市新春化工厂提供;三羟甲基胺基甲烷(Tris)、十二烷基硫酸钠(SDS)、甘氨酸、DTNB,Sigma试剂公司提供;EDTA,Amresco公司提供;大豆油,九三大豆油脂厂提供;KH2PO4、K2HPO4、Na-Cl,优级纯;其余试剂为分析纯。
1.2 仪器与设备
冷冻干燥机,锡山市林洲干燥机厂产品;高速离心机,上海市卢湘仪离心机仪器有限公司产品;722S型分光光度计,上海市精密科学仪器有限公司产品;恒温加热磁力搅拌器,北京市科伟永兴仪器有限公司产品;数显台式鼓风干燥箱,青岛海尔电器厂产品;精密pH计,上海市雷磁仪器厂产品;Malvern激光粒度仪,上海市思百吉仪器系统有限公司产品。
1.3 试验方法
1.3.1 Na2SO3预处理大豆7S球蛋白
(1) 不同质量浓度Na2SO3对大豆7S球蛋白的处理[18-19]。将 60~100 mg的 Na2SO3按照 5 mg为梯度,分别溶解到100 mL蒸馏水中,匀速搅拌至完全溶解,加入5 g大豆7S球蛋白,在温度25℃,pH值7.0的条件下连续搅拌30 min,在真空冷冻干燥的条件下得到预处理的大豆7S球蛋白样品。
(2) 不同处理时间对大豆7S球蛋白的处理。将950 mg的Na2SO3溶解到100 mL蒸馏水中,匀速搅拌至完全溶解,加入5 g大豆7S球蛋白,在温度25℃,pH值7.0的条件下分别搅拌20,30,40,50,60 min,在真空冷冻干燥的条件下得到预处理的大豆7S球蛋白样品。
1.3.2 超声波预处理大豆7S球蛋白
(1) 不同超声功率对大豆7S球蛋白的处理[20-21]。将5 g大豆7S球蛋白,溶于1 L蒸馏水中,于25℃条件下搅拌2 h,使大豆7S球蛋白完全溶解。取100 mL蛋白溶液装入250 mL烧杯中,蒸馏水稀释至1 mg/mL,然后分别在超声功率为180,210,240,270,300 W下处理20 min,在真空冷冻干燥的条件下得到预处理的大豆7S球蛋白样品。
(2) 不同超声时间对大豆7S球蛋白的处理。将5 g大豆7S球蛋白,溶于1 L蒸馏水中,于25℃条件下搅拌2 h,使大豆7S球蛋白完全溶解。取100 mL蛋白溶液装入250 mL烧杯中,蒸馏水稀释至1 mg/mL,然后在超声功率为180 W下分别处理20,40,60,80,100 min,在真空冷冻干燥的条件下得到预处理的大豆7S球蛋白样品。
1.3.3 不同预处理协同MTGase交联处理大豆7S球蛋白
取一定量经Na2SO3和超声预处理的7S样品,溶于0.02 mol/L PBS缓冲溶液,在pH值7.5的条件下加入20 μg MTGase,然后在55℃下水浴2 h,80℃下水浴灭酶5 min,将得到的样品进行冻干处理。
1.3.4 持油性的测定
参考Tomotake H等人[22]的方法,称取1.0 g大豆7S球蛋白试样(M0)置于50 mL离心管中,称量(M1),放入5 mL大豆油,漩涡振动5 min使其混合均匀,室温下静置30 min后,以转速3 000 r/min离心10 min,移除上层油层,用滤纸吸干净管壁剩余的油滴,再称量(M2)。持油性(OHC)的计算公式为:

式中:M0——7S球蛋白的质量,g;
M1——离心管的质量,g;
M2——离心管与沉淀的总质量,g。
1.3.5 乳化性及乳化稳定性的测定
配制1%(W/V) 的MTGase交联处理大豆7S球蛋白溶液,取15 mL蛋白溶液与5 mL大豆油混合,均质(10 000 r/min,2%),形成均一的乳化液。分别在0 min和30 min取20 μL的乳状液与5 mL的0.1%SDS溶液均匀混合取样点固定在离烧杯底部0.5 cm处,于波长500 nm处测定其吸光度,分别记为A0和A30,用0.1%的SDS作为空白对照[23-24]。
乳化性(EAI)、乳化稳定性(ESI)计算公式如下:
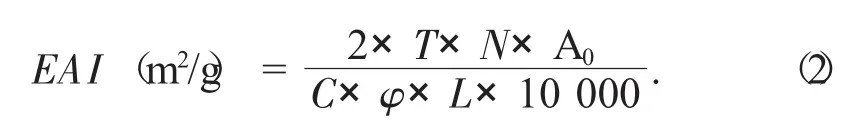
式中:T——2.303;
N——稀释倍数,250;
A0——0 min时的吸光度;
C——乳化液形成前蛋白质水溶液中蛋白质质量浓度,g/mL;
φ——乳化液中油的体积分数,0.25;
L——比色池光径,cm。
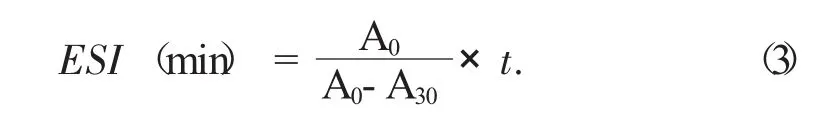
式中:A0——0 min时的吸光度;
A30——30 min时的吸光度;
t——间隔时间。
1.3.6 游离巯基的测定
游离巯基的测定主要参考Hu H等人[25]的方法稍加修改。准确吸取0.5 mL的样品溶液(质量浓度为10 mg/mL),加入2.5 mL Tris-Gly-8Murea溶液,混匀后加入0.02 mL DTNB,迅速混合,在25℃恒温条件下反应30 min,于波长412 nm处测定吸光度,同时测定空白值。每组试样至少平行测定3次,取3组数据的平均值。游离巯基(SH) 含量的计算公式:

式中:A——波长412 nm处的吸光度;
D——稀释系数6.04;
C——待测样品的最终质量浓度,mg/mL。
1.3.7 平均粒径的测定
根据李杨等人[26]的测定方法,采用Malvern激光粒度仪测定大豆7S样品溶液的平均粒径分布。将大豆7S球蛋白样品用PBS缓冲溶液进行稀释,配制成0.1%的蛋白溶液,过0.45 μm水系醋酸纤维素滤膜,在温度25℃,样品平衡时间2%的条件下进行测量。
1.4 数据处理
采用Origin 8.5软件绘图,SPSS 17.0统计分析试验数据,每组试验均重复3次,数据结果以平均值±标准偏差表示,方差分析差异性显著(p<0.05)时采用Duncan方法进行多重比较。
2 结果与分析
2.1 不同理化预处理协同MTGase对大豆7S球蛋白持油性的影响
不同理化预处理协同MTGase对大豆7S球蛋白持油性的影响见图1。
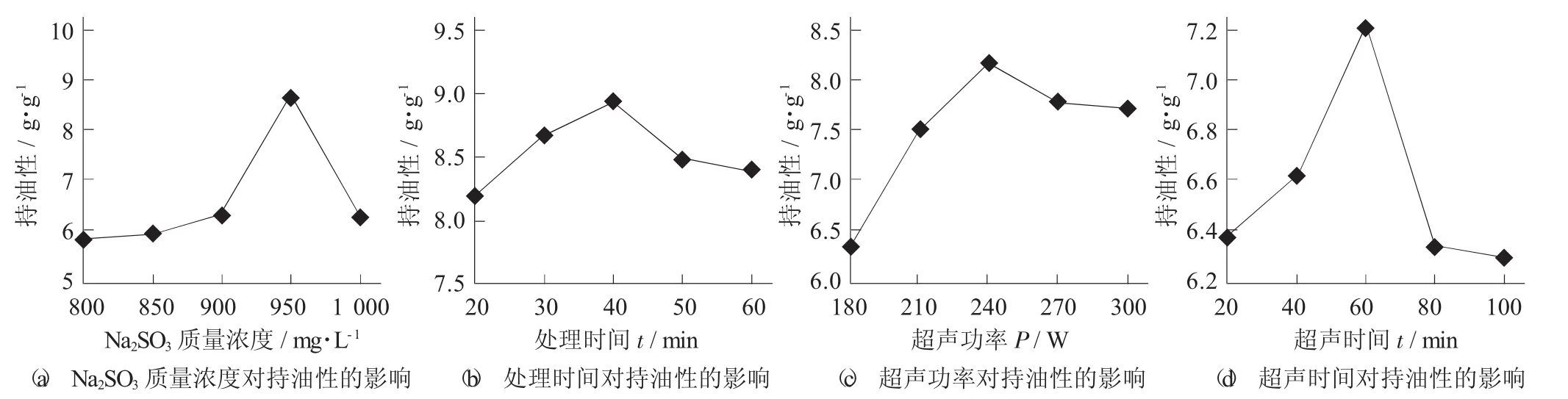
图1 不同理化预处理协同MTGase对大豆7S球蛋白持油性的影响
预试验可知,未经处理的大豆7S球蛋白持油性为3.43 g/g,经MTGase交联处理的大豆7S球蛋白持油性为6.42 g/g,经Na2SO3协同MTGase处理的大豆7S球蛋白持油性显著提高(p<0.05)。
由图1(a) 可知,当Na2SO3质量浓度为800~1 000 mg/L时,持油性呈现先增大后降低的趋势;当质量浓度为950 mg/L时,持油性达到最大,为8.70 g/g。可能是由于Na2SO3破坏了大豆7S球蛋白的二硫键,使二硫键断裂为游离巯基[12],适当质量浓度的Na2SO3处理有助于大豆7S球蛋白结构的破坏,同时在MTGase交联作用下,使持油性提高,但随着Na2SO3质量浓度的持续增加,大豆7S球蛋白的结构过度破坏,导致持油性降低。
由图1(b) 可知,随着Na2SO3处理时间的增加,大豆7S球蛋白的持油性先增大后降低,处理时间为40 min时,持油性达到最大值8.94 g/g,处理时间继续增加,持油性开始下降,这可能是由于恒温条件下,随着处理时间的增加,有利于蛋白质结构的破坏[11],在MTGase的交联作用下,增大了持油性,但随着处理时间的增加,不利于大豆7S球蛋白持油性的提高。
由图1(c) 可知,大豆7S球蛋白经超声波处理协同MTGase作用后持油性提高,180~240 W的超声作用下,持油性升高;240 W时持油性最大,最大值为8.20 g/g;240 W后持油性减小。可能是由于经超声波机械剪切力或空化作用下的蛋白质颗粒变小,组织蓬松,比表面积变大,同时也破坏蛋白质构造,拉伸分子、二硫键、疏水官能团被裸露,提高了吸附样品和联合脂质能力[27],持油性升高;随着超声功率继续增大,导致蛋白质变性过度,破坏其构造,使其变得致密,颗粒变大,含油能力逐步下降。
由图1(d) 可知,随着超声时间的增加,持油性呈先增加后减小的趋势,但整体较未进行超声波作用的对照组呈增大的趋势,在超声功率180 W,超声时间60 min时持油性达到最大值,最大值为7.2 g/g,随后超声时间增加,持油性下降,原因可能是在超声波作用下,随着超声时间的增加蛋白质因空化作用使蛋白颗粒变小,比表面积和吸附作用增强,从而使油脂含量逐渐上升,疏水性变大,持油性增加;超声时间继续增加,比表面积和较强的吸附能力作用减弱,从而使油脂含量逐渐下降,持油性下降。
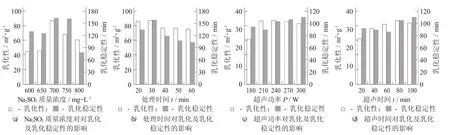
图2 不同理化预处理协同MTGase对大豆7S球蛋白乳化性及乳化稳定性的影响
2.2 不同理化预处理协同MTGase对大豆7S球蛋白乳化性及乳化稳定性的影响
不同理化预处理协同MTGase对大豆7S球蛋白乳化性及乳化稳定性的影响见图2。
未经任何处理的大豆7S球蛋白乳化性为23.99 m2/g,MTGase交联处理的大豆7S球蛋白乳化性为77.24 m2/g,经Na2SO3和MTGase处理的大豆7S球蛋白乳化性显著提高(p<0.05),比未处理的大豆7S球蛋白乳化性提高了256.80%,比MTGase交联处理大豆7S球蛋白乳化性提高了10.82%。
由图2(a) 可知,当Na2SO3质量浓度为600~800 mg/L时,乳化性先增大后降低,当质量浓度为700 mg/L时,乳化性达到最大,为87.60 m2/g。这是因为Na2SO3可以破坏大豆7S球蛋白的二硫键,使二硫键断裂为游离巯基[12],大豆7S球蛋白的网络结构被破坏,同时由于7S球蛋白大量的疏水氨基酸,在MTGase作用下使其能快速吸附在油滴表面,乳化性提高,一定质量浓度的Na2SO3有利于蛋白质结构的破坏[26],但随Na2SO3质量浓度的增大,可能过度破坏了7S球蛋白的结构,导致乳化性降低;当Na2SO3质量浓度为600~800 mg/L时,交联处理后大豆7S球蛋白的乳化稳定性先增大后降低,当质量浓度为700 mg/L时,乳化稳定性达到最大,为158.80 min。这是因为适当质量浓度的Na2SO3处理有助于大豆7S球蛋白结构的破坏[12],在MTGase交联作用下,从而使乳化稳定性提高。但随着Na2SO3质量浓度的持续增加,大豆7S球蛋白的结构过度破坏,导致乳化稳定性降低。
由图2(b) 可知,随Na2SO3对大豆7S球蛋白处理时间的增加,乳化性先增大后降低,处理30 min时,乳化性达到最高为87.60 m2/g,这是由于恒温条件下,对大豆7S球蛋白进行一定时间的处理,有利于蛋白质结构的破坏,在MTGase的交联作用下增强了油滴吸附能力,增大了大豆7S球蛋白乳化性[26],随着处理时间的继续增加,乳化性逐渐降低,这是因为恒温条件下,对大豆7S球蛋白进行长时间的处理,蛋白质乳化能力达到饱和,导致大豆7S球蛋白乳化性降低,也可能是由于MTGase的交联作用随处理时间的延长而减弱,以至30 min后乳化性降低;随着处理时间的增加,大豆7S球蛋白经MTGase交联后乳化稳定性先升高后降低,处理时间为30 min时,乳化稳定性达到最高,为157.64 min。这是因为恒温条件下,对大豆7S球蛋白进行一定时间的预处理,有利于蛋白质结构的破坏[21],使乳化稳定性提高。随着处理时间的继续增加,大豆7S球蛋白乳化稳定性降低并趋与平缓,可能由于MTGase的交联作用随时间的延长而减弱,以至30 min后乳化稳定性降低。
由图2(c)可知,随着超声功率的增加,乳化性提高,当超声功率为240 W时,乳化性的值达到最大,最大值为35.15 m2/g;240 W后,乳化性变小。乳化性增大可能是由于发生机械振动、毁坏分子结构、油水界面的部分膨胀和聚集,从而降低表面张力,从而打开氢键、疏水键与二硫键,暴露酶解位点,提高酶解反应速度,这一趋势被Liu C M等人[28]的研究验证。乳化性减小可能由于经过超声作用后,蛋白质的分子柔性、表面疏水性和聚集形态均会产生改变,从而影响其乳化性;未经超声波处理的空白对照组乳化稳定性为74.19 min,超声功率逐步增加,乳化稳定性变大,180~210 W时乳化稳定性下降,主要是由于超声波对其内部构造产生破坏作用,210 W后逐渐上升,300 W时达到最大值,为91.37 min。随着超声功率增大,乳化稳定性减小,可能是由于超声波作用下超声波的机械作用破坏了其明显稳定的状态,扰乱了其整齐规则的结构[27]。随后乳化稳定性增大主要是由于内部空间慢慢恢复了其排列形态,并逐步趋于稳定,分散相与连续相相溶,且溶解越来越完全,乳化稳定性增大。
由图2(d) 可知,当超声时间20~100 min时,7S球蛋白乳化性随超声时间增大呈现先增大后减小的趋势,80 min之前乳化性随着超声时间的增加,乳化性提高,当超声时间为80 min时,乳化性最大,最大值为35.12 m2/g;80 min后,随着超声时间的增加,乳化性慢慢变小。分析原因,可能是由于超声处理使蛋白质结构打开,而MTGase的加入,随着反应时间的增加,溶液中小分子开始聚合,形成具有疏水性又稳定的大分子聚合物,乳化性增大,超声时间继续延长,乳化性下降;而随着超声时间增加,乳化稳定性在20~60 min时乳化稳定性下降,60 min后逐渐上升,100 min时乳化稳定性最大,最大值为92 min。
2.3 不同理化预处理协同MTGase对大豆7S球蛋白游离巯基的影响
不同理化预处理协同MTGase对大豆7S球蛋白游离巯基含量的影响见图3。
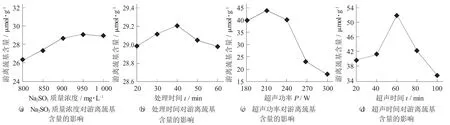
图3 不同理化预处理协同MTGase对大豆7S球蛋白游离巯基含量的影响
巯基含量对蛋白的功用性能起到很大的决定作用,由图3(a) 可知,当Na2SO3质量浓度为800~1 000 mg/L时,经Na2SO3处理的大豆7S球蛋白与MTGase交联后游离巯基含量先增大后趋于平缓,950 mg/L时游离巯基含量达到最大值29.11 μmol/g,之后趋于平缓,但整体变化不明显,分析其产生原因可能是由于Na2SO3使大豆7S球蛋白分子中的二硫键断裂成为游离巯基[12],但因为二硫键和游离巯基是可以相互转变的,在空气的氧化作用下,部分游离的巯基可以转变为二硫键,并达到动态平衡的状态,以致于Na2SO3质量浓度继续升高,游离巯基含量的变化不明显。
由图3(b) 可知,随着处理时间增大,游离巯基的含量先增大后降低。当处理时间为40 min时游离巯基的含量达到最大,为29.20 μmol/g。这是因为,随Na2SO3处理时间的增加,被破坏的二硫键的数量增多,导致游离巯基含量增加,继续增加时间对其巯基含量没有影响,游离巯基含量下降。
由图3(c) 可知,在超声波协同MTGase交联处理下的大豆7S球蛋白,大豆7S球蛋白样品的游离巯基含量呈下降的趋势。超声功率为180~300 W时,游离巯基含量先增大后下降,且在210 W时,游离巯基含量达到最大值44.5 μmol/g,随着超声功率作用继续增大,游离巯基含量逐渐减少,可能是由于超声波的空化作用使蛋白质二硫键破坏,使其结构变得松散,游离巯基含量增大,继续增大超声功率,超声波的机械作用过度破坏其明显稳定的状态,扰乱了其整齐规则的结构,使得游离巯基含量下降。
由图3(d) 可知,超声时间20~60 min,游离巯基含量增加,可能是由于超声作用使蛋白结构打开,蛋白结构变得松散,游离巯基含量增大;超声时间大于60 min时,巯基含量反而呈减小的趋势,其原因可能是因为长时间的超声处理会出现一些相互影响而产生氢过氧化物的自由基,它们会再次生成新的二硫键,同时蛋白质内部的游离构造随着超声时间的延长,有自主聚集的趋势,可包埋住暴露的巯基[29]。这样的变化趋势,可以发现通过超声波的不断作用可以使其内部隐藏的巯基暴露到表面上,造成了游离巯基含量的降低,加快其生成二硫键,应用到日常生活中可以加强相关制品,如市场上新型的大豆冰激凌或大豆果冻等的凝胶性。
2.4 不同理化预处理协同MTGase对大豆7S球蛋白平均粒径的影响
不同理化预处理协同MTGase对大豆7S球蛋白平均粒径的影响见图4。
由试验可知,未经处理的大豆7S球蛋白粒径为40.21 nm,经MTGase交联处理的大豆7S球蛋白粒径为58.76 nm,经Na2SO3协同MTGase处理的大豆7S球蛋白粒径显著提高(p<0.05)。
由图4(a) 可知,当Na2SO3质量浓度为800~1 000 mg/L时,经MTGase交联处理后大豆7S球蛋白的粒径先增大后减小;当Na2SO3质量浓度为950 mg/L时,7S球蛋白平均粒径达到最大,为110.3 nm。这是由于Na2SO3的还原作用使大豆7S球蛋白中的二硫键断裂[12],在MTGase的交联作用下,蛋白质聚集现象增加,表现为粒径的增大[26],随后MTGase作用达到饱和,粒径变小。
由图4(b) 可知,处理时间在40 min之前,随着处理时间的增加,粒径变化不明显,当处理时间为50 min时,粒径达到最大值,为111.0 nm,随着处理时间的继续增加,粒径降低。这是由于恒温条件下,对大豆7S球蛋白进行一定时间的处理,有利于蛋白质结构的破坏,在MTGase的交联作用下,使蛋白粒径增大;时间继续增加,对粒径影响变小,平均粒径变小。
由图4(c) 可知,在超声波的处理下大豆7S球蛋白协同MTGase交联作用,超声功率为180~300 W时,平均粒径先增大后减小,在240 W时,平均粒径达到最大,最大值为112 nm,随着超声功率作用继续增大,平均粒径逐渐减小,可能是由于超声波的空化作用使蛋白质二硫键破坏,使其结构变得松散,在MTGase的交联作用下,蛋白质聚集现象增加,表现为粒径的增大,继续增大超声功率,粒径减小。
由图4(d) 可知,相对于未经超声波处理的大豆7S球蛋白,超声波处理能极大程度上降低大豆7S球蛋白平均粒径,随着超声时间的增大,在超声波的处理下大豆7S球蛋白与MTGase交联协同作用,蛋白质趋向于聚集,使其平均粒径些许增大,随着超声波作用时间的增加平均粒径改变不明显,20~60 min时平均粒径基本保持不变。可能是由于超声波的空穴效应使其形成湍流,作用生成的剪切力等作用打乱了原来具有的完整的蛋白颗粒,80 min后增加,平均粒径反而从107.8 nm增大到129.8 nm,可能是由于过长时间的高强度处理诱发了其非共价作用而形成的微小物理聚集体,导致平均粒径增大。

图4 不同理化预处理协同MTGase对大豆7S球蛋白平均粒径的影响
3 结论
以Na2SO3质量浓度、处理时间、超声功率、超声时间为单因素,研究理化预处理协同MTGase交联改性处理后大豆7S球蛋白的持油性、乳化性及乳化稳定性、游离巯基含量、平均粒径等变化。结果表明,Na2SO3处理协同MTGase交联处理明显提高大豆7S球蛋白持油性、乳化性及乳化稳定性,Na2SO3质量浓度950 mg/L,处理时间40min时,持油性达到最大,最大值为8.94 g/g;Na2SO3质量浓度700 mg/L时,处理时间30 min时,乳化性达到最大(87.60 m2/g),乳化稳定性达到最大(153.42 min);超声处理协同MTGase交联处理明显提高大豆7S球蛋白游离巯基含量,增大蛋白颗粒平均粒径;超声功率180 W,超声时间60 min时,游离巯基含量达到最大值,为51.96 μmol/g;超声功率180 W,超声时间100 min时,平均粒径达到最大值,为129.8 nm。
