皖北地区腌制菜中具高抗氧化能力乳酸菌的筛选
2020-03-11蒋家璇张凯迪姚沛琳
黄 煜,蒋家璇,张凯迪,姚沛琳
(宿州学院生物与食品工程学院,安徽宿州 234000)
0 引言
乳酸菌(Lactic acid bacteria,LAB) 是可以利用碳水化合物产生大量乳酸的一类无芽孢、革兰氏染色阳性细菌的总称[1]。乳酸菌不仅可以提高营养价值,改善食品的风味,还可以提高食品保鲜和附加值,而且还具有特殊的生理活性。大量研究表明,乳酸菌可以降低血清胆固醇、控制内毒素、制造营养物质,从而对机体的营养状态、生理功能、衰老过程等产生作用。由于乳酸菌具有诸多益生作用,人们对此加以重视并开发利用[2]。
氧化是肌肤衰老的最大威胁,还可引发心血管、关节炎、癌症等疾病[3]。饮食不健康、日晒、环境污染、压力等都可以让机体内自由基泛滥,从而使肌肤产生各种氧化现象。抗氧化物质就是以低浓度存在就能有效抑制自由基的氧化反应的物质,其可以直接作用在自由基上,也可以间接消耗掉容易生成自由基的物质,防止发生进一步反应[4]。人体中的抗氧化物质一部分由自身合成,另外一部分由食物供给。乳酸菌作为一种研究较多的益生菌,能够降低自由基的生成[5],作为一种天然抗氧化剂具有较大的研究价值。
从皖北地区腌制咸菜(宿州农贸市场采购的腌制雪菜、豆角、白菜等)中分离出来的20株乳酸菌的基础上,测定其菌体及无细胞提取物的羟自由基清除率、DPPH自由基清除率、还原能力、螯合亚铁离子能力这4个抗氧化指标,比较它们之间抗氧化活性的差异,筛选出具有高抗氧化活性的菌株,为后续研究提供优良的菌种资源。
1 材料与方法
1.1 材料
1.1.1 试验菌株
20株乳酸菌,从皖北地区采集的腌制菜中筛选得到。
1.1.2 培养基
MRS培养基:鱼粉蛋白胨10 g/L,酵母粉5/L,牛肉浸膏10 g/L,葡萄糖20 g/L,乙酸钠5 g/L,柠檬酸氢二铵2 g/L,磷酸氢二钾2 g/L,硫酸锰0.25 g/L,硫酸镁0.58 g/L,吐温-80 1 mL/L,于121℃下高压蒸汽灭菌15 min。
1.1.3 主要试剂
焦性没食子酸、七水合硫酸亚铁、六水合三氯化铁、六氰合铁(III)酸钾、水杨酸、DPPH试剂等,均购置于国药集团。
1.2 试验方法
1.2.1 菌株的活化
20株乳酸菌菌株保存于含30%(V/V) 甘油的MRS培养基中,于-80℃下保存,使用前按2%(V/V) 接种量接于MRS液体培养基中,于37℃下培养20 h,连续活化2次[6]。
1.2.2 乳酸菌无细胞提取物的制备
参考Liu C等人[7]的方法,并稍作修改。收集活化后的乳酸菌(4℃,以转速6 000 r/min离心10 min),用PBS清洗2次后,重悬于PBS中,超声破碎。超声破碎条件设置为:功率60 W,工作3 s停8 s,共15 min。将超声后的破碎液以转速12 000 r/min离心20 min后取其上清液,经过0.22 μm的滤膜过滤后得到无细胞提取物。
1.2.3 乳酸菌DPPH清除率的测定
取样品1 mL,浓度0.2 mmol/L的DPPH-无水乙醇溶液1 mL,依次加入试管中,二者充分混匀后,于37℃的恒温水浴锅中反应1 h,随后立即于波长517 nm处测定制品的吸光度值,该方法用蒸馏水做空白对照[8]。自由基清除率计算方法如下:
式中:A1——空白管的吸光度;
A2——样品管的吸光度。
1.2.4 乳酸菌羟自由基清除能力的测定
1,10- 菲罗啉 2.5 mmol/L溶液、PBS(pH 值 7.4)和样品溶液各加入1 mL,再加1 mL浓度2.5 mmol/L FeSO4溶液。充分混合后,加入1 mL浓度20 mmol/L的H2O2溶液。反应混合物在37℃水浴中保持1.5 h。离心收集的上层清液是以转速6 000 r/min离心10 min,其波长为536 nm。同时,按照上述方法,用1 mL PBS代替混合物中1 mL的样品溶液作为空白对照组,测定536 nm处的吸光度[9]。自由基清除率计算方法如下:
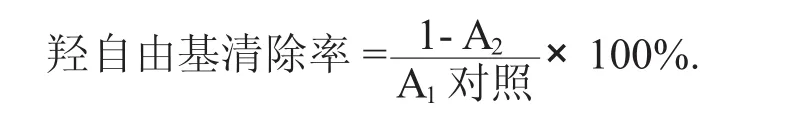
式中:A1——对照组在波长536 nm处测得的吸光度;
A2——样品管在波长536 nm处测得的吸光度。
1.2.5 乳酸菌还原能力的测定
取样品0.5 mL,加入1%铁氰化钾溶液0.5 mL后PBS(pH值6.6)。混合在50℃恒温水浴20 min。从水浴中取出后,迅速在冰浴中冷却。加入10%三氯乙酸溶液0.5 mL,混合离心,取上清液(以转速3 000 r/min离心10 min)。取上清液1 mL,加入0.1%氯化铁溶液1 mL,拌匀。10 min后,以盐酸半胱氨酸为标准品,于波长700 nm处测定吸光度。同时,用蒸馏器代替混合物中的样品于波长700 nm处测量水的吸光度[10]。吸光度越高,待测样品的还原能力越强。
1.2.6 乳酸菌螯合亚铁离子的测定方法
加入0.1 mL抗坏血酸、0.1 mL硫酸亚铁和100 mL硫酸亚铁。2 mol/L的氢氧化钠溶液,在37℃恒温水浴20 min后,三氯乙酸沉淀的蛋白质,以转速4 000 r/min离心10 min,取上清液0.2 mL,添加0.1%的邻菲罗啉2 mL反应10 min后,于510 nm处测量吸光度,OD值,同时做空白试验(PBS)[11]。
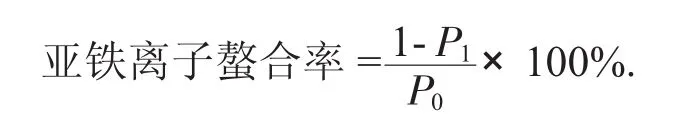
式中:P0——PBS系统OD值;
P1——样品系统的OD值。
2 结果与分析
2.1 乳酸菌对DPPH自由基清除率的测定结果
乳酸菌对DPPH自由基清除率结果见表1。
DPPH自由基清除率的测定是一种使用很广泛的评价和筛选抗氧化剂抗氧化能力的方法。DPPH清除率越大表明抗氧化能力越强[12]。试验测定了20株乳酸菌的无细胞提取物对DPPH自由基的清除情况。20株菌株都表现出一定的DPPH自由基清除能力。总体而言,菌体细胞DPPH自由基清除率要比无细胞提取物强。其中,菌株4-1,3-3的无细胞提取物对DPPH自由基清除能力比较强,分别为61.24%,60.85%;菌株3-1,3-3的菌体细胞对DPPH自由基清除率较强,分别为56.98%,52.71%。
2.2 乳酸菌清除羟自由基能力的测定
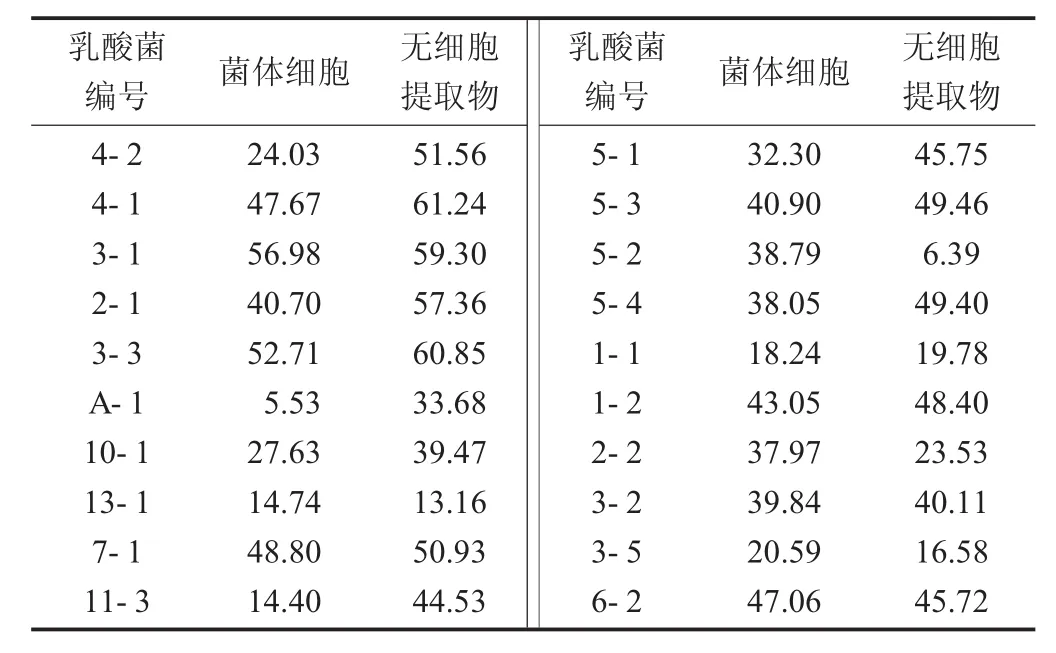
表1 乳酸菌对DPPH自由基清除率结果
乳酸菌清除羟自由基能力结果见表2。
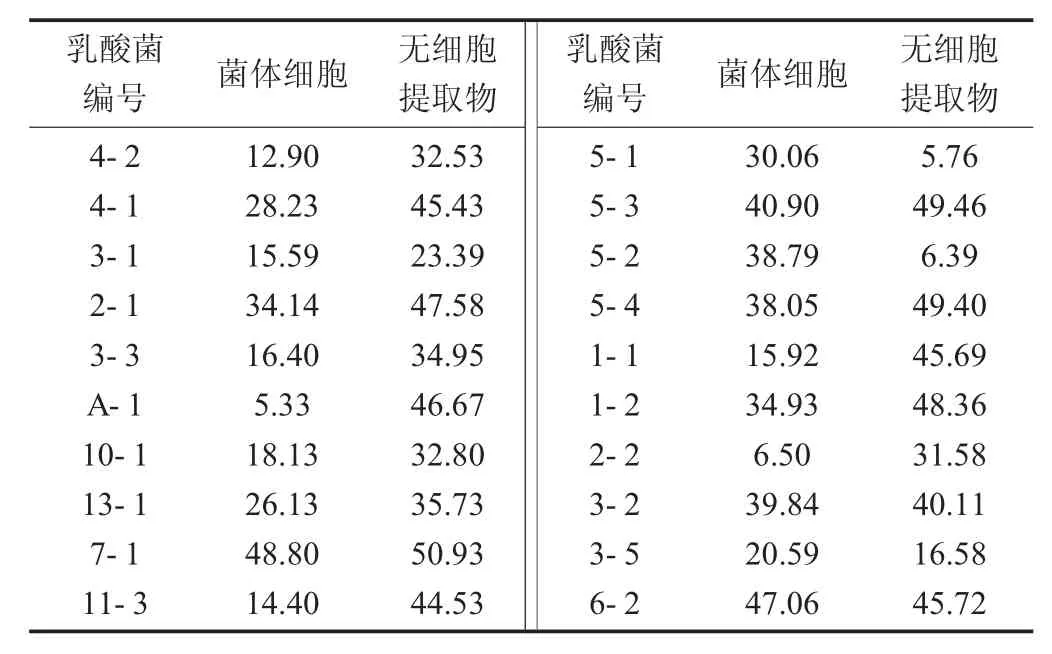
表2 乳酸菌清除羟自由基能力结果
羟基自由基是一种体内氧化能力较强的自由基,可对大分子造成损伤。因此,清除羟自由基的能力也是衡量抗氧化能力的重要指标[13]。研究测定了不同乳酸菌的无细胞提取物对羟基自由基的清除能力,各菌株均表现出一定的羟基自由基清除能力。总体看来,菌体和无细胞提取物清除羟自由基能力相差不大,其中菌株7-1和6-2的菌体对羟基自由基清除能力较强,分别为48.80%,47.06%;菌株7-1和5-3的无细胞提取物对羟基自由基清除能力较强,分别为50.93%,49.96%;菌株5-1的无细胞提取物对羟基自由基清除能力最低,为5.76%。
2.3 乳酸菌还原能力的测定
乳酸菌还原能力的测定结果见表3。
抗氧化能力与还原能力直接相关[14],20株乳酸菌的菌体和无细胞提取物的还原能力测定结果均显示乳酸菌具有一定的还原能力,无细胞提取物的还原能力相对于菌体的还原能力而言更强。其中,菌株1-2的菌体细胞的还原力相对较强,为0.233,而菌株6-2的菌体细胞最弱,为0.086;菌株3-5的无细胞提取物的还原能力较强,为0.248,而菌株3-1的还原能力最低,为0.035。
2.4 乳酸菌螯合亚铁离子的测定
乳酸菌螯合亚铁离子的结果见表4。
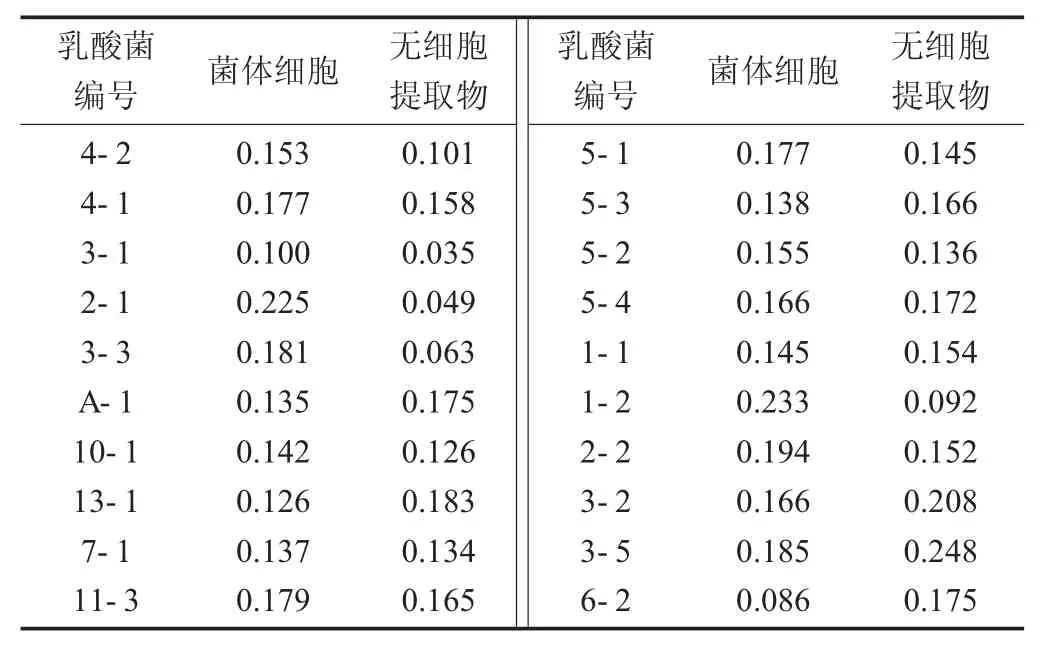
表3 乳酸菌还原能力的测定结果
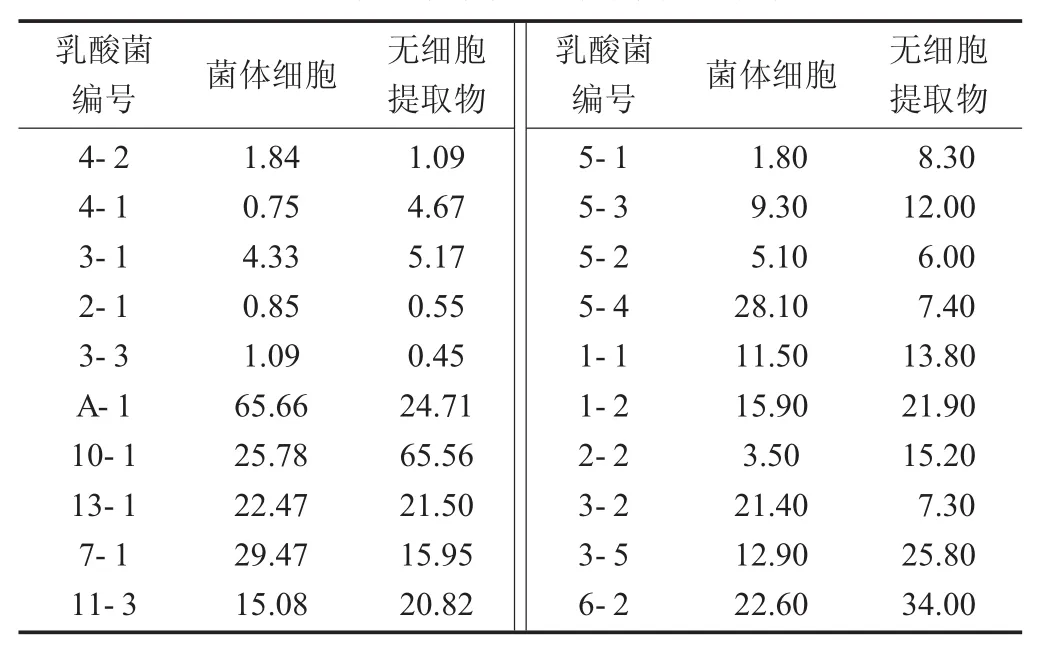
表4 乳酸菌螯合亚铁离子的结果
由表4可知,20株乳酸菌均具有一定的螯合亚铁离子的能力,但是菌体细胞和无细胞提取物对亚铁离子的螯合能力基本上差别不大。其中,菌株10-1的无细胞提取物螯合亚铁离子能力最强,为65.56%,其次是6-2,为34.00%;菌株A-1的菌体细胞相对较好,为65.66%,而菌株4-1的则最差,为0.75%。
3 结论
乳酸菌的抗氧化作用与其对人体健康息息相关[15]。试验以羟自由基清除率、DPPH自由基清除率、还原能力的测定、螯合亚铁离子能力的测定为体外抗氧化能力评价指标,对20株分离于皖北地区不同腌制菜中的乳酸菌为筛选源,比较其菌体细胞和无细胞提取物的抗氧化活性。结果表明,20株菌株中,菌体细胞的DPPH自由基清除率要比无细胞提取物强要强,而清除羟自由基能力和螯合亚铁离子能力两者相差不大,无细胞提取物的还原能力相对于菌体细胞的更强。总体上,菌株7-1抗氧化能力较好。其中菌株7-1,3-3,A-1的菌体细胞抗氧化能力强,菌株3-1,3-5,10-1的无细胞提取物抗氧化能力强。在今后的研究中,可以对抗氧化能力强的乳酸菌采用细胞模型或动物模型,对其体内抗氧化能力进行评价。
