超声心动图评价早产儿动脉导管关闭前后左心结构与功能变化
2020-03-09毕桐瑶姜克新
毕桐瑶,姜克新
中国医科大学附属盛京医院超声科,辽宁沈阳 110004;*通讯作者 姜克新 kxj189@163.com
动脉导管是主动脉与肺动脉之间起连接作用的管状结构[1],在胎儿时期处于开放状态,出生后动脉导管内皮细胞分泌的前列腺素E2 减少、血液内一氧化氮含量减低、氧含量增高促使动脉导管管壁平滑肌收缩,动脉导管完成早期的功能性闭合[2]。动脉导管平滑肌收缩导致动脉导管内膜缺乏血供,刺激生长转化因子的生成,动脉导管内膜增生,逐步完成解剖性关闭。动脉导管未闭(patent ductus arteriosus,PDA)的发病率与胎龄、体重具有相关性,胎龄越小、出生体重越低,则早产儿PDA的发病率越高[3-4]。早产儿PDA 易诱发严重并发症,早期药物干预十分必要,其中布洛芬在临床上应用最广泛[5],疗效好且不良反应小,是低体重新生儿PDA的首选用药。超声心动图是诊断PDA、评估患儿心功能的首选检查。本研究利用常规超声心动图与实时三维超声心动图(real-time three-dimensional echocardiography,RT-3DE)分析布洛芬治疗早产儿动脉导管关闭前后左心结构和左心功能的变化,探讨左心腔内径、左心功能指标与动脉导管内径、动脉导管分流速度的相关性。
1 资料与方法
1.1 研究对象 收集2017年12月—2019年1月于中国医科大学附属盛京医院出生,且出生后72 h 临床听诊心脏杂音并行超声心动图确诊为PDA的早产儿60例,其中30例出生体重<1000 g 者为超低出生体重儿,男19例,女11例,胎龄(27.52±1.26)周,体重(868.8±87.5)g。30例1000 g≤出生体重<1500 g者为极低出生体重儿,男17例,女13例,胎龄(30.40±1.70)周,体重(1259.0±164.7)g。纳入患儿均无其他心脏疾病,卵圆孔开放状态正常。
1.2 仪器与方法 采用Philips EPIQ 7C彩色多普勒超声诊断仪,S12-4 探头(频率4~12 MHz),X5-1探头(频率1~5 MHz),Qlab10.8 定量分析软件。布洛芬治疗动脉导管关闭3~6 d 后复查超声心动图。
1.2.1 常规超声心动图指标测量 患儿于安静状态下取平卧位,同步记录心电图,于主动脉短轴切面测量动脉导管内径及动脉导管分流速度,于胸骨旁左心室长轴切面测量左心房内径(left atrial diameter,LAD)和左心室舒张末期内径(left ventricular enddiastolic diameter,LVEDD)。利用脉冲多普勒(pulse wave Doppler,PW)获得二尖瓣口血流频谱,测量二尖瓣舒张早期血流峰值速度(E)和舒张晚期血流峰值速度(A)。利用组织多普勒(tissue Doppler imaging,TDI)在二尖瓣环处测量二尖瓣环舒张早期运动峰值速度(E′)、舒张晚期运动峰值速度(A′)、等容收缩时间、等容舒张时间和射血时间,上述参数均测量3次取平均值。计算E/A、E′/A′、E/E′及Tei 指数。

1.2.2 RT-3DE 指标测量 于心尖四腔心切面获得清晰完整的图像,选择全容积成像,采集并存储6个心动周期的三维图像。利用Qlab 10.8软件3DQ Advance插件进行分析,在舒张末期、收缩末期,分别于心尖四腔、两腔切面手动选择二尖瓣瓣环水平的前壁、室间隔、侧壁、下壁以及心尖部左心室心内膜取样点,计算机自动生成心内膜轮廓[6],对于描记不完整处进行手动描记,计算左心室舒张末期容积(left ventricular end-diastolic volume,LVEDV)、左心室心肌质量(left ventricular mass,LVM)、左心室射血分数(left ventricular ejection fraction,LVEF)、左心室基底段、中间段和心尖段射血分数(图1)。根据公式(2)、(3)分别计算左心室舒张末期容积指数(left ventricular end-diastolic volume index,LVEDVI)和左心室心肌质量指数(left ventricular mass index,LVMI)。以上参数指标均测量3次取平均值。

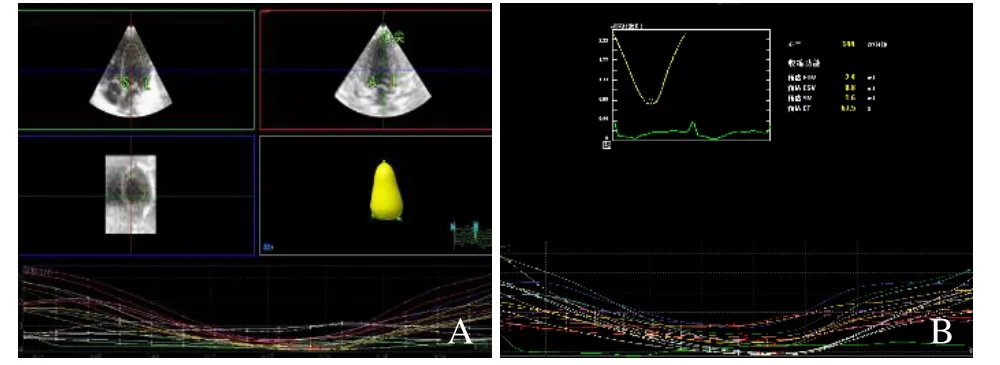
图1 RT-3DE 测算左心室收缩功能。用RT-3DE 测量左心室容积(A);用RT-3DE 计算LVEF(B)
1.3 统计学方法 采用SPSS 20.0软件,计量资料以表示,动脉导管关闭前后参数比较行配对样本t检验,动脉导管直径、动脉导管分流速度与各参数指标的相关性采用Pearson 相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 动脉导管关闭前后常规超声心动图指标比较 极低出生体重儿组、超低出生体重儿组动脉导管关闭后LAD和LVEDD 较关闭前缩小(表1,图2),动脉导管关闭后E/A、E′/A′较关闭前升高,E/E′、Tei 指数较关闭前减低,且关闭前后比较,差异均有统计学意义(P均<0.05,表1)。
2.2 动脉导管关闭前后RT-3DE 指标比较 RT-3DE法测量两组患儿动脉导管关闭后LVEDV、LVEDVI及LVMI 较关闭前减低,且关闭前后比较,差异均有统计学意义(P均<0.05,表2)。两组患儿动脉导管关闭前后LVEF、左心室基底段、中间段和心尖段射血分数变化差异无统计学意义(P>0.05,表2)。
表1 动脉导管关闭前后常规超声心动图测量参数比较(±s)
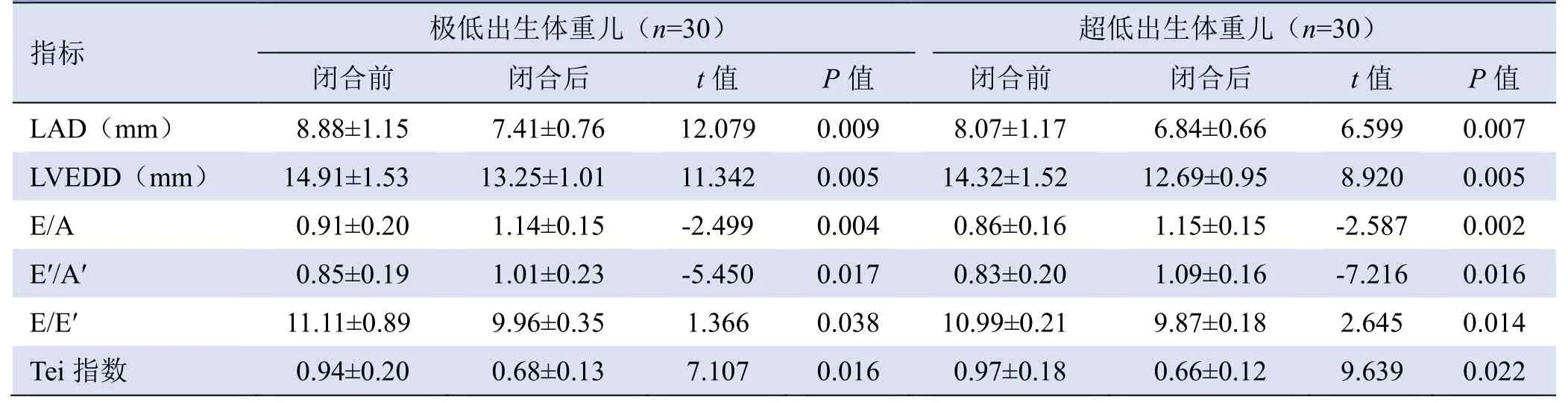
表1 动脉导管关闭前后常规超声心动图测量参数比较(±s)
注:LAD为左心房内径,LVEDD为左心室舒张末期内径,E为二尖瓣舒张早期血流峰值速度,A为舒张晚期血流峰值速度,E′为二尖瓣环舒张早期运动峰值速度,A′为舒张晚期运动峰值速度
指标 极低出生体重儿(n=30) 超低出生体重儿(n=30) 闭合前 闭合后 t值 P值 闭合前 闭合后 t值 P值 LAD(mm) 8.88±1.15 7.41±0.76 12.079 0.009 8.07±1.17 6.84±0.66 6.599 0.007 0.005 E/A 0.91±0.20 1.14±0.15 -2.499 0.004 0.86±0.16 1.15±0.15 -2.587 0.002 LVEDD(mm) 14.91±1.53 13.25±1.01 11.342 0.005 14.32±1.52 12.69±0.95 8.920 0.016 E/E′ 11.11±0.89 9.96±0.35 1.366 0.038 10.99±0.21 9.87±0.18 2.645 0.014 E′/A′ 0.85±0.19 1.01±0.23 -5.450 0.017 0.83±0.20 1.09±0.16 -7.216 Tei 指数 0.94±0.20 0.68±0.13 7.107 0.016 0.97±0.18 0.66±0.12 9.639 0.022
表2 动脉导管关闭前后RT-3DE 测量参数比较(±s)
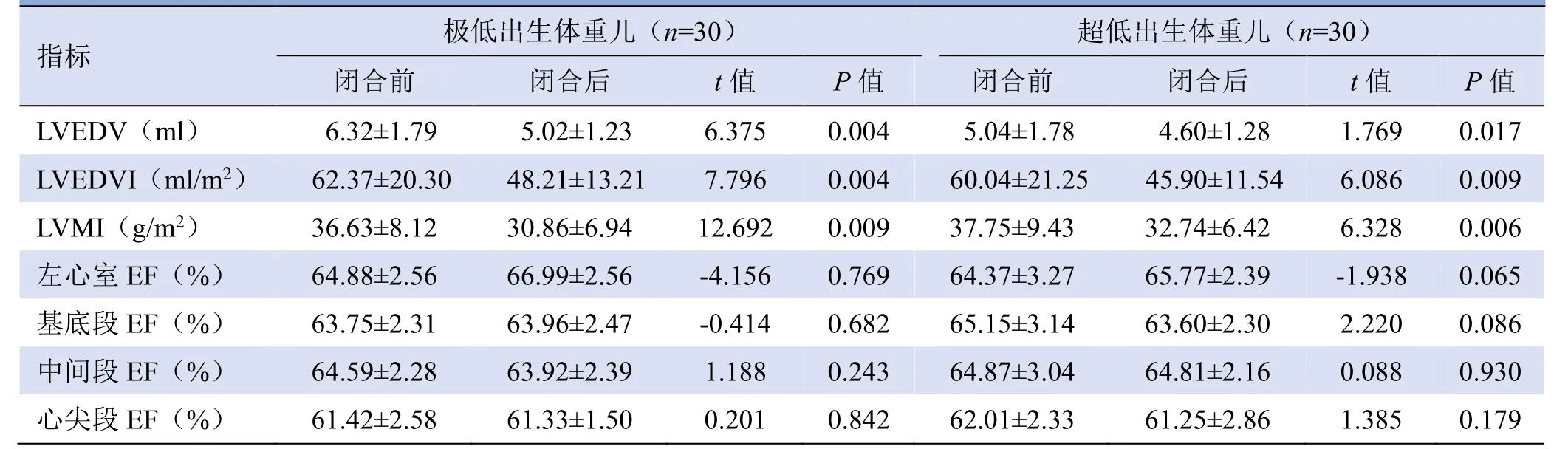
表2 动脉导管关闭前后RT-3DE 测量参数比较(±s)
注:LVEDV为左心室舒张末期容积,LVEDVI为左心室舒张末期容积指数,LVMI为左心室心肌质量指数,EF为射血分数
指标 极低出生体重儿(n=30) 超低出生体重儿(n=30) 闭合前 闭合后 t值 P值 闭合前 闭合后 t值 P值 LVEDV(ml) 6.32±1.79 5.02±1.23 6.375 0.004 5.04±1.78 4.60±1.28 1.769 0.017 LVEDVI(ml/m2) 0.009 LVMI(g/m2) 36.63±8.12 30.86±6.94 12.692 0.009 37.75±9.43 32.74±6.42 6.328 0.006 62.37±20.30 48.21±13.21 7.796 0.004 60.04±21.25 45.90±11.54 6.086 0.065 基底段EF(%) 63.75±2.31 63.96±2.47 -0.414 0.682 65.15±3.14 63.60±2.30 2.220 0.086 左心室EF(%) 64.88±2.56 66.99±2.56 -4.156 0.769 64.37±3.27 65.77±2.39 -1.938 0.930心尖段EF(%) 61.42±2.58 61.33±1.50 0.201 0.842 62.01±2.33 61.25±2.86 1.385 0.179 中间段EF(%) 64.59±2.28 63.92±2.39 1.188 0.243 64.87±3.04 64.81±2.16 0.088
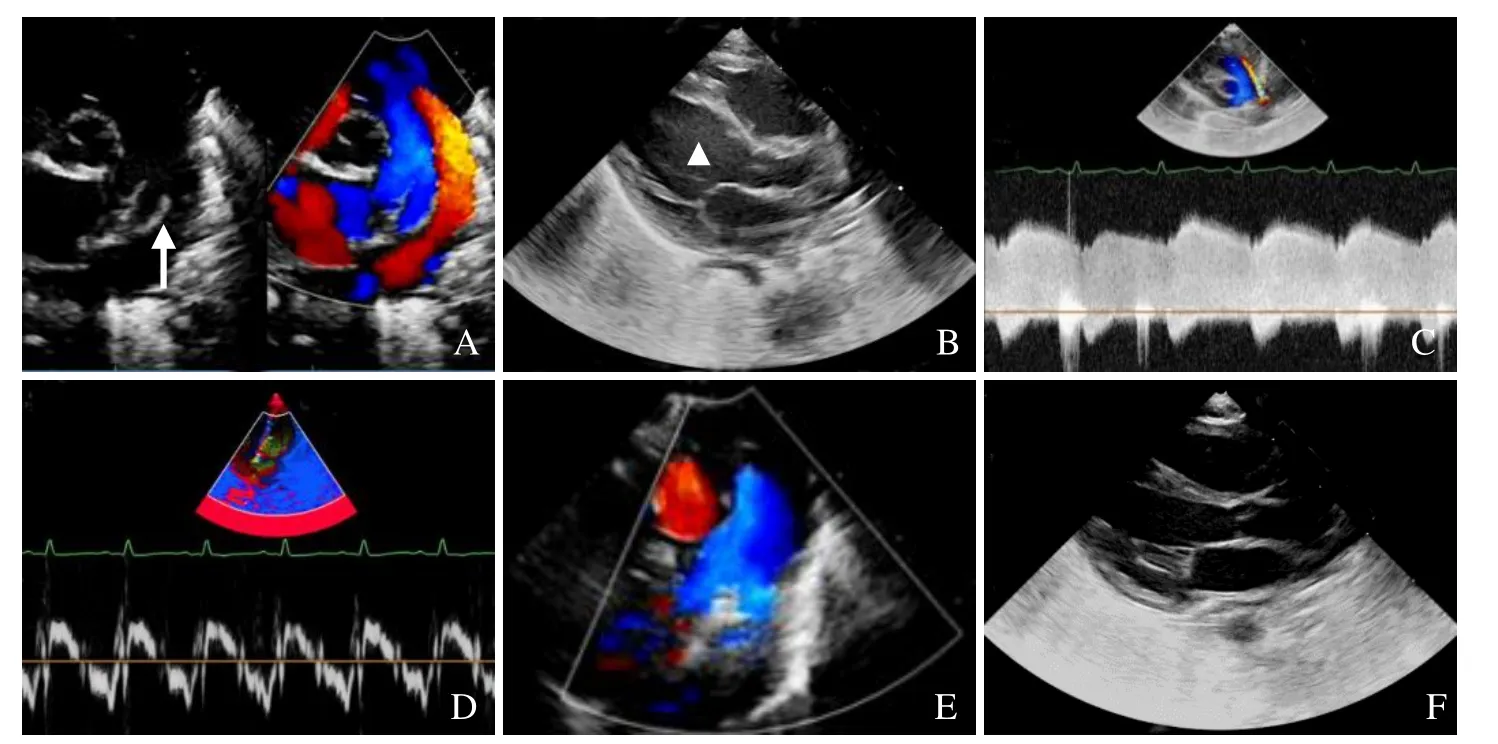
图2 RT-3DE 检测1例动脉导管未闭患儿,女,7 d。超声示动脉导管开放(箭,A),左心腔内径增大(箭头,B),动脉导管分流峰速(C),患儿TDI 频谱(D),动脉导管关闭(E),患儿左心结构恢复正常(F)
2.3 RT-3DE 指标与动脉导管内径、动脉导管分流速度的相关性 早产儿PDA的LAD、LVEDD、LVEDV与动脉导管内径呈正相关(r=0.574、0.642、0.661,P<0.05)(图3~5)。LVMI与动脉导管分流速度呈正相关(r=0.264,P<0.05)(图6)。
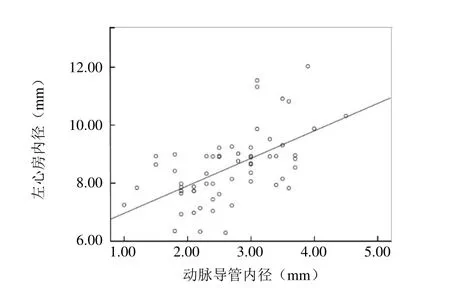
图3 PDA 患儿左心房内径与动脉导管内径的相关性
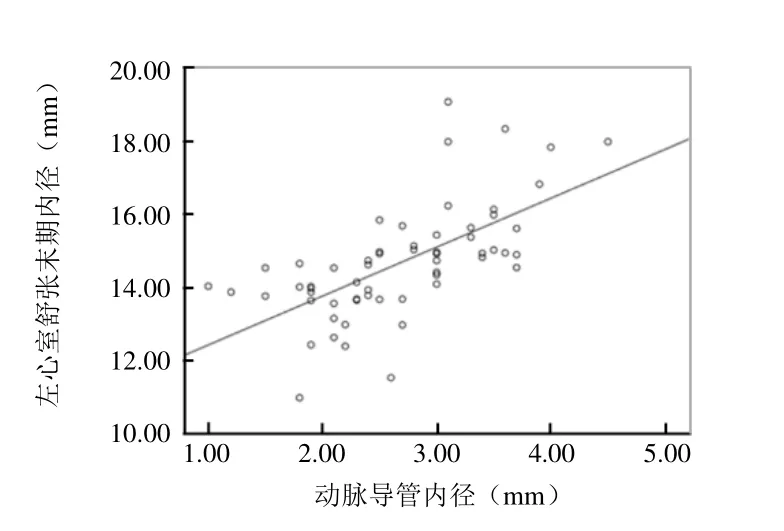
图4 PDA 患儿左心室舒张末期内径与动脉导管内径的相关性
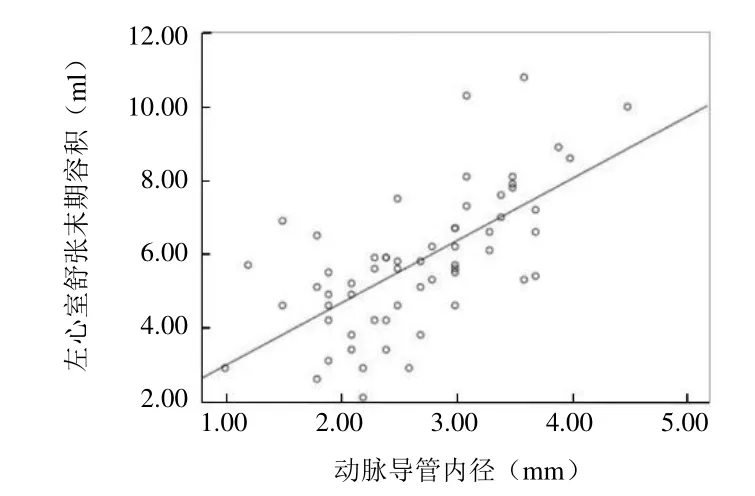
图5 PDA 患儿左心室舒张末期容积与动脉导管内径的相关性
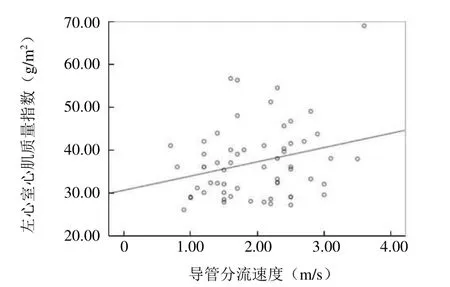
图6 PDA 患儿左心室心肌质量指数与动脉导管分流速度的相关性
3 讨论
3.1 动脉导管关闭前后左心结构变化 中重度PDA的导管异常左向右分流量大,早期主动脉的压力高于肺动脉,动脉导管内的血液左向右分流至肺动脉内,经肺循环回至左心系统[7]。大量的动脉导管分流加重左心室容量负荷,使得左心室长期处于高动力循环状态,左心室心肌结构发生变化,左心腔内径逐渐增大,最终导致心衰等并发症[8]。本研究表明,动脉导管关闭后患儿的LAD和LVEDD 较关闭前缩小,左心室前负荷减低,左心室结构逐渐恢复正常,与既往研究相符。
3.2 动脉导管关闭前后左心功能变化
3.2.1 常规超声心动图评价 左心功能变化应用PW、TDI 测量二尖瓣口E、A、E′、A′,计算E/A、E′/A′及E/E′比值可以准确地评估左心室舒张功能,Harada 等[9]研究表明,E/A、E′/A′和E/E′用于评价早产儿的左心室舒张功能具有更好的敏感性,其中TDI不受患儿心率及血流动力学的影响,能更好地评价左心室舒张功能[10]。本研究中动脉导管关闭后E/A和E′/A′比值升高,E/E′降低,与以往研究结果一致,提示动脉导管的闭合有助于改善左心舒张功能。TDI 通过测定左心室室壁的运动计算左心室Tei 指数,用于评价左心室心肌整体功能。戚庭月等[11]利用TDI 对早产儿左心室Tei 指数进行测算,结果显示早产儿左心室Tei 指数为0.50±0.04。本研究中左心室Tei 指数在动脉导管关闭后降低,与上述研究结论一致,表明动脉导管的分流量对于左心室是较重的负荷,会影响左心室心肌收缩和舒张功能,动脉导管关闭后左心室不再处于高动力状态,左心室心肌功能逐渐恢复正常。
3.2.2 RT-3DE 评价左心功能变化心脏MRI是评估心室容积和收缩功能的“金标准”。毕涛等[12]研究证实RT-3DE 对心功能的测算与心脏MRI的结果基本一致,尤其是对于心肌结构发生改变的PDA 患儿,RT-3DE 在评价形态不规整的心脏功能方面的优势大于二维超声心动图[13]。本研究应用RT-3DE 测算LVEDV、LVEDVI,动脉导管关闭后LVEDV及LVDEVI 较关闭前减低,表明动脉导管关闭后左心室逐渐从高动力代偿性收缩的状态中恢复至正常。LVMI 用于反映左心室肥厚及结构重塑,是评价左心室功能的重要参数指标[14]。主动脉与肺动脉间动脉导管的存在使左心室血容量增多,左心室心肌细胞为适应异常增大的前负荷而代偿性肥大,心肌收缩功能增强,此时LVM及LVMI 增高[15]。动脉导管关闭后左心室的异常容量负荷消失,心肌细胞回缩,心肌质量减低,LVMI 减低,与郑军等[15]的结论一致,提示动脉导管关闭后左心室功能恢复正常。
3.3 左心结构及功能指标与动脉导管内径、分流速度的相关性 本研究中,LAD、LVEDD、LVEDV与动脉导管内径呈正相关,与以往研究结论一致,表明动脉导管内径是影响PDA 患儿左心结构与左心收缩功能的重要因素,导管内径越宽,左心容量负荷越重,左心结构变化越明显,左心室心肌代偿性收缩功能越强。此外,LVMI与动脉导管分流速度呈正相关,证明导管流速也是左心功能的影响因素之一。临床工作中可以根据动脉导管的内径及分流速度综合评估早产儿PDA 程度,预估心脏结构功能改变程度,针对中度以上的PDA(动脉导管直径≥1.5 mm,速度≥1.5 m/s)进行药物干预,并评价动脉导管关闭后早产儿左心结构与功能的改善情况。
总之,动脉导管关闭后早产儿的左心腔内径缩小,左心室功能较关闭前改善。RT-3DE 不受心室几何形变的影响,能够从心脏整体和局部评价左心室心肌功能。导管内径和导管分流速度是影响左心结构与功能的重要因素。本研究的局限性为样本量不够充足,对于早产儿三维探头过大、检查过程中肺气及体位对图像的采集造成影响,从而影响后期相关参数的测量,造成误差。今后需扩大样本量,增加图像清晰度,延长随访时间进一步评价。
