酶法改性对马铃薯渣膳食纤维单糖组分及理化性质的影响
2020-03-09张海芳李艳韩育梅佟海龙赵珺
张海芳,李艳,韩育梅,*,佟海龙,赵珺
(1.内蒙古化工职业学院材料工程系,内蒙古呼和浩特010010;2.内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特010018)
膳食纤维(dietary fiber,DF)被称为“第七营养素”,根据是否溶于水分为可溶性膳食纤维(soluble dietary fiber,SDF) 和不可溶性膳食纤维 (insoluble diebary fiber,IDF)[1-2]。有研究表明,膳食纤维有降低血糖[3]、降低胆固醇、预防便秘、预防结肠癌等功能特性[4-5],这些保健功能与其单糖组成以及键合结构有关。例如,阿拉伯糖可以阻断蔗糖在肠道内的代谢,降低血糖水平[6];半乳糖和半乳糖醛酸作为果胶及果胶类物质的主要组成部分,可以形成凝胶网状结构吸附胆酸盐、胆固醇等物质,从而降低人体胆固醇[7-8];膳食纤维化学结构中含有很多亲水基团,具有很强的持水力和结合水力,膳食纤维吸水后膨胀形成滑润细腻的海绵状膨润物,有利于扩大粪便容积,产生自然通便作用,同时大大减少粪便中有毒有害物质对肠道黏膜细胞的毒害作用,从而降低肠道癌症的发病率[9-10]。
酶法改性温和高效,操作简单,常用的酶有纤维素酶、半纤维素酶、木聚糖酶[11-12]。例如,莎日娜等[13]利用纤维素酶改性马铃薯膳食纤维后,持油力由2.85 g/g提高至3.62 g/g,阳离子交换力由0.27 mL/g 提高至0.64 mL/g。沈蒙等[14]用纤维素酶和半纤维素酶对黑豆皮可溶性膳食纤维进行改性,SDF 的持水力和膨胀力分别提高3.71%、10.97%。王佳等[15]用纤维素酶和木聚糖酶对竹笋膳食纤维进行改性处理,其膨胀力、持水力、持油力分别提高了61%、46%、31%。
本试验选用纤维素酶、木聚糖酶、纤维素-木聚糖复合酶分别对马铃薯渣膳食纤维进行改性,并对其改性前后理化性质和单糖组成及含量进行分析,旨在为马铃薯渣膳食纤维研究提供理论依据,为今后淀粉副产物的综合利用提供参考价值。
1 材料与方法
1.1 材料与试剂
马铃薯渣:呼和浩特市华欧淀粉厂;95 %乙醇、氢氧化钠、盐酸、硝酸银、溴化钾、葡萄糖、半乳糖、半乳糖醛酸、阿拉伯糖、木糖(均为分析纯)、纤维素酶(≥5 000 U/g):国药集团化学试剂有限公司;高峰α-淀粉酶(≥4 000 U/g):上海源叶生物科技有限责任公司;木瓜蛋白酶(≥50 万U/g):北京奥博星生物技术有限责任公司;木聚糖酶(≥5 000 U/g):江苏锐阳生物科技有限公司。
1.2 仪器与设备
HC-3018 高速离心机:安徽中科中佳科学有限公司;GZX-9076 数显鼓风干燥箱:上海博迅实验有限公司医疗设备厂;Waters e2695 高效液相色谱仪(示差折光检测器):科沃安生物科技有限公司;IRSffinity-1 傅里叶变换红外分光光度计:日本岛津公司。
1.3 试验方法
1.3.1 膳食纤维的制备
原马铃薯渣膳食纤维:参考莎日娜等[13]的方法,将干燥的马铃薯渣粉碎过筛后,按1 ∶10(g/mL)的料液比加入蒸馏水,调pH 值至6.0,加入α-淀粉酶和木瓜蛋白酶,60 ℃酶解30 min,去除淀粉和蛋白质,灭酶冷却后加4 倍体积95%的乙醇,沉淀1 h,抽滤得到滤渣即为马铃薯渣膳食纤维,记为O-DF。
改性马铃薯渣膳食纤维:将原马铃薯渣膳食纤维按 1 ∶10(g/mL)的料液比加入蒸馏水,调 pH 值至 5.0,加入6%的纤维素酶或木聚糖酶(复合酶按1 ∶1 质量比混合),50 ℃酶解2 h,冷却后抽滤得到滤渣即为改性马铃薯渣膳食纤维,在干燥箱烘干备用。
DF:灭酶冷却后用95 %乙醇醇沉后抽滤得到的滤渣;IDF:灭酶冷却后直接抽滤得到的滤渣;SDF:抽滤得到的滤液用95%乙醇醇沉后抽滤得到的滤渣。
1.3.2 改性前后马铃薯渣膳食纤维单糖含量的测定
参考 Qi Jing 等[16]的方法,准确称取(200±1)mg 1.3.1 节中制取的样品于试管中,每支试管加入(2.00±0.10)mL72%的H2SO4,搅拌至其充分水解;然后加入28.00 mL 去离子水,使H2SO4稀释到7%,混合均匀,密封好后置于压力锅中,于121℃反应60 min,反应结束后冷却至25 ℃。
色谱条件:采用Waters 2414 示差折光检测器,色谱柱为Aminex HPX-87H column(300 mm×7.8 mm,9 μm),流动相为 5 mmol/L H2SO4;进样体积是 20 μL;流速为0.5 mL/min;柱温和检测器温度均为50 ℃。通过样品与标准品物质进行比对进行定性分析,采用外标法进行定量分析。
1.3.3 改性前后马铃薯渣膳食纤维理化指标的测定
1.3.3.1 持水力的测定
准确称量1.000 g 样品于离心管中,加入20 mL 蒸馏水,混匀后静置1 h,在6 000 r/min 的转速下离心10 min,弃上清液,称离心管和沉淀质量m1[17]。

式中:m0为离心管质量,g;m 为干燥样品质量,g;m1为离心管和沉淀质量,g。
1.3.3.2 持油力的测定
准确称量1.000 g 样品于离心管中,加入20 mL 亚麻籽油,混匀后静置1 h,在6 000 r/min 的转速下离心10 min,弃上层油,称离心管和沉淀质量m1[18]。
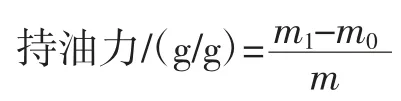
式中:m0为离心管质量,g;m 为干燥样品质量,g;m1为离心管和沉淀质量,g。
1.3.3.3 溶解度的测定
准确称取1.000 g 样品于烧杯中,加入10 mL 蒸馏水,混匀后,25 ℃下静置1h,在 6 000 r/min 的转速下离心10 min,收集上清液于平皿中,烘干称重m1。
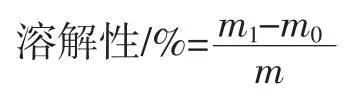
式中:m1为烘干后的上清液+平皿质量,g;m0为平皿的质量,g;m 为样品质量,g。
1.3.3.4 结合水力的测定
在锥形瓶中加入1.000 g 样品,加入30 mL 蒸馏水,混匀后37 ℃水浴加热1 h,用真空泵抽滤,记录滤渣重量m1,将滤渣烘干至恒重后称重m2。

式中:m1为湿滤渣质量,g;m2为滤渣烘干至恒重后的质量,g;m 为样品质量,g。
1.3.4 阳离子交换力的测定
在锥形瓶中加入1.000 g 样品和15 mL 的0.1 mol/L的HCl 溶液,置于37 ℃水浴锅中24 h,将样品取出后用真空泵进行抽滤,之后用蒸馏水冲洗至滤渣中不再含有Cl-(用AgNO3溶液检验),将滤渣转移到锥形瓶中,加入100 mL 15 g/100 mL 氯化钠溶液,摇匀,加入酚酞,用0.1 moL/L 的氢氧化钠溶液进行滴定,淡红色为终点,记录氢氧化钠溶液所用体积V1(mL)。同时以蒸馏水代替氯化氢溶液做空白试验并记录氢氧化钠溶液所用体积V0(mL)[19-20]。

式中:m 为样品质量,g;V1为测定时氢氧化钠溶液所用体积,mL;V0为空白试验氢氧化钠溶液所用体积,mL。
1.3.5 红外光谱测定方法
分别取少量烘干至恒重的4 种膳食纤维粉末及KBr 粉末以1 ∶100 的质量比混合,放入玛瑙研钵中研磨均匀后压片处理,并对样品进行扫描。扫描条件:以KBr 为空白,扫描次数 32 次,扫描范围(4 000 cm-1~450 cm-1),扫描分辨率为 4 cm-1。
1.4 统计分析
本试验数据均为3 个平行样的平均值,结果采用SPSS20.0 分析软件和Origin7.5 进行处理,并对数据进行差异显著性分析(p<0.05)。
2 结果与分析
2.1 单糖组分分析
原马铃薯渣膳食纤维和纤维素酶、木聚糖酶、复合酶改性后膳食纤维的单糖组成及所占百分比如表1所示。
4 种样品均含有半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖、木糖这5 种单糖组分,且均以葡萄糖为主,其次是半乳糖醛酸、半乳糖和木糖,阿拉伯糖含量均低于5%,说明马铃薯渣膳食纤维主要由纤维素中葡聚糖、半纤维素中木聚糖和阿拉伯木聚糖、果胶中聚半乳糖醛酸、果胶类物质中聚半乳糖构成。

表1 马铃薯渣膳食纤维改性前后单糖组分分析Table 1 Analysis of monosaccharide compositions before and after modified potato dregs dietary fiber
由表1 中还可得知,不同酶法改性前后膳食纤维中各单糖含量有显著性差异。与原马铃薯渣膳食纤维相比,纤维素酶改性后,膳食纤维中半乳糖醛酸、半乳糖含量分别由10.14%、13.52%提高至14.82%、14.55%(p<0.05),葡萄糖含量由55.25%降低到49.22%(p<0.05),这可能是由于纤维素酶作用于纤维素,使部分不溶性纤维转化成果胶和果胶类可溶性多糖,同时构成纤维素的葡聚糖减少。木聚糖酶改性后,膳食纤维中阿拉伯糖提高到4.79%(p<0.05),木糖和葡萄糖分别降低到9.97%、52.53%(p<0.05),可能是由于木聚糖酶降解半纤维素,使以木糖为主链的不溶性阿拉伯木聚糖转化成可溶性木聚糖,同时以β-吡喃葡聚糖为主链的木糖葡聚糖转化成阿拉伯半乳聚糖等可溶性低聚糖[21-22]。复合酶改性后膳食纤维中半乳糖醛酸、半乳糖、阿拉伯糖含量分别为15.19%、18.61%、4.85%,显著高于纤维素酶改性和木聚糖酶改性;同时葡萄糖和木糖含量也显著低于其他两种酶法改性。由此可以看出,纤维素酶和木聚糖酶对马铃薯渣膳食纤维进行复合改性是正协同作用,使纤维素和半纤维素转化成可溶性低聚糖,即IDF 向SDF 转化,进而获得高品质膳食纤维[23]。
2.2 不同酶处理改性后的马铃薯膳食纤维持水力的比较
不同酶处理改性后的马铃薯膳食纤维的持水力结果见图1。
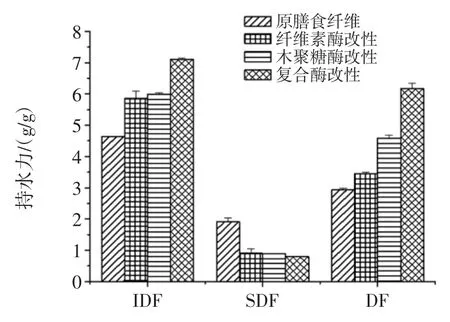
图1 不同酶处理改性后的马铃薯膳食纤维的持水力Fig.1 Water holding capacity of the potato dietary fiber with different enzymatic modifications
由图1 可知,经过不同酶法改性后马铃薯渣IDF和DF 的持水力均有所提高,其中复合酶改性的效果更为显著,这可能是由于纤维素酶和木聚糖酶酶协同作用使DF 和IDF 结构变得疏松,增大了与水分的接触面积。原马铃薯渣DF 持水力为2.93 g/g,经纤维素酶、木聚糖酶以及复合酶改性后DF 的持水力分别为3.46、4.59、6.29 g/g,与原 DF 相比分别提高了 18 %、57%和115%。如图所示,经不同酶改性后IDF 的持水均有所增加,SDF 却均降低。这可能是由于经过酶法改性后IDF 的分子链被酶切断,空间网状结构遭到破坏,更多亲水基团暴露,增加了与水的接触面积使得其持水力有所提高[24]。
2.3 不同酶处理改性后的马铃薯膳食纤维持油力的比较
不同酶处理改性后的马铃薯膳食纤维的持油力结果见图2。
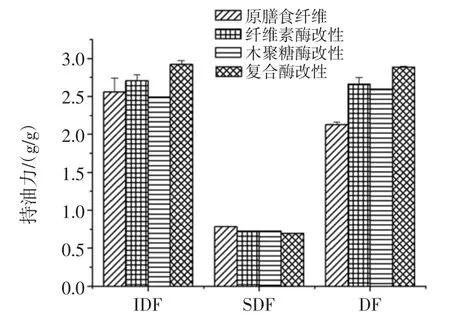
图2 不同酶处理改性后的马铃薯膳食纤维的持油力Fig.2 Oil holding capacity of the potato dietary fiber with different enzymatic modifications
由图2 可知,与原马铃薯渣膳食纤维相比,经纤维素酶、木聚糖酶、复合酶改性后DF 的持油力均有所提高,由 2.13 g/g 分别提高到 2.6、2.60、2.89 g/g,且分别提高了30%、8.2%和16.73%。这是由于酶法改性能改变DF 化学结构,暴露出一些亲油基团,改性后DF 与油脂之间的结合能力增强,宏观上呈现了持油力的提高。不同酶法改性后DF 持油力的强弱次序为复合酶改性>纤维素酶改性>木聚糖酶改性,复合酶改性效果显著,而木聚糖酶改性低于其他两种酶法改性可能是由于木聚糖酶对于马铃薯DF 水解程度过高,破坏了基础的空间网状结构,使其降低了对油脂的吸附能力,其次是由于原有的亲水性基团暴露出来,让持油力出现了下降的现象[25]。
2.4 不同酶处理改性后的马铃薯膳食纤维结合水力的比较
不同酶处理改性后的马铃薯膳食纤维的结合水力结果见图3。

图3 不同酶处理改性后的马铃薯膳食纤维的结合水力Fig.3 Water binding capacity of the potato dietary fiber with different enzymatic modifications
由图3 可知,与原马铃薯渣DF 相比,纤维素酶、木聚糖酶、复合酶改性后DF 结合水力由4.71 g/g 分别提高到 5.12、5.19、5.99 g/g,且分别提高了 8.7%、10.19%和27.18%。马铃薯渣IDF 和DF 的结合水力的强弱次序均为复合酶改性>木聚糖酶改性>纤维素酶改性,复合酶改性的效果更为显著。这是由于酶改变纤维结构,使亲水基团暴露,空间网状结构的面积增加,更多水分子被束缚在网状结构内,从而表现为结合水力的增加[26]。
2.5 不同酶处理改性后的马铃薯膳食纤维溶解度的比较
不同酶处理改性后的马铃薯膳食纤维溶解度结果见图4。
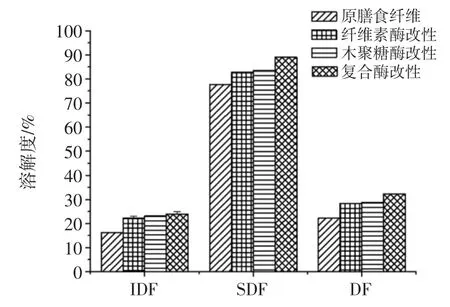
图4 不同酶处理改性后的马铃薯膳食纤维溶解度Fig.4 Solubility of the potato dietary fiber with different enzymatic modifications
由图4 可知,SDF 溶解度最高,改性后均达到80%以上,IDF 和DF 经不同酶法改性后溶解度也均有提高,其中复合酶改性的效果最显著。与原马铃薯渣DF相比,经纤维素酶、木聚糖酶、复合酶改性后DF 溶解度由22.22%分别提高到28.38 %、28.71 %、32.28 %,且分别提高了27.72%、29.21%、45.27%。这可能是由于纤维素酶和木聚糖酶分别作用于不溶于水的纤维素和半纤维素,使其分子间氢键等键合力断裂,形成无序结构,可溶性小分子增加,从而表现为溶解度的增加[5,27]。
2.6 不同酶处理改性后的马铃薯膳食纤阳离子交换力的比较
不同酶处理改性后的马铃薯膳食纤维的阳离子交换力结果见图5。
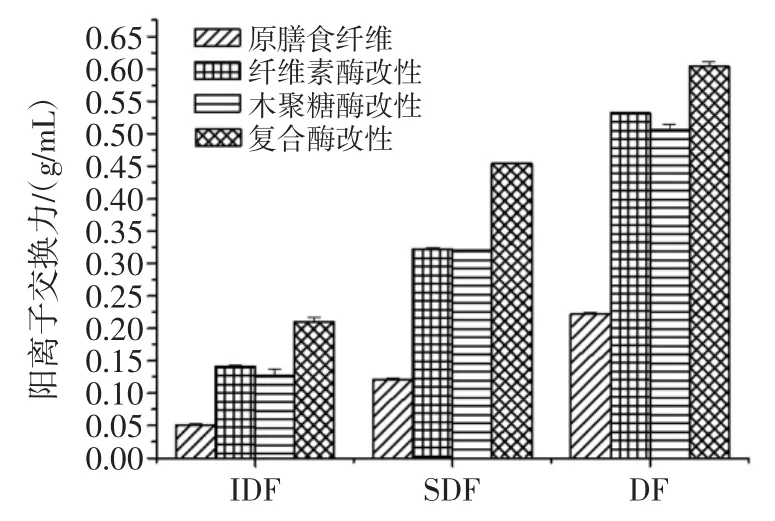
图5 不同酶处理改性后的马铃薯膳食纤维的阳离子交换力Fig.5 Cation exchange force of the potato dietary fiber with different enzymatic modifications
由图5 可知,纤维素酶、木聚糖酶、复合酶改性后马铃薯渣IDF、SDF、DF 的阳离子交换力均有提高,说明纤维素酶和木聚糖酶均可使膳食纤维的长链断裂,羧基、羟基等弱酸性基团暴露出来,离子结合位点增加,同时比表面积增大,最终表现为阳离子交换力增大。图中还显示,木聚糖酶改性IDF、SDF、DF 的阳离子交换力均大于纤维素酶改性,说明木聚糖酶可以使更多的侧链基团暴露出来。原马铃薯渣DF 的阳离子交换力为0.22 mL/g,改性后分别提高到0.53 mL/g(纤)、0.50 mL/g(木)、0.60 mL/g(复合)且分别提高了 141%、127%和173%。
2.7 不同酶处理改性后的马铃薯膳食纤维红外光谱分析
不同酶法改性前后马铃薯渣膳食纤维的红外光谱测定结果见图6。

图6 不同酶处理改性后的马铃薯膳食纤维红外光谱图Fig.6 FTIR spectra of the potato dietary fiber with different enzymatic modifications
从图6 中可以看出,原马铃薯渣膳食纤维和3 种酶法改性后的膳食纤维在某些波长处的吸收峰相似,只是吸收峰的强度和面积发生了改变。在3 500 cm-1~3 000 cm-1出现的宽峰是纤维素和半纤维素中O-H的伸缩振动,3 种酶法改性后的膳食纤维在此处吸收峰都比原膳食纤维宽,其中复合酶改性膳食纤维差异最显著(p<0.01),这是由于纤维素酶和木聚糖酶分别水解纤维素和半纤维素,使多糖糖苷键断裂,游离羟基增多,从而使羟基的吸收峰增强[28]。在2 921 cm-1处波动范围是糖类亚甲基上的C-H 伸缩振动特征峰;1 027 cm-1处波动范围是纤维素和半纤维素中C-O 的伸缩振动,3 种酶法改性后此处吸收峰强度都增强,其中纤维素酶改性后膳食纤维在1 027 cm-1处吸收峰显著增强。木聚糖酶和复合酶改性后膳食纤维在1 241 cm-1和898 cm-1附近出现的小峰分别是半纤维素中C=O 和阿拉伯糖基伸缩振动引起的,而其他两种膳食纤维中未出现这两种峰,这是由于木聚糖酶水解半纤维素,产生阿拉伯木聚糖,从而出现特征吸收峰[29]。在1 735 cm-1处波动范围是木质素中苯环特征吸收峰;在1 614 cm-1处波动范围是糖醛酸C=O 吸收峰,3 种酶法改性后此峰强度均增加,其中复合酶改性后膳食纤维在此波数处吸收峰显著增强,表明两种酶作用下纤维素和半纤维素同时被分解成可溶性小分子,氢键断裂,产生更多纤维二糖及短链糖类[30]。
3 结论
本试验对比了不同酶法处理后马铃薯渣膳食纤维的单糖组分和理化性质,研究表明,纤维素酶和木聚糖酶复合处理比用单一酶处理更显著提高了马铃薯渣膳食纤维功能性单糖含量及其理化性质。单糖测定结果表明,3 种酶法改性后膳食纤维中均含有葡萄糖、半乳糖、半乳糖醛酸、阿拉伯糖、木糖5 种单糖,各单糖含量差异显著(p<0.05)。复合酶改性后膳食纤维持水力、持油力、结合水力、溶解度、阳离子交换力分别为 6.29 g/g、2.89 g/g、5.99 g/g、32.28%、0.60 mL/g,与原膳食纤维相比较分别提高了115.22%、16.73%、27.18%、45.27%、173.18%。原马铃薯渣膳食纤维和3 种酶法改性后的膳食纤维在某些波长处出现相似吸收峰,但吸收峰的强度和面积发生了改变。
