沉默A20基因对人喉鳞癌细胞系Hep-2增殖、周期、侵袭能力的影响
2020-03-09罗德艳冯俊彭涛唐一萍
罗德艳,冯俊,彭涛,唐一萍
南充市中心医院,四川南充 637000
喉癌是临床常见头颈部恶性肿瘤,其最主要病理学类型为喉鳞癌,占90%以上。喉鳞癌近年来发病率升高,但在医疗水平提升及新的高效抗癌药物应用情况下患者整体预后未显著改善,而肿瘤增殖、侵袭、转移等生物学特性是其重要原因[1]。因此,探寻恶性肿瘤的治疗靶点尤为必要。肿瘤坏死因子α诱导蛋白3(A20)是锌指结构蛋白,可调节免疫应答、基因转录、细胞受体功能等。研究[2~4]表明,A20基因在乳腺癌、胆管癌、急性淋巴细胞白血病等恶性肿瘤中均存在相对异常高表达,与肿瘤发生发展密切相关,沉默A20基因能够抑制肿瘤细胞的增殖、侵袭等生物学行为。但目前尚未明确A20基因在喉鳞癌中的生物学功能。2019年1~6月,本研究则应用RNA干扰技术,特异性沉默人喉鳞癌Hep-2细胞中A20基因表达,观察A20基因对喉鳞癌Hep-2细胞增殖、周期、侵袭能力的影响。
1 材料与方法
1.1 细胞、仪器及试剂 ①细胞:Hep-2细胞由华西医学实验中心惠赠。②主要仪器:荧光定量PCR仪(美国Stratagene);电泳仪、凝胶成像分析系统、酶标仪(美国Bio-Rad);倒置光学显微镜(日本Olympus);紫外分光光度仪、CO2培养箱(美国Thermo)。③主要试剂:RPMI1640培养基、胎牛血清(美国Hyclone);Lipofectamine RNAiMAX转染试剂(美国Invitrogen);胰蛋白酶(美国Sigma);总RNA提取、逆转录试剂盒(北京艾德莱生物科技);A20 siRNA及阴性对照siRNA(NC siRNA)(上海吉玛制药技术公司);BCA蛋白测定试剂(北京赛驰生物科技公司);A20多克隆抗体、β-actin单克隆抗体(美国sigma);辣根过氧化物酶标记的IgG二抗(美国Bioworld);细胞蛋白提取试剂盒(上海碧云天生物技术公司);A20基因引物、内参引物(苏州金唯智生物科技有限公司合成);Transwell小室(美国Corning)。
1.2 Hep-2细胞培养、分组及转染 Hep-2细胞采用RPMI1640培养基(含胎牛血清10%)在37 ℃、5%CO2饱和湿度条件下常规培养、传代;取对数生长期Hep-2细胞,接种至6孔板,待细胞融合达80%~90%时进行分组,实验共分为A20 siRNA组、NC siRNA组、对照组,A20 siRNA组、NC siRNA组应用Lipofectamine RNAiMAX转染试剂分别转染A20 siRNA、NC siRNA,转染操作严格按照试剂盒说明书操作,对照组不做任何处理。
1.3 Hep-2细胞A20 mRNA、蛋白检测方法 ①A20 mRNA:采用荧光定量PCR法。收集转染后48 h的3组细胞,提取细胞总RNA,紫外分光光度仪测定RNA含量,总RNA逆转录,合成cDNA;后行PCR扩增,以β-actin为内参。PCR反应条件:预变性94 ℃、10 min,变性94 ℃、30 s,退火60 ℃、30 s,延伸72 ℃、30 s,40个循环。用2-ΔΔCt公式计算A20mRNA的相对表达量,实验重复3次,取3次实验的平均值。②A20蛋白:采用Western blotting法。收集转染后48 h的3组细胞,分别提取细胞总蛋白,裂解细胞提取蛋白,BCA检测蛋白,取20 μL总蛋白经SDS-PAGE电泳后转移至PVDF膜,封闭2 h,加一抗A20稀释(工作浓度1∶300),4 ℃孵育过夜。TTBS洗脱后,加二抗(工作1∶2 000稀释),室温孵育2 h。增强化学发光显色法实施条带显色,以β-actin蛋白为内参,实验重复3次,取3次实验的平均值。
1.4 Hep-2细胞增殖能力观察方法 ①光密度值(OD值):采用CCK8实验。收集3组细胞,将细胞消化离心,以3 000个细胞/孔、200 μL/孔体积,将细胞接种在96孔板中,37 ℃、5%CO2培养。在转染后24、48、72 h,各孔避光加入CCK8细胞增殖试剂10 μL。培养4 h后,酶标仪检测OD值,实验重复3次,取3次实验的平均值。②克隆数:采用平板克隆形成实验。将转染48 h的3组细胞分别接种至6孔板(每孔200个),每类细胞设置3个复孔,培养箱培养2周;后PBS洗涤、多聚甲醛4%固定20 min;吸除甲醛,结晶紫染色15 min,洗除染液,显微镜计数克隆数,实验重复3次,取3次实验的平均值。
1.5 Hep-2细胞周期观察方法 采用流式细胞术。收集转染48 h的3组细胞,PBS洗涤、离心,加75%预冷乙醇固定,4 ℃过夜;PBS洗涤,加碘化丙啶、RNase各50 μg/mL,避光4 ℃染色20 min。每样本收集10 000个荧光信号,MuticycleAV软件分析细胞周期,计算G0/G1期、S期、G2/M期细胞占总细胞的百分比,实验重复3次,取3次实验的平均值。
1.6 Hep-2细胞侵袭能力观察方法 采用Transwell侵袭实验。细胞转染后48 h,采用无血清培养基分别对3组细胞进行培养12 h。胰酶消化,制备细胞悬液,调整细胞浓度为2×106个/mL;在Transwell小室上室中加不同的细胞悬液100 μL,每组均设3个复孔;下室中各孔加入600 μL含FBS 20%的RPMI1640培养基,孵育12 h。取出小室,吸除培养液,将未穿过ECMatrix膜的细胞除去,对小室染色,显微镜观察,随机选取5个高倍视野计数穿过ECMatrix膜的细胞数,实验重复3次,取3次实验的平均值。
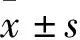
2 结果
2.1 各组细胞A20 mRNA、蛋白表达比较 A20 mRNA、蛋白表达比较见表1。
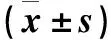
表1 各组A20 mRNA、蛋白表达比较
注:与对照组比较,①P<0.05;与NC siRNA组比较,②P<0.05。
2.2 各组细胞OD值及克隆数比较 各组细胞不同时点OD值比较见表2。A20 siRNA组、NC siRNA组、对照组细胞克隆数分别为(123.58±15.69)、(229.65±31.58)、(231.65±32.47)个,A20 siRNA组与NC siRNA组、对照组比较,P均<0.05。
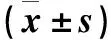
表2 各组细胞不同时点OD值比较
注:与对照组比较,①P<0.05;与NC siRNA组比较,②P<0.05。
2.3 各组细胞G0/G1期、S期、G2/M期比例比较 细胞G0/G1期、S期、G2/M期比例比较见表3。
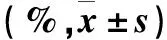
表3 各组细胞G0/G1期、S期、G2/M期比例比较
注:与对照组比较,①P<0.05;与NC siRNA组比较,②P<0.05。
2.4 各组细胞穿膜细胞数比较 A20 siRNA组、NC siRNA和对照组穿膜细胞数分别为(31.25±4.82)、(84.00±9.95)、(86.35±10.02)个,A20 siRNA组与NC siRNA组、对照组比较,P均<0.05。
3 讨论
喉癌是头颈部常见的恶性肿瘤之一,在世界范围内发病率位居头颈部恶性肿瘤第2位,位居所有恶性肿瘤第11位,主要的病理类型为鳞状细胞癌[5]。近年来,我国喉癌的发病率呈逐年升高的趋势,尤其是在中国的东北部地区[6]。虽然外科手术、放化疗等传统治疗方式已取得显著进展,但由于喉癌的低治愈率和治疗后对患者喉功能和生活质量的影响原因[7,8],因此尚无令人满意的治疗方法,临床上亟需新的喉癌治疗策略[9]。目前,喉癌的发病机制尚不完全清楚,吸烟、饮酒、空气污染、职业因素等均为其发病危险因素。研究证实,在喉癌的发生进展中存在许多癌基因或抑癌基因的异常激活或失活,但至今尚未发现影响喉癌发生进展的关键基因[10]。
A20基因是细胞凋亡通路的重要抑制基因,是由TNF介导的NF-κB活化诱导的蛋白质,能够调节NF-κB。目前研究表明,A20基因是多类恶性肿瘤(胶质瘤、淋巴瘤、胰腺癌等)的易感基因[11~14]。而A20基因在不同肿瘤中可能具备各异的生物学功能,如在胰腺癌组织中表达较正常组织低;在淋巴瘤中A20失活,在胶质瘤中表达较正常组织高等[15~17]。Hadisaputri等[18]发现,siRNA抑制A20基因后食管鳞癌细胞增殖侵袭明显减少,A20基因可能作为食管鳞癌生存率低的独立预后指标。另有资料显示,在肝癌组织中A20基因表达升高与预后关系密切,降低A20基因表达能够诱导肿瘤细胞凋亡,抑制细胞增殖[19,20]。近年也有学者针对耐药问题展开研究,发现A20基因异常表达可造成细胞抗凋亡,致使细胞凋亡水平下降,进而导致癌细胞对药物敏感性降低,产生耐药[21]。上述文献说明,A20基因与肿瘤的发生、发展、转归、药物抵抗均有联系。作用考虑与A20基因既能够通过对靶细胞蛋白的泛素化修饰以调节机体炎症反应、免疫应答,又可对TNF-ɑ介导的细胞凋亡实施去泛素化修饰以发挥负调控效用有关。RNA干扰技术涉及转录后基因沉默,是一种有效的代替基因敲除工具,目前已凭借其高效性、高特异性等特征而作为新实验方式应用于肿瘤细胞信号通路及特定基因功能的研究中[22,23]。本研究显示,A20 siRNA组A20基因mRNA和蛋白表达水平低于NC siRNA组、对照组。说明构建A20 siRNA表达载体能够特异性封闭A20蛋白,且蛋白水平下降与mRNA下降是平行的。CCK8实验显示,A20 siRNA组OD值、克隆数低于NC siRNA组、对照组;流式细胞术提示,细胞周期G0/G1比例明显上升,S期和G2/M期比例明显下降,提示转染A20 siRNA后Hep-2细胞增殖水平受到显著抑制,A20 siRNA可使喉鳞癌Hep-2细胞周期阻滞于G0/G1期,特异性抑制细胞分裂。Transwell侵袭实验显示,A20 siRNA组穿膜细胞数低于NC siRNA组及对照组。说明转染A20 siRNA后细胞侵袭能力出现下降。
总之,沉默A20基因后可显著抑制喉鳞癌Hep-2细胞的增殖和侵袭能力,缩短细胞周期,这有望成为喉鳞癌的潜在治疗靶点,但相关机制还有待进一步分析明确。
