噪声暴露对小鼠行为学和海马区即刻早基因表达的影响
2020-03-08陶珊刘秀平卓志强
陶珊 刘秀平 卓志强


[摘要] 目的 觀察小鼠高强度噪声短时暴露后,其行为学的改变,探索噪声对小鼠行为和听力的影响及机制。 方法 选取生后15 d的C57小鼠,随机分为两组,噪声暴露组30只,123 dB SPL白噪声固定时间暴露2 h;对照组30只,正常喂养,2个月后,检测ABR反应阈,将两组小鼠根据是否给予MWM训练再分为两个亚组,剥离小鼠海马,检测氧化应激水平,实时荧光定量PCR 法测定各组小鼠海马组织中即刻早基因IEGs的表达水平。 结果 强噪声单次暴露后2个月,与对照组比较,噪声暴露组动物ABR反应阈升高,小鼠的Morris水迷宫行为表现显著改变,差异有统计学意义(P<0.05);两组小鼠海马组织中氧化应激水平比较,差异无统计学意义(P>0.05)。小鼠海马组织中即刻早基因例如Npas4、Arc的表达量可通过学习与训练来上调,但噪声暴露组动物通过学习训练致使两基因上调的变化低于对照组(P<0.05)。 结论 高强度噪声短时暴露对小鼠的行为和听力有负性影响。学习训练可显著上调小鼠海马组织中即刻早基因的表达,而噪声暴露的作用在统计学上无显著性差异,这可能是噪声影响学习记忆能力的分子机制之一。
[关键词] 噪声;认知功能;氧化应激;海马;即刻早基因
[中图分类号] R285.5 [文献标识码] A [文章编号] 1673-9701(2020)34-0044-04
[Abstract] Objective To observe the behavioral changes of mice exposed to high intensity noise for a short time, and to investigate the impacts of noise on behavior and hearing of mice and its mechanism. Methods C57 mice of 15 days after birth were randomly divided into the noise exposure group(n=30) and the control group(n=30). The noise exposure group was exposed to 123 dB SPL white noise for 2 hours, while the control group was fed normally. After 2 months, the ABR response threshold was detected. The two groups of mice were divided into two subgroups according to whether they were given MWM training or not. The hippocampus of mice was stripped, and the oxidative stress level was detected. The expression level of immediate early genes(IEGs) in hippocampus of mice in each group was determined by real-time fluorescence quantitative PCR method. Results Two months after single exposure to strong noise, compared with the control group, the ABR threshold of animals in the noise exposure group was increased, and the Morris water maze behavior of mice was changed significantly, with statistically significant difference(P<0.05). There was no significant difference in oxidative stress level between the two groups of mice(P>0.05). The expression amount of IEGs such as Npas4 and Arc in hippocampus of mice could be up-regulated by learning and training, but the changes of up-regulation of the two genes in the noise exposure group were lower than those in the control group through learning and training(P<0.05). Conclusion Short-term exposure to high intensity noise has negative impacts on the behavior and hearing of mice. Learning and training can significantly up-regulate the expression of IEGs in hippocampus of mice, while the effect of noise exposure has no statistically significant difference, which may be one of the molecular mechanisms of noise impacting learning and memory ability.
[Key words] Noise; Cognitive function; Oxidative stress; Hippocampus; Immediate early genes
噪声是一种常见的有害因素,其对人体的危害不仅是听力损失,而且对非听觉系统也可以产生不利的影响,可导致学习记忆能力下降、免疫力下降、血压上升等一系列的健康问题[1-2]。婴幼儿因自身发育未成熟,更易受外界环境的影响,如病房持续的噪声对新生儿重症监护室里的患儿有诸多不利影响[3]。本研究通过模拟噪声暴露环境,观察发育早期小鼠给予噪声暴露后,成年小鼠听性脑干反应(Auditory brainstem response,ABR)反应阈值、行为学、氧化应激水平以及海马组织中多种即刻早基因(Immediate early genes,IEGs)的变化情况,探索噪声对学习记忆的影响及可能的发生机制。
1 材料与方法
1.1 仪器与试剂
1.1.1 主要仪器 RZ6听觉电生理系统,美国;Morris水迷宫(Morris water maze,MWM)系统,上海欣软信息科技有限公司;SOD(superoxide dismutase)测定试剂盒、MDA(madondialdehyde)测定试剂盒,南京建成生物工程研究所;Real Time PCR仪,美国ABI公司
1.1.2 主要试剂 戊巴比妥钠,美国;Primer引物,上海捷瑞生物工程有限公司;Prime ScriptTM RT reagent Kit with gDNA Eraser,日本Takara公司
1.2 实验动物及分组
本实验选用生后15 d的C57小鼠,购于江苏大学实验动物中心,动物许可证号为SCXK(苏)2011-0003,饲养于东南大学医学实验动物中心,随机分为两组,即噪声暴露组(30只)与对照组(30只)。遵循东南大学实验动物医学伦理委员会规定。
1.3 噪声暴露
采用123 dB声压级(Sound pressure level,SPL)的白噪声对暴露组小鼠进行固定时间暴露2 h。对照组无噪声暴露,其他条件与暴露组相同。
1.4 实验方法
1.4.1 听觉功能测试 暴露结束2个月后,通过听性脑干反应(ABR)测定小鼠的听力情况,具体操作:将小鼠麻醉后置于固定架上,应用美国TDT(Tucker-Davis Technology)系统Ⅲ和Biosig软件,其中电极的连接方案及参数的设置见参考文献[4],ABR信号为10 ms短纯音,测试频率:2、4、8、16 kHz。测试从90 dB SPL开始,衰减间隔为5 dB,以Ⅲ波存在的最低声强为反应阈值。
1.4.2 行为学测试 Morris水迷宫根据赵瑛等[5]文章的方式进行。将小鼠头朝池壁放入水中,放入的位置随机,先予60 s引导实验,若小鼠60 s内找不到平台,则引导小鼠至平台,使其在平台停留15 s。每只小鼠每天训练4次,每次间隔时间不少于30 min,训练5 d。第6天,撤去隐藏的平台,将小鼠由开始的4个位置放入水中。空间记忆的检测指标:小鼠到达平台所花的时间;撤掉平台后小鼠进入平台范围内的次数。
1.4.3 海马组织SOD含量和MDA活力测定 将小鼠快速处死后取海马组织,分别制备10%组织匀浆,每组10个样本分别测试SOD含量及MDA活力,参照南京建成生物工程研究所试剂盒进行。
1.4.4 荧光实时定量PCR(Quantitative real time-polymerase chain reaction,RT-qPCR)检测 扩增引物:Npas4(Neuronal Per-Arnt-Sim domain protein 4),正向5'-AGCAAGAGCCTGAGCGAAAAGA-3', 反向5'-CTTGGTGGATCGGTACATGACTG-3';Arc(Activity-regulated cytoskeleton-associated protein),正向5'-CTCAGAGGAGTTCTTAGCCTGTTCG-3',反向5'-ATC TCAGCTCGGCACTTACCAAT-3';β-Actin正向5'-TGAGAGGGAAATCGTGCGTGAC-3',反向5'- GCTC GTTGCCAATAGTGATGACC-3'。PCR引物由TaKaRa宝生物工程有限公司设计,海马组织中的总RNA由Trizol试剂提取,并及鉴定RNA样品的浓度及纯度。通过实时荧光定量PCR系统,β-Actin作为内参行實时逆转录PCR(qRT-PCR),计算Npas4及Arc两者mRNA的相对表达量。
1.5 统计学方法
采用SPSS20.0统计学软件,数据经过正态性检验,且全部符合正态分布,计量数据采用均数±标准差(x±s)表示,采用t检验及进行单因素或双因素ANOVA分析,P<0.05为差异有统计学意义。
2 结果
2.1 两组小鼠ABR反应阈值比较
两组小鼠噪声暴露后ABR反应阈值比较,在多个频率,噪声暴露组小鼠ABR反应阈显著高于对照组,差异有统计学意义(P<0.05)。见表1。
2.2 行为学测试结果
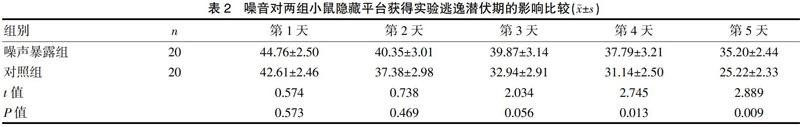
2.2.1 隐藏平台获得实验 在前5 d训练阶段的实验中,两组小鼠的逃避潜伏期在第1~3天,差异无统计学意义(P>0.05)。但在第4天、第5天,两组小鼠找到平台的时间比较,差异有统计学意义(P<0.05)。见表2。
2.2.2 空间定向实验 空间定向实验中,噪声暴露组小鼠穿越平台次数减少,即(2.19±0.27)次,而对照组小鼠为(3.61±0.42)次,差异有统计学意义(t=3.173,P=0.005)。
2.3 两组海马组织SOD含量和MDA活力测定
噪声可引起机体氧化应激反应,利用商品化试剂盒检测了小鼠海马组织中MDA的含量及SOD的活性。噪声暴露组、对照组SOD含量及MDA活力见表3,两组比较,差异无统计学意义(P>0.05)。
2.4 噪声暴露后2个月海马中的基因表达情况比较
有训练对照组、无训练对照组、有训练噪声组、无训练噪声组,这四个组进行交叉比较,Npas4及Arc基因表达量的情况见表4。对噪声暴露及训练做双因素方差分析,Npas4及Arc两基因的表达水平,提示训练的作用比较,差异有统计学意义(P<0.05),而噪声的作用比较,差异无统计学意义(P>0.05)。
3 讨论
随着环境污染的加重,人们越来越关注噪声暴露的危害。噪声暴露不仅可以对听觉系统产生不良的影响,而且对非听觉系统的影响更深、更广,可引起心率及血压等的变化,并产生应激相关的激素,导致机体焦虑、学习记忆能力下降等[6]。
婴幼儿因自身发育未成熟,易受外界环境的影响,如病房持续的噪声等。研究报道新生儿重症监护室(Neonatal intensive care unit,NICU)噪声水平远高于美国儿科学会推荐的NICU噪声控制标准[7]。而噪声对婴幼儿可产生诸多不利影响,如心率增快、血压上升、血氧饱和度下降、听力损伤、睡眠障碍等,甚至可以影响新生儿神经系统的发育,导致成年期的认知困难等[8]。
中枢的听觉通路与大脑的边缘系统和皮层存在广泛的神经联系,因此噪声暴露可引发认知相关的神经系统功能发生异常,与神经系统相关疾病具有一定的关联性[9-10]。相关的实验研究提示,噪声可影响大鼠的空间学习记忆能力,其可能机制是损伤海马的神经细胞再生功能,引起神经递质传导过程障碍[11]。研究显示噪音暴露的动物空间学习记忆都会受损[12]。
研究发现,小鼠出生后第10~14天,听力功能才开始出现,生后第14天小鼠耳蜗的功能基本成熟[13]。而此时大脑的发育尚未完成[14]。通过检索文献,听觉系统发育关键期是出生后的早期,其发育的关键期会随年龄增长消失,因此研究小鼠在出生后15 d对噪声暴露的影响可间接提示出生早期的相关情况,在本研究中,选择在听觉发育关键期(P15)建立模型。
实验研究显示,听力正常的小鼠噪声暴露后ABR发生明显阈移,且ABR的阈值明显提高[15-16]。这与本实验结果一致。本研究结果显示,噪声组小鼠的听觉阈值在多个频率均显著高于对照组(表1),提示发育早期噪声暴露对C57小鼠听觉系统有不良影响。
Morris水迷宫是用来检测空间学习及记忆能力的经典行为学实验,具有良好的记忆量化指标[17]。前5 d的定航实验主要检测小鼠的学习能力,潜伏期的延长可提示空间学习能力的降低;第6天的空间测试阶段测试小鼠的记忆能力。本研究Morris水迷宫试验结果显示,前5 d训练阶段的实验中,两组小鼠的潜伏期在第1、2、3天差异无统计学意义,但在第4、5天噪声组的逃避潜伏期比对照组明显延长,并且在第6天测试阶段跨台次数明显减少,差异有统计学意义(P<0.05),提示噪声可影响小鼠的空间学习及记忆能力。
强噪声暴露可致海马组织中抗氧化酶及自由基清除剂的活性下降,使其氧化和抗氧化体系统的平衡失调,引起氧化应激反应,最终机体内产生过多的氧化应激产物及炎症因子等[18],超过机体的清除能力,脂质的过氧化反应将生成多余的脂质过氧化物,最终分解为丙二醛(MDA),引起海马组织DNA损伤及蛋白质表达的异常。超氧化物歧化酶(SOD)可清除氧自由基,是机体的一道保护防线。
研究表明,持续的噪声暴露,小鼠海马组织中的SOD含量显著降低,MDA含量明显上升,提示噪声暴露导致学习记忆能力下降的主要原因是由于海马组织自由基代谢异常,神经系统的结构发生退变引起的[19-20]。本研究结果显示,与对照组相比,噪声组SOD及MDA水平差异无统计学意义,这可能是因为机体的氧化应激水平的变化是短暂的,而本研究观察的氧化应激水平是噪声暴露后2个月的长期效应。
外周听觉系统的损伤可导致各级听觉神经轴神经元的破坏,影响神经递质的传递及细胞内的代谢。研究发现,海马组织内有多种学习记忆相关联的即刻早基因(IEGs),它们能将神经元的活性及可塑性与学习相关的基因转导相关联起来[21-22]。Npas4即神经元PAS结构域蛋白,可用于神经元突触的连接部位,在神经突触可塑性及学习记忆的形成过程中起重要作用[23]。Arc即活性调节基因,可通过脑源性神经营养因子,调节神经信号通路,促进神经突触的可塑性[24]。研究报道,噪声暴露或認知训练引起海马组织中相关IEGs表达的改变[25]。
[参考文献]
[1] Mathias B,Mark B,Abigail B,et al. ICBEN review of research on the biological effects of noise 2011-2014[J]. Noise & Health,2015,17(75):57-82.
[2] Amirreza AM,Yahya R,Tohid K,et al. Inflammatory and immunological changes caused by noise exposure:A systematic review[J]. Journal of Environmental Science and Health Part C,Toxicology and Carcinogenesis,2020,38(1):61-90.
[3] 曹霞,李仁凤,李梅,等.新生儿重症监护室声光触环境因素对低体质量早产儿生理功能的影响及改进方案[J].中国实用护理杂志,2020,36(4):284-288.
[4] 张纪帅,陈星睿,吴军,等.白噪声暴露前后豚鼠听觉功能的检测[J].中华耳科学杂志,2015,13(1):141-144.
[5] 赵瑛,高伟莹,余群星,等.基于Morris水迷宫的小鼠学习记忆规律研究[J].哈尔滨商业大学学报(自然科学版),2020,36(2):131-136,141.
[6] Charlotte C,Clare C,Notley,et al. Evidence for environmental noise effects on health for the united kingdom policy context:A systematic review of the effects of environmental noise on mental health,wellbeing,quality of life,cancer,dementia,birth,reproductive outcomes,and cognition[J]. International Journal of Environmental Research and Public Health,2020,17(2):1-34.
[7] Smith S,Ortmann A,Clark W. Noise in the neonatal intensive care unit:A new approach to examining acoustic events[J].Noise and Health,2018,20(95):121-130.
[8] Santos J,Pearce SE,Stroustrup A.Impact of hospital-based environmental exposures on neurodevelopmental outcomes of preterm infants[J]. Current Opinion in Pediatrics,2015,27(2):254-260.
[9] L Us,G Cl,R Gl. Effects of loud noise on hippocampal and cerebellar-related behaviors.Role of oxidative state[J].Brain Research,2010,1361:102-114.
[10] Oscar GP,Oscar CC,Fernando JH,et al. Stress by noise produces differential effects on the proliferation rate of radial astrocytes and survival of neuroblasts in the adult subgranular zone[J]. Neuroscience Research,2011,70(3):243-250.
[11] Cui B,Wu M,She X. Effects of chronic noise exposure on spatial learning and memory of rats in relation to neurotransmitters and NMDAR2B alteration in the hippocampus[J].Japan Society for Occupational Health,2009, 51(2):152-158.
[12] Lijie L,Pei S,Tingting H,et al. Noise induced hearing loss impairs spatial learning/memory and hippocampal neurogenesis in mice[J]. Scientific Reports, 2016,6(1):31-34.
[13] Mikaelian D,Ruben RJ.Development of hearing in the normal Cba-J mouse:Correlation of physiological observations with behavioral responses and with cochlear anatomy[J].Taylor & Francis,2009,59(2-6):451-461.
[14] Semple BD, Blomgren K, Gimlin K, et al. Brain development in rodents and humans: Identifying benchmarks of maturation and vulnerability to injury across species[J]. Progress in Neurobiology,2013,106: 1-16.
[15] 楊卫平,许阳,胡博华,等.耳蜗基底膜组织巨噬细胞对噪声的反应[J].中华耳科学杂志,2018,16(1):73-79.
[16] Galle N,Marie-Pierre P,G Lpc.Use of the guinea pig in studies on the development and prevention of acquired sensorineural hearing loss,with an emphasis on noise[J].The Journal of the Acoustical Society of America,2019, 146(5):3743-3769.
[17] 楊玉洁,李玉姣,李杉杉,等.用于评价大小鼠学习记忆能力的迷宫实验方法比较[J].中国比较医学杂志,2018, 28(12):129-134.
[18] Molina SJ,Miceli M,Guelman LR. Noise exposure and oxidative balance in auditory and extra-auditory structures in adult and developing animals. Pharmacological approaches aimed to minimize its effects[J]. Pharmacological Research,2016, 109:86-91.
[19] Manikandan S,Padma MK,Srikumar R,et al. Effects of chronic noise stress on spatial memory of rats in relation to neuronal dendritic alteration and free radical-imbalance in hippocampus and medial prefrontal cortex[J]. Neuroscience Letters,2006,399(1-2):17-22.
[20] Cheng L,Wang SH,Chen QC,et al. Moderate noise induced cognition impairment of mice and its underlying mechanisms[J]. Physiology & Behavior,2011,104(5):981-988.
[21] S P,E A,S C,et al. Early genomics of learning and memory:A review[J]. Genes,Brain,and Behavior,2006,5(3):209-221.
[22] Kim S,Kim H, Um JW.Synapse development organized by neuronal activity-regulated immediate-early genes[J]. Experimental & Molecular Medicine,2018,50(4):355-363.
[23] Stefano BG,B HMG,P DSN,et al. Genomic decoding of neuronal depolarization by stimulus-specific NPAS4 heterodimers[J]. Cell,2019,179(2):373-391,e27.
[24] Guzowski JF,Setlow B,Wagner EK,et al. Experience-dependent gene expression in the rat hippocampus after spatial learning:A comparison of the immediate-early genes Arc,c-fos,and zif268[J]. The Journal of Neuroscience:The Official Journal of the Society for Neuroscience,2001,21(14): 5089-5098.
[25] Minatohara K,Akiyoshi M,Okuno H. Role of immediate-early genes in synaptic plasticity and neuronal ensembles underlying the memory trace[J]. Frontiers in Molecular Neuroscience,2015,8:78.
(收稿日期:2020-08-31)
