铽掺杂碳点的制备及其抑菌性能
2020-03-07于丽娟杨亚玲李晚谊
李 宏,田 浩,于丽娟,高 哲,杨亚玲,李晚谊,*
(1.云南省农业科学院 农产品加工研究所,云南 昆明 650221; 2.昆明理工大学 生命科学与技术学院,云南 昆明 650500)
随着城市化和工业化的发展,许多环境污染物,如有机染料和工业废水中的微生物被注入水源[1],从而可能导致一些传染病的流行,威胁人类健康[2]。大肠埃希菌是微生物中的重要菌群,人体感染后可引起急性腹泻、呕吐、败血症等。因此,开发适用于处理大肠埃希菌污染的有效技术已成为亟待解决的问题。近年来,碳点光催化技术在解决此类问题上越发展现出其潜力:Venkateswarlu等[3]研发的用真菌衍生的光致发光碳点,对大肠埃希菌具有有效的光诱导杀菌活性;Das等[4]研发的用锌和氮掺杂的蓝绿色发光碳点,在光照条件下对大肠埃希菌同样显示出有效的光催化抑菌效果。
碳点(CDs),是一种尺寸小于10 nm的碳纳米材料[5],因具有低毒性、光学稳定性、环境友好性、生物相容性、高耐光漂白性等优点,近年来受到了广泛的关注[6-7]。通常,碳点表面富含羟基、羧基和胺基等官能团[8],使其具有单分散性强、溶解度高等特点。由于其自身的良好性质,碳点已广泛应用于生物成像[9-10]、药物输送[11]、光电和能量装置[12]、荧光油墨[13]、光催化[14-16]和传感器等领域[17]。碳点可以通过自上而下(激光烧蚀、化学气相沉积等)和自下而上(水热、电沉积、溶剂热等)的方法合成,主要来自化学和绿色资源的各种前体[18-19]。
本研究以马铃薯为碳源,通过一步水热法合成碳点[4],再将铽与碳点在室温下搅拌,最终制备成铽掺杂的碳点。所合成的碳点富含羟基、羧基等,容易进行后续的改性和应用。此外,还探索了铽掺杂的碳点在光催化条件下对大肠埃希菌的抑制作用,及其对大肠埃希菌进行荧光标记的可行性[20-21],旨在为进一步利用碳点开展微生物抑菌提供理论依据。
1 材料与方法
1.1 试剂
蛋白胨、酵母粉、琼脂、葡萄糖,生物试剂,北京索莱宝科技有限公司;氯化钠,分析纯,天津市风船化学试剂科技有限公司;三氯化铽六水合物,上海麦克林生化科技有限公司;马铃薯,购于当地超市。
1.2 仪器
UV-2550型紫外可见分光光度计(日本,岛津公司),TENSOR27型傅里叶变换红外光谱仪(德国,BRUKER公司),G9800A型荧光分光光度计(美国,安捷伦公司),TecnaiG2TF30型场发射透射电子显微镜(TEM)(荷兰,FEI公司),THZ-100型恒温培养摇床(上海一恒科学仪器有限公司),VS-1300型洁净工作台(苏州净化设备有限公司),Thermo Scientific 3913型恒温培养箱(美国,Thermo Scientific公司),YXQ-LS-75G型灭菌锅(上海博迅实业有限公司),120 mL聚四氟乙烯内衬水热反应釜(上海一凯仪器设备有限公司),FA1004型电子分析天平(上海精密科学仪器有限公司),S-4800 FE型场发射扫描电子显微镜(SEM)(日本,Hitachi公司),TCS-SP5型共聚焦激光扫描显微镜(CLSM)(德国,Leica公司)。
1.3 供试菌种
选用的菌种为大肠埃希菌(Escherichiacoli),系革兰氏阴性致病菌。
1.4 铽掺杂碳点(Tb-CDs)的制备
称取马铃薯干粉3 g,加入100 mL去离子水中,将得到的悬浮液加入到120 mL聚四氟乙烯内衬水热反应釜的内衬中,将其放入马弗炉中在180 ℃条件下加热6 h,自然冷却至室温后,将得到的溶液以8 000 r·min-1的转速离心10 min以去除不溶于水的大颗粒物质,再用0.22 μm的滤膜过滤掉大分子物质。最后,将得到的溶液在60 ℃真空干燥箱中干燥,得到CDs固体粉末。
将三氯化铽配制成浓度0.1 mol·mL-1的溶液。称取0.2 g的CDs固体粉末溶于20 mL去离子水中制备CDs溶液,将制备的CDs溶液和5 mL的三氯化铽溶液加入三颈烧瓶中,在室温下磁力搅拌5 h,所得到的溶液即为Tb-CDs溶液,置于60 ℃真空干燥箱干燥,得到Tb-CDs固体粉末。
1.5 抑菌实验
1.5.1 菌体活化与菌液制备
将冷冻保存的大肠埃希菌菌种与5 mL菌种所需的液体培养基进行混合,于37 ℃、200 r·min-1的条件下在摇床上培养12 h。血球计数板计数菌液浓度(控制大肠埃希菌的菌液浓度为1×106CFU·mL-1)。
1.5.2 抑菌材料的光催化抑菌实验
将Tb-CDs、CDs分别加入含有5 mL菌液的石英试管中混合均匀,Tb-CDs的质量浓度分别为0.2、0.4、0.6、0.8、1.0 mg·mL-1,CDs的质量浓度为0.6 mg·mL-1。随后,将样品溶液置于可见光下照射不同的时间间隔,判断抑菌剂的抑菌效果。在无光照条件下重复相同的实验步骤。此外,在相同条件下开展不加Tb-CDs、CDs的空白实验(CK)
1.5.3 稀释平板计数法计算Tb-CDs对大肠埃希菌的抑菌率
在超净工作台上,将LB培养基(121 ℃灭菌20 min)倾斜倒入培养基平板上,待其凝固。将100 μL含有碳点的菌液加到已凝固的培养基平板上,再用涂布器快速将其均匀涂布,37 ℃培养箱中倒置培养12 h。每组实验均做3个平行。用平板计数法计算每个平板菌落的数量。计算每组实验中3个平行实验的菌落数平均值,作为该组实验的最终菌落数。计算Tb-CDs对大肠埃希菌的抑菌率。
1.6 Tb-CDs对大肠埃希菌的荧光标记
将大肠埃希菌在LB培养基中孵育。大肠埃希菌菌悬液与Tb-CDs在37 ℃无光振荡培养2 h,4 000 r·min-1离心收集大肠埃希菌菌体。然后,用无菌磷酸缓冲盐溶液(PBS)洗涤大肠埃希菌菌体,4 000 r·min-1离心6次以除去未进入细菌细胞的培养基和Tb-CDs,分别在405、488、555 nm激发波长的CLSM上进行荧光成像。
2 结果与分析
2.1 Tb-CDs的透射扫描电镜、红外、紫外、荧光光谱
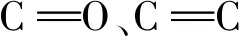
由紫外吸收光谱(图2)可知,Tb-CDs的紫外吸收范围较宽,在300 nm和375 nm处有最大吸收峰,分别是Tb-CDs SP2区域的π-π*、n-π*跃迁[24-25]。
如图3-a所示,Tb-CDs的最大激发波长和最大发射波长分别是360、442 nm,即在激发波长为360 nm时,该碳点的最大发射波长为442 nm。在自然光下,Tb-CDs溶液呈淡黄色;在紫外灯照射下,Tb-CDs溶液呈现明亮的蓝色荧光。图3-b为Tb-CDs在不同激发波长下的发射波长,可以看出,Tb-CDs在激发波长为360 nm处有最大发射波长。
2.2 Tb-CDs和CDs对大肠埃希菌的光催化抑菌效果
探究Tb-CDs(0.6 mg·mL-1)分别在无光和光照条件下对大肠埃希菌的抑菌效果。如图4-a所示,Tb-CDs对大肠埃希菌的抑菌作用在无光条件下不明显,光照40 min时抑菌作用明显。图4-b为大肠埃希菌在Tb-CDs无光和光照(40 min)处理下活菌数的对数值,结果显示,Tb-CDs在可见光照射下能将大肠埃希菌杀死,有较强的抑菌效果。
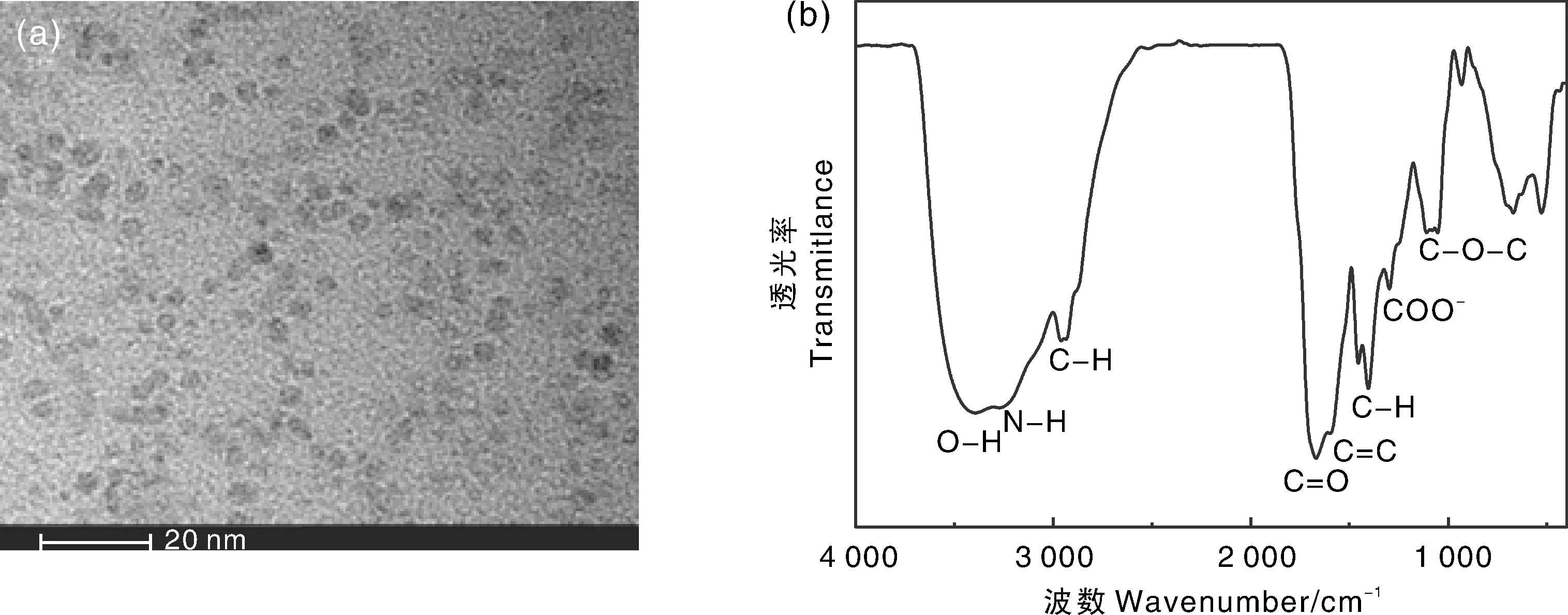
图1 Tb-CDs的TEM图像(a)和红外光谱图(b)Fig.1 Transmission electron microscope image (a) and Fourier transform infrared spectrum (b) of Tb-CDs
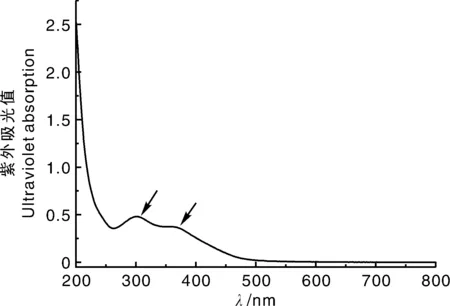
图2 Tb-CDs的紫外光谱Fig.2 Ultraviolet-vis absorption spectrum of Tb-CDs
将Tb-CDs和CDs对大肠埃希菌的抑菌效果进行对比。如图5所示,在相同质量浓度下(0.6 mg·mL-1),CDs对大肠埃希菌的抑制作用随着光照时间延长没有明显变化,抑菌效果不明显;而Tb-CDs对大肠埃希菌的抑制作用随着光照时间的延长显著增强。当光照时间为60 min时,Tb-CDs对大肠埃希菌的抑菌率达到了100%,明显大于CDs对大肠埃希菌的抑菌率。
2.3 不同质量浓度Tb-CDs对大肠埃希菌的光催化抑菌效果
探究Tb-CDs在不同质量浓度(0.2、0.4、0.6、0.8、1.0 mg·mL-1)下对大肠埃希菌的抑菌效果。如图6所示,Tb-CDs对大肠埃希菌的抑菌率随着碳点质量浓度的增加而增大,当碳点的质量浓度达到0.6 mg·mL-1时,其对大肠埃希菌的抑菌率最大;之后,进一步增加Tb-CDs的质量浓度时,其对大肠埃希菌的抑菌率没有明显变化。

图3 Tb-CDs的荧光光谱(a)和光致发光发射光谱(激发波长为310~400 nm)(b)Fig.3 Fluorescent spectra (a) and photoluminescent emission spectra (excitation wavelength of 310-400 nm) (b) of Tb-CDs

图4 大肠埃希菌在Tb-CDs无光和光照(40 min)处理下菌落的生长情况(a)及其活菌数量(b)Fig.4 Growth (a) and bacterial quantity (b) of E. coli under dark and light (irradiation of 40 min) enviroment with Tb-CDs

图5 大肠埃希菌在CDs(a)和Tb-CDs(b)处理下菌落的生长情况及其细胞数量变化(c),和Tb-CDs与CDs对大肠埃希菌的抑菌率(d)Fig.5 Colony growth of E. coli treated with CDs (a) or Tb-CDs (b) and changes of bacterial quantity (c), and antibacterial rate of CDs or Tb-CDs against E. coli(d)

图6 不同质量浓度的Tb-CDs对大肠埃希菌菌落生长(光照60 min)的影响(a)及其对大肠埃希菌抑菌率的动态变化(b)Fig.6 Colony growth of E.coli under different concentrations of Tb-CDs (irradiation of 60 min) (a) and dynamics of antibacterial rate of different concentrations of Tb-CDs against E.coli(b)
2.4 Tb-CDs对大肠埃希菌的光催化抑菌机制分析
Tb-CDs对大肠埃希菌的光催化抑菌作用归因于活性氧(ROS)的影响,如羟基自由基(HO·)、超氧离子(O2·-)、空穴(h+)等[16,26-27]。如图7所示,在可见光照射下,电子从Tb-CDs的价带转移至导带,从而形成e--h+对。游离的e-可与O2反应生成O2·-,而h+则与—OH结合产生HO·。该反应过程中产生的光生e-、h+和自由基可破坏细胞包膜的完整性,并导致其死亡。
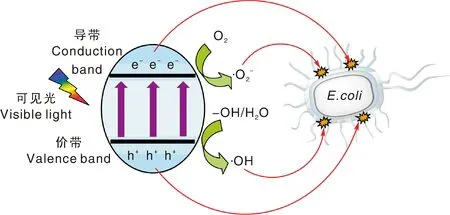
图7 在可见光照射下Tb-CDs光催化灭活大肠埃希菌的示意图Fig.7 Schematic of photocatalytic inactivation of E. coli by Tb-CDs under visible-light irradiation
通过SEM观察微生物表面的形状变化[28]。图8-a显示了光催化抑菌前大肠埃希菌的SEM图像,从中可以观察到保存完好的细胞壁。如图8-b、c所示,在光催化条件下,Tb-CDs加入后,大肠埃希菌的细胞壁开始起皱收缩,细胞壁变形,在细胞壁表面出现多处小的凹坑和突出点,照射结束时,几乎整个细胞表面都被孔隙占据,导致细菌细胞完全扭曲。这表明,在光催化抑菌过程中,Tb-CDs与大肠埃希菌的细胞壁有多个相互作用位点,从而导致细胞壁的破坏。其破坏机理可能是,在抑菌过程中,Tb-CDs与大肠埃希菌细胞相互接触,并在光照条件下产生自由基,自由基作用于细胞的磷脂层,细胞被破坏,进而诱发细胞膜渗透性的改变[29],细胞外的物质进入细胞,导致细胞失活,最终引发细胞死亡。
2.5 Tb-CDs对大肠埃希菌的荧光标记
Tb-CDs具有优异的荧光性能和良好的生物相容性,因此可以作为荧光探针来对大肠埃希菌进行荧光标记。Tb-CDs的尺寸小,大肠埃希菌能很好地摄取Tb-CDs。本研究利用CLSM验证了Tb-CDs对大肠埃希菌的标记。大肠埃希菌在与Tb-CDs孵育2 h后,表现出强烈的荧光。如图9所示,将其分别在405、488、555 nm波长下激发时,可分别观察到蓝、绿、红等多色荧光,说明利用Tb-CDs可以对大肠埃希菌进行荧光标记。

图8 大肠埃希菌(a)及与Tb-CDs在光照下共存40 min(b)的SEM图像Fig.8 Scanning electron microscope image of E.coli(a) and E.coli treated with Tb-CDs (b, c) under irradiation of 40 min
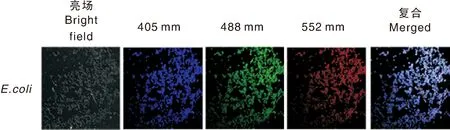
图9 Tb-CDs标记的大肠埃希菌的荧光图像Fig.9 Fluorescent images of E. coli labeled with Tb-CDs
3 结论
以马铃薯为原料,通过一步水热法合成了CDs,再将稀有金属铽与CDs通过室温搅拌,混合后合成了Tb-CDs。通过透射扫描电镜、紫外光谱、红外光谱、荧光光谱等对Tb-CDs的形态结构进行表征,并以革兰氏阴性菌——大肠埃希菌为模型,研究了Tb-CDs的光催化抑菌性能。结果显示,在光照条件下,Tb-CDs能有效地抑制大肠埃希菌的生长,并显示出良好的抑菌效果。此外,Tb-CDs还可以对大肠埃希菌进行荧光标记,在不同激发波长下显示出不同颜色的荧光。本研究不仅拓宽了碳点的制备方法,而且也为碳点的功能化和生物应用奠定了基础。
