秀珍菇原基形成相关基因PpFBD1的克隆与表达研究
2020-03-07王伟科宋吉玲袁卫东陈观平
王伟科,宋吉玲,陆 娜,袁卫东,闫 静,陈观平
(1.杭州市农业科学研究院,浙江 杭州 310024; 2.浙江省中医药研究院,浙江 杭州 310012)
食用菌从营养生长转变为生殖生长需经历菌丝萌发到原基扭结再分化成子实体这一形态上的巨大变化,其中原基扭结形成是菌丝体向子实体转变的一个重要节点。但食用菌原基形成分化机制目前尚不明确,因此开展与食用菌结实相关基因的研究对于了解食用菌子实体生长发育机理、选育品种及控制出菇环境均具有重要意义。
分子生物学和生物信息学的快速发展,为食用菌子实体发生的分子机理研究提供了新思路和新方法,使子实体发生的遗传机制研究取得了重要进展[1]。马爱民等[2]采用RAP-PCR差异显示技术对平菇菌丝体及原基、菇蕾和成熟子实体进行研究,获得了在原基阶段差异表达的3条cDNA片段POD1、POD2与POD3,其中POD3片段为HSP70基因片段,说明热激蛋白在原基形成期起到重要作用。Yamada等[3]利用荧光差异显示技术在金针菇(Flammulina.velutipes)中发现了Fv-hyd1基因(编码疏水蛋白),Northern杂交结果表明,该基因在菌丝生长期不表达,但在原基形成期间表达量显著升高,同时在子实体成熟期表达水平也较高,从而推测其对金针菇结实具有调控作用。韩星、仝宗军等[4-5]基于金针菇转录组数据对转运蛋白基因fvopt1、fvopt2以及fv-mfs1开展序列和表达分析,发现上述基因在金针菇原基和子实体发育过程中发挥作用。周烁红等[6]从构建的肺形侧耳变温结实相关消减杂交文库中筛选到一个代表csl基因部分序列的EST,并通过TAIL PCR技术克隆了Pp-csl1基因,荧光定量检测结果表明,该基因在菌丝经过5 ℃ 12 h冷处理之后的表达量最高,说明其有可能被冷刺激诱导表达并在子实体形成过程中起重要作用。上述研究均为揭示子实体发生的遗传机制奠定了基础。
本实验前期研究中对秀珍菇低温诱导后样本及恢复到室温后原基形成前期样本进行转录组测序,并对其中的差异表达基因进行分析,发现基因ID为Cluster-6377.64510的基因(命名为PpFBD1)在原基形成前期的样本中高度表达,经基因注释及Swissprot描述,推测其很可能在原基形成中起重要作用。同时,利用生物信息学技术获得该基因的序列全长,并设计合成了相关引物,利用逆转录PCR技术首次克隆了该基因,并对基因序列、表达和功能进行了初步分析,为进一步深入研究该基因及其可能参与的原基形成调节功能提供参考。
1 材料与方法
1.1 材料与处理
秀珍菇菌株台秀5766由浙江临安鼎新生物科技有限公司提供。母种采用PDA培养基。菌包培养基配方为杂木屑400 g·kg-1、棉籽壳400 g·kg-1、麸皮180 g·kg-1、石膏10 g·kg-1、石灰10 g·kg-1。菌包接种后于26~28 ℃条件下避光培养,待菌丝长满菌包后(40~45 d),选取生长良好、状态一致的菌包开展试验。取样分4组,每组10包,分别记为S0、S1、S2、S3。
S0,菌丝满袋后,挑取发菌良好的菌包料面菌丝体10 g,立即置于-80 ℃超低温冰箱保存;S1,菌丝满袋后,发菌良好的菌包置于10 ℃条件下12 h,按S0方法取样保存;S2,菌丝满袋后,发菌良好的菌包置于10 ℃ 条件下12 h,再待其恢复到室温状态后,按S0方法取样保存;S3,经S0、S1、S2阶段后,原基形成期取原基10 g,立即置于-80 ℃超低温冰箱保存。
1.2 试验方法
1.2.1 总RNA的提取
采用Trizol法进行样本总RNA的提取[7],样本经液氮研磨后Trizol裂解,离心弃沉淀,上清加入氯仿/异戊醇,振荡混匀,离心。上清加入1∶1的异丙醇,沉淀RNA。离心弃上清,沉淀经75%乙醇洗涤后溶于50 μL DEPC水中。
1.2.2 cDNA的合成
总RNA经1.2%琼脂糖凝胶电泳及核酸分析仪检测纯度和浓度后,按照Bio-Rad公司的iScript cDNA Synthesis Kit合成cDNA。
1.2.3 基因克隆
根据RNA-seq测序结果,选取PpFBD1基因序列。并运用引物设计软件Primer Premier 5.0设计相关引物如下:上游引物为5'-ATGTTCTCCATCCGCATCTCC-3',下游引物为5'-CGCCCATCAAACTCCTCTAA-3'。
以反转录后获得的cDNA为模板进行PCR扩增,以Thermo Fisher的AccuPrimePfxDNA Polymerase为扩增酶,建立25 μL反应体系:10×Pfx缓冲液2.5 μL,50 mmol·L-1MgSO40.5 μL,25 mmol·L-1dNTP 1.0 μL,10 mmol·L-1引物各1.0 μL,cDNA模板5.0 μL,PfxDNA Polymerase 0.5 μL,ddH2O 13.5 μL。
反应条件为:93 ℃预变性3 min;93 ℃ 30 s,53 ℃ 30 s,72 ℃延伸30 s,30个循环;72 ℃延伸7 min。扩增产物经1.2 %琼脂糖电泳后,用DNA胶回收试剂盒纯化回收。连入T载体(PMD18-T,TaKaRa),转化大肠埃希菌菌株JM109,蓝白斑筛选,提取质粒DNA进行酶切鉴定,阳性克隆送北京擎科生物技术有限公司测序。
1.2.4 基因的生物信息学分析
主要采用http://www.ncbi.nlm.nih.gov/blast、http://www.bio-soft.net/sms/index.html、http://amigo.geneontology.org/、http://www.uniprot.org 等网上软件包进行生物信息学分析。使用Vector NTI软件对序列进行多重比对,并用MEGA 5.0软件构建进化树。
1.2.5 基因表达分析
试剂盒提取秀珍菇S0、S1、S2、S3四个阶段总RNA,并按照iScript cDNA Synthesis Kit合成cDNA,根据PpFBD1基因序列设计出特异性qRT-PCR引物(表1),以Actin作为内参基因,用qRT-PCR的方法检测PpFBD1基因在秀珍菇不同采样阶段的相对表达量[8]。PpFBD1和Actin的退火温度均为53 ℃,每个样品设3重复。按2-ΔΔCt法计算基因相对表达量。
2 结果与分析
2.1 PpFBD1序列的获得及序列分析
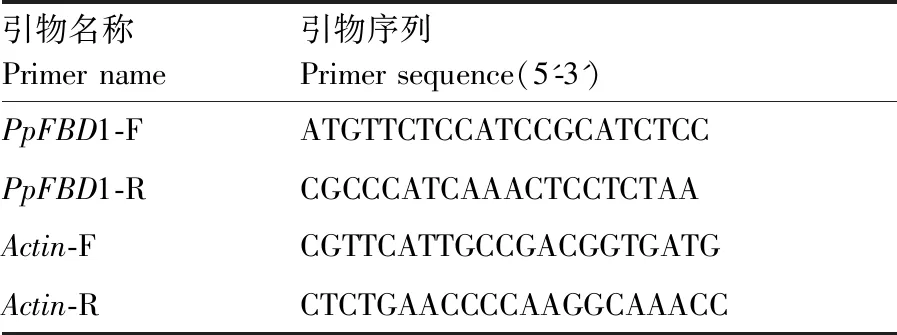
表1 qRT-PCR反应引物序列Table 1 Primer sequence of qRT-PCR
利用RT-PCR技术从秀珍菇中得到350 bp左右的DNA片段,克隆至PMD18-T载体后测序,将测序结果与GenBank中登录基因进行同源性比较分析,获得342 bp全长序列,命名为PpFBD1。BLAST显示其与糙皮侧耳hydrophobin1基因(GenBank:Y14656.1)100%相似。
通过ORF Finder寻找PpFBD1的开放读码框,显示其包含1个342 bp的ORF框,推断其为编码113个氨基酸的功能蛋白。由Vector NTI软件推算该编码蛋白的相对分子质量约为11 ku。SMART工具预测显示该蛋白质C端含有一个由77个氨基酸组成的保守区域(HYDRO),说明所获基因属于疏水蛋白家族。
2.2 PpFBD1基因编码蛋白系统进化分析
利用MEGA5.0 软件对秀珍菇PpFBD1基因编码氨基酸序列开展进化树分析,显示秀珍菇PpFBD1编码的蛋白与糙皮侧耳同源蛋白亲缘关系最近,与其他真菌同源蛋白的亲缘关系较远(图1)
2.3 PpFBD1的GO功能分析
GO功能分析显示,PpFBD1编码蛋白为细胞壁的结构成分(图2),其主要参与了真菌类细胞壁的合成。
2.4 不同生长阶段秀珍菇PpFBD1的表达情况
在秀珍菇生长发育过程中的4个不同阶段PpFBD1均有表达。其中,S1阶段(低温刺激阶段)PpFBD1的表达量要高于S0阶段,说明低温刺激对PpFBD1的表达起一定程度的诱导作用;而S2阶段(原基形成前期)PpFBD1的表达量明显要高于S0及S1阶段,说明PpFBD1虽然受一定程度的低温诱导,但更有可能是原基形成的小分子诱导蛋白;S3(原基形成期)阶段其表达量又有所下降,进一步说明其可能在促使原基扭结形成这一过程中发挥重要作用。

图1 秀珍菇PpFBD1基因编码氨基酸系统进化树Fig.1 Phylogenetic tree of the amino acid encoded by PpFBD1 of Pleurotus pulmonarius
图2 PpFBD1蛋白的亚细胞定位Fig.2 Subcellular location of protein encoded by PpFBD1 of Pleurotus pulmonarius
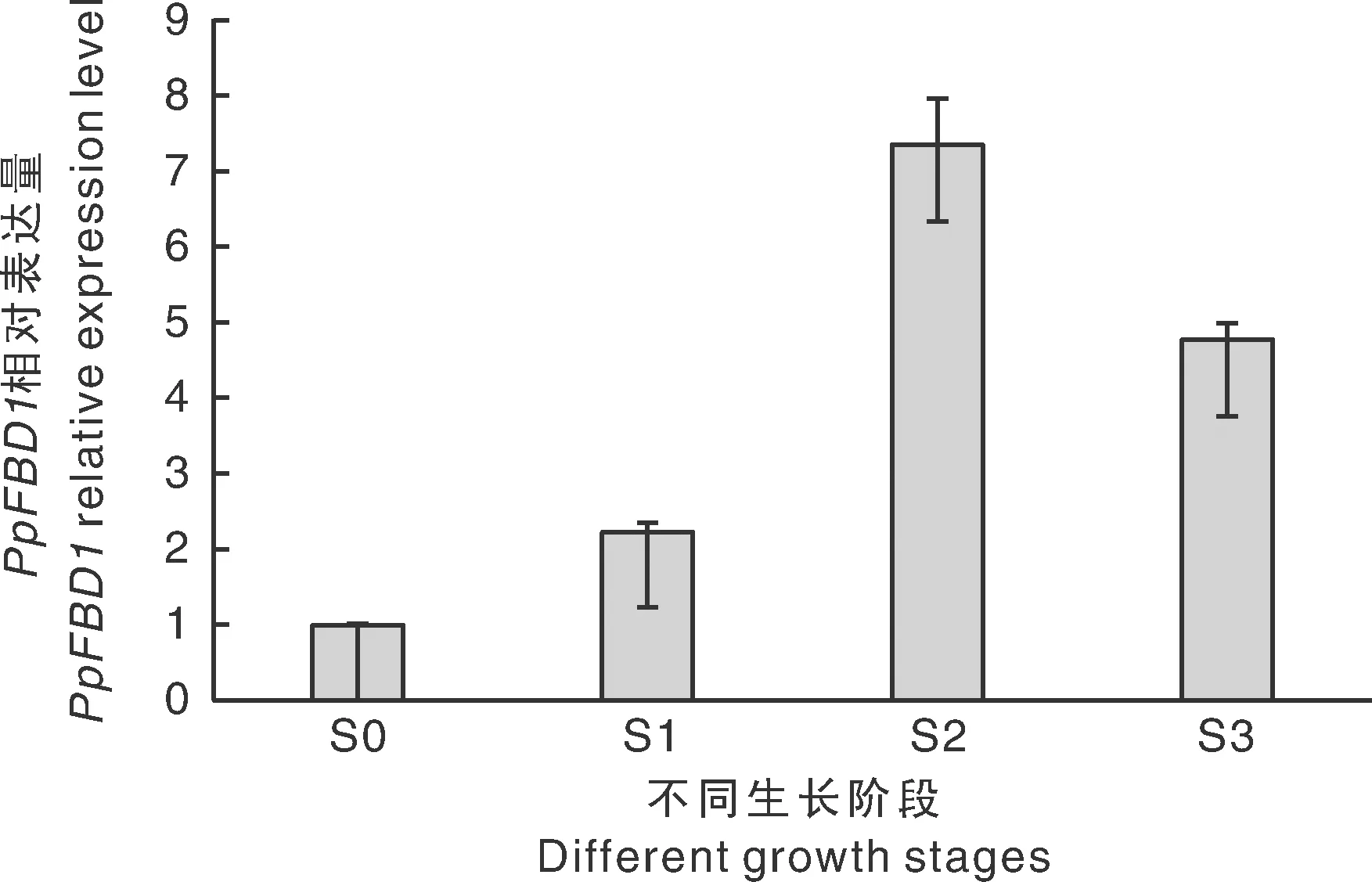
图3 PpFBD1在秀珍菇不同生长阶段表达量Fig.3 Relative expression of PpFBD1 gene in different growth stages
3 讨论
秀珍菇作为一种具有重要经济价值、食用价值和营养价值的食用菌类,其子实体发育分子机制的研究及发育相关功能基因的鉴定分析一直是一项复杂且具有重要理论和实际意义的工作[9-11]。
本研究基于秀珍菇转录组测序结果,发现PpFBD1在原基形成前期的样本中高度表达。利用RT-PCR技术从秀珍菇中克隆了该基因,测序获得核酸序列并推测了其蛋白序列。比对发现该基因序列与糙皮侧耳hydrophobin1基因一样。蛋白质序列包括一个HYDRO疏水保守区域,说明该基因编码的蛋白为疏水蛋白。
研究表明,疏水蛋白具有诱导形态发育等相关功能,疏水蛋白作为天然表面活性剂,可降低水表面张力,从而使真菌菌丝突破水-空气界面,进而诱导产生气生菌丝结构[12-13]。Ohm等[14]通过裂褶菌(Schizophyllumcommune)的基因组和表达谱分析发现,在裂褶菌子实体生长发育过程菌丝扭结阶段,与疏水蛋白相关的基因表达均出现不同程度的升高,这表明疏水蛋白在子实体生长发育过程中直接或间接起着重要作用。陈仁良等[15]通过分析金针菇不同生长发育阶段的表达谱,发现疏水蛋白Fv-Hyd1的表达在菌丝扭结阶段和原基期均升高,且远高于其他时期,这与本次我们在秀珍菇中的研究结果相似。
本研究中发现的PpFBD1编码的蛋白为小分子疏水蛋白,在秀珍菇营养生长到生殖生长的不同阶段表达量存在明显差异,低温处理后原基形成前期表达量明显要高于其他3个时期,这说明其可能与原基形成和分化有关,具体功能有待深入研究。
