肝内型门脉高压相关基因功能和信号通路的分析
2020-03-05
肝星状细胞(HSC)活化及其向肌成纤维母细胞转化在肝内型门脉高压发病中起着重要作用[1]。HSC位于肝细胞板与肝窦之间的Disse间隙内,Disse间隙借肝窦内皮细胞“窗孔”与肝窦相通。在健康者肝脏中,HSC处于静息状态,尽管静止的HSC没有较强的舒缩能力,但其足以通过改变肝窦容积来调节肝内血流[2]。 然而,在肝炎病毒等各种肝损伤因素作用下,HSC增殖、活化,生物学功能发生改变,活化的HSC一方面通过分泌细胞外基质(ECM)参与纤维化的形成和肝内结构的重建,从而形成对中央静脉和门静脉的机械挤压,另一方面通过自身收缩,使肝窦及其流出道受阻,增加肝内血管阻力。此外,肝损伤时,缺氧刺激HSC分泌大量血管活性生长因子,导致向肝性的血流量急剧增加。这两类变化奠定了肝内型门脉高压发病的病理学基础[3]。 因此,以活化HSC为靶点,对其信号通路和相关基因进行干预,将为药物调节门脉高压提供理论基础。
HSC活化后发生一系列表型改变是多因素长期作用后形成的复杂的病理改变,其调控机制是研究难点。本研究应用二代高通量测序技术对cDNA进行测序和生物信息学分析,为全面研究HSC内信使RNA(mRNA)在肝内型门脉高压形成中的作用奠定了可信的基础,为后续相关药物靶点的开发提供了方向和前景。
1 材料与方法
1.1 材料
雄性大鼠3只,清洁级,体质量为400~500 g。链酶蛋白酶和Ⅰ、Ⅳ型胶原酶:Sigma 公司产品。0.25%胰蛋白酶+1 mmol/L乙二胺四乙酸钠消化液:Gibco公司产品。DMEM培养基:Gibco公司产品。高通量测序仪(二代高通量测序技术):Illumina Hiseq 2000/2500、Miseq。
1.2 方法
1.2.1 大鼠原代HSC的分离培养及鉴定 麻醉大鼠,注入1 g/L链酶蛋白酶,经密度梯度离心后,置于DMEM中培养,取静止期2 d和活化期14 d培养的HSC,分别进行Desmin免疫荧光染色,并用于下游实验。
1.2.2 二代测序和数据分析 HSC总RNA提取,对纯化后的总RNA进行rRNA去除、片段化、第一链cDNA合成、第二链cDNA合成、末端修复、3′末端加A、连接接头、富集等步骤,完成测序样本文库构建。高通量测序仪(二代高通量测序技术)对cDNA进行测序。所建文库使用荧光定量仪检测浓度,生物芯片分析系统检测文库的大小。按照所示相应流程,在Illumina测序仪上完成第一向测序引物杂交。按照Illumina测序仪用户指南准备测序试剂后上机,进行双端测序。测序过程由 Illumina测序仪提供的数据收集软件进行控制,并进行实时数据分析。数据量约10 G/样本,每个碱基质量>20(Q20)的比例≥90%。
1.2.3 生物信息学分析 差异表达基因的富集分析(https://david.ncifcrf.gov/home.jsp):首先对生物过程、细胞成分、分子功能这3个层次上对应的差异基因数目进行统计,然后进行GO富集分析,GO富集分析的结果以散点图的方式展示。其中富集度=(某个基因功能中差异基因的数目/能够对应到基因功能数据库中的所有差异基因的数目)/ (某个GO term中包含的基因数目/能够对应到GO数据库中的总的基因数目),富集度越大表示富集的程度越大。Q值是多重假设检验校正之后的P值,值越小表示富集越显著。同样的,KEGG信号通路分析对各条信号通路上的差异表达基因数目进行统计,同时对差异基因进行KEGG通路富集分析。
1.3 统计学分析
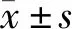
2 结果
2.1 HSC的鉴定
参照Friedman等[4]的密度梯度离心法分离HSC,从每只大鼠收获HSC(5×107),分离的细胞在48 h显示圆形形态。逐渐在7~14 d培养后实现活化,通过台盼蓝染色活性>95%。通过Desmin免疫荧光染色检查证实静息(2 d)和活化(14 d)HSC的纯度>95%,见图1。
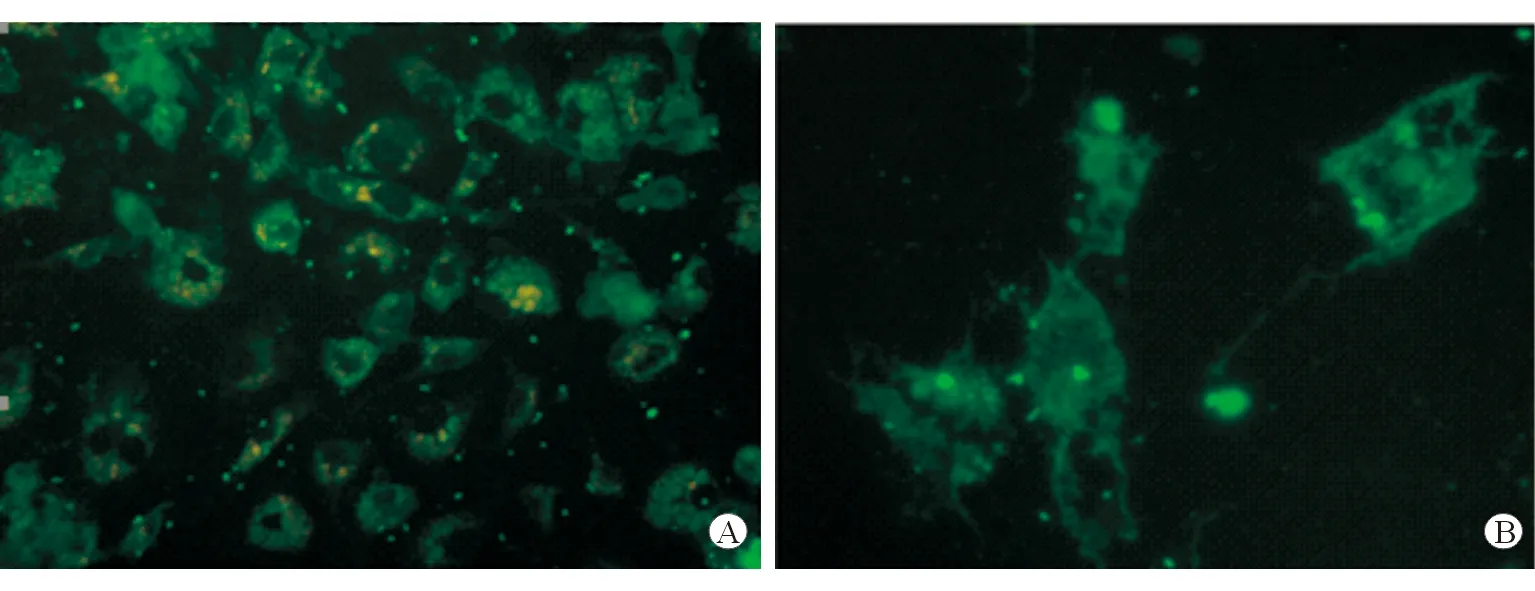
图1 HSC的Desmin免疫荧光染色图 ×400 A 2 d B 14 d
2.2 差异mRNA的筛选
原始数据先应用Seqtk(https://github.com/lh3/seqtk)进行过滤,得到可用于数据分析的clean Reads,再进一步归一化,应用edgeR[5]进行样本间差异基因分析,按Q值≤0.05和Fold-change≥2筛选,结果提示HSC的mRNA测序分析中差异表达mRNA共有529种,其中上调的有155种,下调的有374种。采用TreeView统计软件进行聚类分析,聚类结果见图2。

图2 差异基因聚类分析
2.3 生物信息学分析
HSC转型过程中,上调的基因功能分类中(见图3),以离子转运、基因转录调控、细胞增殖迁移、有丝分裂信号通路富集度较高;下调的基因功能中,以凋亡、脂质代谢、血管生成、碳水化合物代谢过程等富集度较高,说明基因分布的差异导致了这些功能分布的异常,从而进一步促进静止期和活化期HSC的表型转化。进一步对HSC表型转变过程中差异基因归属信号通路进行分析(见图4),发现转化生长因子(TGF-β)和血管内皮生长因子(VEGF)这两条信号通路富集度较高,可能在HSC活化过程中发挥重要的作用。
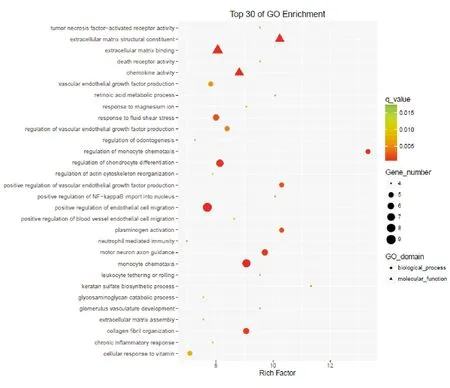
图3 HSC差异表达基因的GO富集散点图

图4 HSC差异表达基因的KEGG信号通路
3 讨论
门脉高压症(PHT)是一组由于血流量增加和(或)门脉系统血流受阻,导致门静脉及其属支血管压力升高的症候群,其并发症的治疗较困难,死亡率较高,如食管胃底静脉曲张破裂导致的上消化道大出血, 其首次出血死亡率达40%~80%[6]。近年来的研究证明,肝脏门脉高压状态呈潜在进展趋势与HSC表型转变过程中基因动态表达密切相关[7]。因此,从HSC中动态表达的mRNA入手,早期发现并干预门脉高压状态进展的相关靶点及信号通路,将对延缓、防止乃至逆转肝内型门脉高压进展及其并发症的发生具有极为重要的意义。
本研究成功分离大鼠的HSC并进行相关指标鉴定,显示细胞纯度>95%,并在体外建立了静止与活化的HSC模型,以二代测序为平台初步研究了HSC表型变化过程中mRNA的表达谱, 发现在原代培养的静止期HSC与体外活化的HSC之间存在差异表达的mRNA共有529种,其中上调的有155种,下调的有374种。通过差异基因的功能分析,发现Bcl-2、BAX、Capspase都与凋亡有关[8-9];人端粒酶逆转录酶(hTERT)、VEGF等与细胞生长、增殖有关[10-11];还有部分与细胞信号通路及代谢活动相关,如丝裂原活化蛋白激酶(MAPK)等[12]。差异调控基因的功能分析显示与活化HSC密切相关的异常表型,如肌纤维母细胞转分化、活性增殖和抗凋亡,可能在HSC表型转变过程中发挥着重要的作用。
本研究进一步对HSC表型转变过程中差异基因归属信号转导通路进行分析,发现TGF-β和VEGF这两条信号通路在HSC活化过程中富集度较高。TGF-β/Smad通路主要介导HSC活化和增殖,在肝损伤早期,活化的HSC开始收缩,肝窦及Disse间隙受压,窦内及Disse间隙内压力上升,导致肝窦内压增高[13];在肝损伤后期,TGF-β家族介导HSC产生大量以Ⅰ、Ⅲ型胶原为主的ECM,并通过合成和分泌组织抑制金属蛋白酶(TIMP)抑制基质金属蛋白酶(MMP)的活性从而抑制ECM的降解[14]。因此,干预该信号通路,尤其是抑制TGF-β1信号转导分子的水平可能成为肝内型门脉高压防治的重要靶标。研究发现,门脉压力的高低还与肝窦微血管系统的重建直接相关,而VEGF家族在这一过程中发挥着重要的作用[15]。VEGF-A是迄今为止唯一被证明对血管形成有关键且特异性作用的生长因子[16]。HSC活化后,一方面通过自分泌或旁分泌方式表达VEGF,促进细胞过度增殖、活化[17];另一方面大量表达的VEGF与其在内皮细胞上的酪氨酸激酶受体(Flt-1,KDR/Flk)结合启动血管新生中的一个初始过程——出芽,形成未成熟的血管,从而导致肝内侧支循环形成,肝内分流增多,肝窦血流量剧增,最终使门脉压力升高[18]。体内实验也证明,肝损伤后肝窦血管化程度明显加重,且应用VEGF信号途径抑制剂能显著减少血管生成,改善肝窦微循环,可实现大鼠门脉高压的逆转[19]。因此,如能对上述信号通路的关键基因进行联合调控,无疑将发挥显著的协同效应,可明显降低肝内阻力,减轻肝内分流,最终达到降低门脉压力的效果。
综上所述,本研究首次以二代测序技术筛选出HSC转型过程中mRNA的差异表达谱,深入挖掘了mRNA在肝内型门脉高压中的基因功能和相关信号通路,为今后开展对筛选出的慢性肝病治疗靶点研究奠定了基础。
